乳酸菌与酵母菌的复配筛选及在传统泡菜中应用
2023-08-13付竹贤王淑敏璠1
陈 偲,张 明,付竹贤,王淑敏,罗 璠1,,
(1.西南民族大学青藏高原动物遗传资源保护与利用四川省教育部重点实验室,四川成都 610041;2.西南民族大学青藏高原研究院,四川成都 610041;3.西南民族大学畜牧兽医学院,四川成都 610041)
乳酸菌和酵母菌是发酵产品中发挥重要作用的微生物类群,它们通过相互作用,共同发酵促成发酵食品成熟,提高挥发性风味物质,改善感官评价[1],增加发酵食物不饱和脂肪酸、促进消化、增加食欲等[2]。这种天然混合发酵体系在传统食品发酵中广泛存在,例如酸面团[1]、泡菜[2]、传统发酵豆酱[3]、传统发酵酸奶[4]、葡萄酒[5]等。在食品工业生产中也多有应用,利用乳酸菌和酵母菌发酵饲料[6]、苹果汁[7]、杂粮面包[8]、富麸馒头[9]等。但乳酸菌和酵母菌相互作用研究表明,在共培养体系中既存在协同(互促)作用,也存在拮抗(互抑)作用[10]。如Xu 等[11]在水开菲尔中发现霍尔迪乳酸杆菌(Lactobacillus hordei)和酿酒酵母(Sacchromyces cerevisiae)通过代谢产物的交换促进各自的生长。Branco 等[12]通过质谱分析发现酿酒酵母细胞凋亡可产生抗微生物肽(antimicrobial peptides,AMPs),并对葡萄酒中的乳酸菌等产生抑制作用[13]。Carbonetto 等[14]通过面团的共培养发酵发现乳酸菌的存在阻碍了酵母菌的生长,在碳代谢过程中表现出潜在的竞争关系。
在乳酸菌与酵母菌混合发酵体系中,当菌株间作用为相互促进时,可提高发酵效率并获得更为丰富的代谢产物,菌株之间的良性互动也有益于提升发酵食品的品质[15]。但乳酸菌与酵母菌之间的互作关系,也可能表现为营养竞争、相互抑制的拮抗作用,影响最终发酵效果[16]。因此在乳酸菌与酵母菌混合发酵应用前,应深入分析复配菌组间的互作关系,使发酵应用效果最佳化。
泡菜口感脆爽,风味独特,是主要的蔬菜发酵产品。泡菜发酵过程中,乳酸菌起主导作用并含有酵母菌辅助发酵,其熟制加工方式为冷加工,对营养物质有较好保留,同时富含益生菌,使其具有开胃、健脾、促消化、降低胆固醇、抗动脉硬化、抗肥胖作用等功效[17-18],目前国内发酵泡菜中微生物研究多集中于菌群分布及自然发酵泡菜与人工接种发酵泡菜发酵效果比较[19-20],筛选复配优势菌株组合再进行泡菜人工接种发酵的研究鲜有报道。基于此,本研究拟分析不同组合乳酸菌和酵母菌复配的相互关系,筛选菌株组合,将其应用在泡菜发酵实验中,为筛选发酵性能较强的菌株组合及人工接种发酵泡菜的工业化生产,提供一定的理论参考依据。
1 材料与方法
1.1 材料与仪器
实验菌株 信息见表1,采用传统分离纯化方法从自然发酵泡菜及酸乳样品中,分离得到13 株乳酸菌和酵母菌,通过形态学特征、生理生化实验、16S rDNA 和26S rDNA 序列分析,对菌株种属进行鉴定,前期实验表明,同类型所选菌株生长速度与产酸性能较接近[21];新鲜大白菜(Brassica rapa pekinensis)、泡菜盐 均为市售;MRS 培养基、酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD)、改良查尔莫斯培养基(Modified Chalmers Agar,MC),孟加拉红培养基 青岛海博生物技术有限公司;水葡萄糖 分析纯,天津奥普升有限公司;盐酸 分析纯,成都市科隆化学品有限公司;亚甲蓝、硫酸铜、冰乙酸、氢氧化钠、乙酸锌、酚酞、亚铁氰化钾、正辛醇、硫酸锌、氨水、活性炭、酒石酸钾钠均为分析纯,成都金山化学试剂有限公司。

表1 实验菌种信息Table 1 Experimental strains information
ST16R 高速冷冻离心机 赛默飞世尔科技有限公司;GH6000 电热恒温培养箱 天津泰斯特设备有限公司;SHKE6000-8CE 恒温振荡摇床 美国Thermo Scientific 有限公司;紫外可见分光光度计UV1900上海佑科仪器;ELX-800 酶标仪 美国伯腾仪器有限公司;R40-IIB2 超净工作台 中国青岛海尔有限公司;GI54DW 高压蒸汽灭菌锅 厦门致微仪器有限公司;雷磁pHS-25 酸度计 上海仪电科学仪器股份有限公司;WY-01 电热炉 浙江伟远工贸有限公司。
1.2 实验方法
1.2.1 无菌代谢产物制备 参照刘敏敏等[22]方法并改进。将活化好的乳酸菌(1×108CFU/mL)以1%的接种量接种于MRS 液体培养基中,30 ℃静置培养24 h;将活化好的酵母菌(4×106CFU/mL)以1%的接种量接种于YPD 液体培养基中,30 ℃静置培养24 h。发酵液在6000 r/min 离心15 min,取上清,用1 mol/L 的NaOH 溶液调节pH 至6.0,0.22 μm 滤膜过滤除菌,得无菌代谢产物,4 ℃保存备用。
1.2.2 菌种初筛 将制备好的酵母菌代谢产物按体积分数30%加入到MRS 液体培养基中,以同样比例在MRS 液体培养基中添加pH6.0 的YPD 液体培养基为对照组,以1%接种量接种乳酸菌(1×108CFU/mL),30 ℃静置培养24 h,振荡混匀在600 nm处测定吸光度。
将制备好的乳酸菌代谢产物按体积分数30%加入到YPD 液体培养基中,以同样比例在YPD 液体培养基中添加pH6.0 的MRS 液体培养基作为对照组,以1%接种量接种酵母菌(4×106CFU/mL),30 ℃静置培养24 h,振荡混匀后在 600 nm 处测定吸光度。选取乳酸菌和酵母菌菌体浓度较对照差异显著组吸光度显著大于对照组,P<0.05)作为复筛的出发菌组。
1.2.3 菌种复筛 以筛选出来的促进生长的菌组作为研究对象。将乳酸菌(1×108CFU/mL)和酵母菌(4×106CFU/mL)以1%的接种量接种在MRS 液体培养基中30 ℃静置共培养12 h 后,将共培养菌液用无菌生理盐水按10 倍进行梯度稀释,取适当稀释度的发酵液进行平板涂布法计数,使用改良MC 培养基平板测定乳酸菌活菌数,使用孟加拉红培养基平板测定酵母活菌数,于30 ℃静置培养48 h,每个稀释度做3 个重复,取菌落数在30~300 的平板计数,取平均值。
1.2.4 培养方式的确定 将酵母菌(4×106CFU/mL)以1%的接种量接种于YPD 液体培养基中,于30 ℃下分别进行静置与振荡两种培养方式培养24 h,发酵液以6000 r/min 离心15 min,取上清,0.22 μm 滤膜过滤除菌,4 ℃保存备用。MRS 液体培养基中添加体积分数为30%的两种不同培养方式的酵母菌无菌代谢产物为实验组;添加等量的YPD 液体培养基作为对照组。将植物乳杆菌(1×108CFU/mL)以1%接种量接种在上述液体培养基,4、8、12、16、20、24 h 测定菌液在600 nm 处的吸光度。
1.2.5 接种顺序的确定 将乳酸菌(1×108CFU/mL)以1%接种量接种于MRS 液体培养基中,30 ℃静置培养12 h,然后接种1%的酵母菌(4×106CFU/mL),共培养至24 h;以乳酸菌单菌于第0 h 和酵母菌单菌于第12 h 以同接种量接种至MRS 液体培养基为对照。每隔4 h 使用pH 计测定pH,使用改良MC 培养基平板测定乳酸菌活菌数,使用孟加拉红培养基平板测定酵母活菌数。
将酵母菌(4×106CFU/mL)以1%接种量接种于MRS 液体培养基中,30 ℃静置培养12 h,然后接种1%的乳酸菌(1×108CFU/mL),共培养至24 h,以酵母菌单菌于第0 h 和乳酸菌单菌于第12 h 以同接种量接种至MRS 液体培养基为对照。每隔4 h 测定活菌数和pH。
1.2.6 接种比例的确定 乳酸菌与酵母菌活菌数以10:1、20:1、30:1、40:1、50:1、100:1 的比例接种于MRS 液体培养基中,其中酵母菌菌体浓度固定为(4×106CFU/mL),乳酸菌菌体浓度随比例调节,先接种酵母菌后接种乳酸菌;以相同菌体浓度的乳酸菌和酵母菌单菌接种于MRS 培养基为对照组,30 ℃静置培养,在12、18、24 h 测定活菌数。
1.2.7 发酵效果比对实验
1.2.7.1 菌悬液制备 将互促菌组植物乳杆菌J05和酿酒酵母Y21 以及互抑组合乳酸乳球菌RQ 和毕赤酵母Y1,分别接入MRS 与YPD 培养基进行活化,活化两代之后,4500 r/min 离心15 min,弃去上清,无菌生理盐水重悬沉淀,调节菌体浓度为前期筛选出的最佳比例乳酸菌:酵母菌=30:1(此时乳酸菌菌体浓度为1.2×108CFU/ml;酵母菌菌体浓度为4×106CFU/mL)。
1.2.7.2 泡菜制作工艺与实验处理 泡菜工艺流程参考熊涛等[23]的方法并加以改进,制作流程如下:
泡菜原料挑选→整理筛选→泡菜坛预处理→冲洗控水→切块装坛→接种发酵剂→盐水封口→发酵→成品。
取45 个320 mL 的玻璃密封罐,洗净,烘箱烘干。分别称取50 g 白菜样品放入玻璃密封罐中。用冷沸水配制质量分数为 4%的泡菜盐水,以2%的接种量(以白菜质量计)添加菌液发酵。按照1:2 的料液比,分别量取100 mL 泡菜盐水完全淹没样品,保鲜膜加盖密封,室温条件下自然发酵。从腌制之日起,每隔 2 d 取样测定相关指标。
本实验设5 个处理:单菌植物乳杆菌J05 组,单菌酿酒酵母Y21 组,互促组植物乳杆菌J05 和酿酒酵母Y21,互抑组乳酸乳球菌RQ 和毕赤酵母Y1 以及空白对照组(自然发酵)。
1.2.7.3 泡菜理化指标测定 泡菜发酵液pH 采用pH 计直接测定。总酸测定参照GB/T 12456-2021《食品中总酸的测定》直接滴定法;还原糖含量测定参照GB 5009.7-2016《食品国家安全标准食品中还原糖的测定》直接滴定法;亚硝酸盐含量测定参照GB 5009.33-2016《食品国家安全标准食品中亚硝酸盐与硝酸盐的测定》紫外分光光度法。
1.3 数据处理
所有实验均设置3 个重复,实验数据使用SPSS.20 软件进行统计学分析,采用ANOVA 对各组间差异进行单因素方差分析,采用t检验对两组之间的差异进行分析,P<0.05 表示有显著性差异,平均值±标准差表示结果,使用Origin 2021 软件绘图。
2 结果与分析
2.1 互促乳酸菌和酵母菌的初筛
由表2、表3 可得,通过比较乳酸菌、酵母菌在添加代谢产物培养基和单一培养基的生长情况,从所有菌株组合中筛选出具有偏利关系的组合23 对,占比28.75%;相互促进的组合4 对(P<0.05),即植物乳杆菌J05 和酿酒酵母Y21,植物乳杆菌J05 和毕赤酵母Y163,屎肠球菌HR 和毕赤酵母Y163 以及屎肠球菌B2 和毕赤酵母Y163,占比5.00%;仅对一方有抑制作用的组合24 对,占比30.00%;相互抑制的组合8 对(P<0.05),包括乳酸乳球菌RQ 和毕赤酵母Y1 等,占比10.00%。由此可见,乳酸菌和酵母菌复配,菌株间会表现出不同的菌间关系,而能够互相促进的组合占比较低。在刘敏敏等[22]的实验中有相似结果,其从分离自酸马奶的8 株乳酸菌和7 株酵母菌中仅筛选出3 对具有相互促进作用的乳酸菌和酵母菌组合。许多研究表明乳酸菌能产生多种代谢产物如有机酸、抗真菌肽等对酵母菌的生长产生不同影响[24-25]。酵母菌的代谢产物(游离氨基酸和维生素)大多对乳酸菌产生促进作用,部分酵母菌的代谢产物甚至会激活乳酸菌的LuxS/AI-2 QS 系统[26],从而调节群体密度,影响菌群生长。但也有报道证明一些酵母菌会分泌抑菌物质抑制乳酸菌的生长[27]。

表2 乳酸菌代谢产物对酵母菌生长影响Table 2 Effects of lactic acid bacteria metabolites on yeast growth
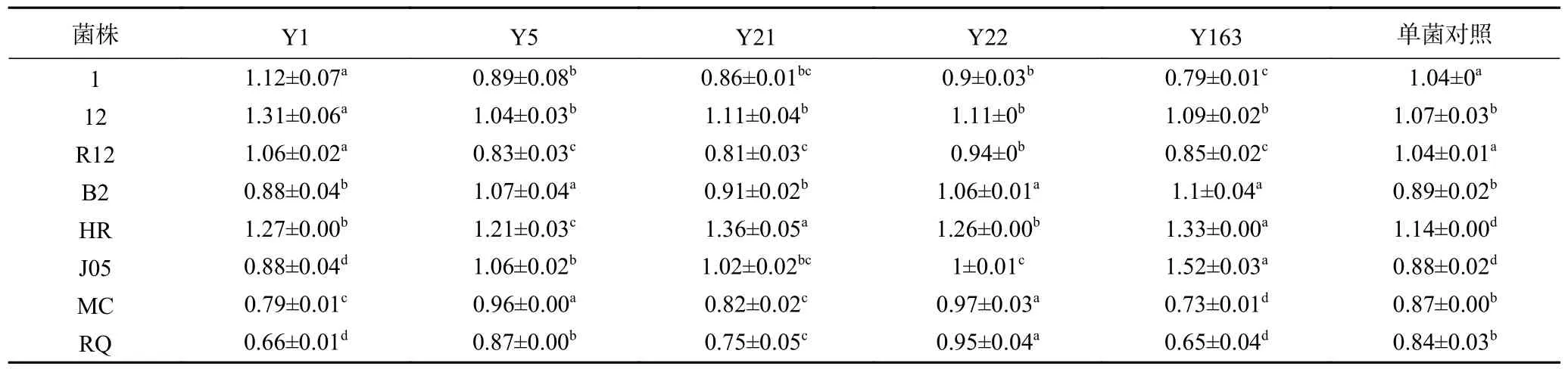
表3 酵母菌代谢产物对乳酸菌生长影响Table 3 Effects of yeast metabolites on the growth of lactic acid bacteria
2.2 互促乳酸菌和酵母菌的复筛
表4 结果表明,对初筛中选出的4 对乳酸菌和酵母菌组合进行菌组共培养复筛,只有植物乳杆菌J05 和酿酒酵母Y21 显示出明显稳定的相互促进关系(P<0.05),因此选该菌株组合作为后续筛选实验的研究对象。
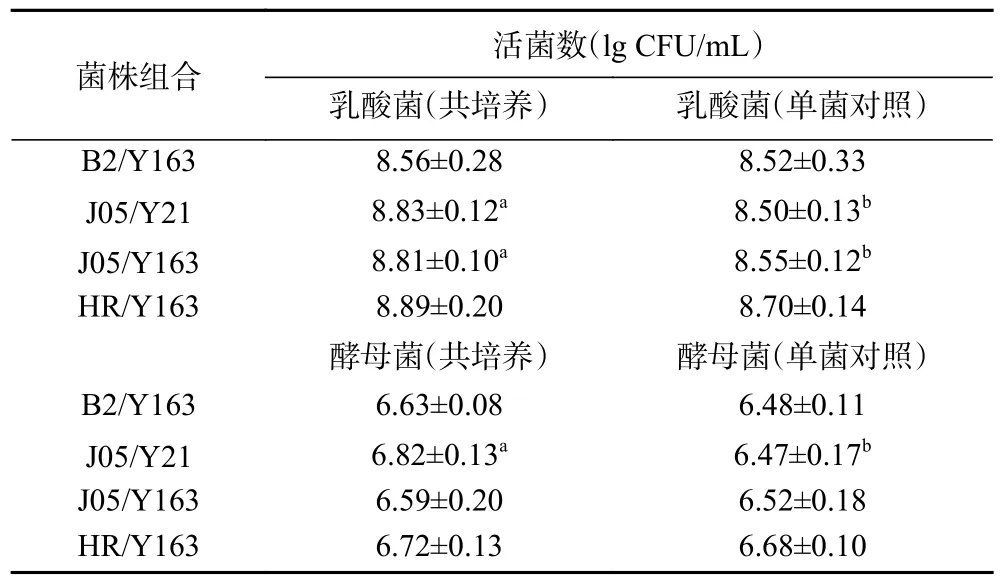
表4 乳酸菌和酵母菌复筛活菌数Table 4 The viable number of lactic acid bacteria and yeast
2.3 培养方式的确定
结果如图1 所示,酿酒酵母Y21 静置培养和振荡培养的无菌代谢产物都可以促进植物乳杆菌J05 的生长,且对该菌的促进作用表现在4~16 h 之间,而静置培养的无菌代谢产物对植物乳杆菌J05 的促进作用更加明显。酵母菌属于兼性厌氧菌,静置培养过程中酵母菌与空气接触较少,可将糖分分解成乙醇和CO2等代谢产物,振荡培养过程中酵母菌主要进行耗氧代谢,此时糖分降解较彻底,酵母菌在不同氧含量情况下代谢产物不同,对乳酸菌的影响也可能不同。郭倩茹[28]使用振荡培养酵母无细胞上清液与乳酸菌共培养,筛选出了互利的乳酸菌和酵母菌;赵小丽[29]使用厌氧发酵的酵母培养物来测定对植物乳杆菌的促进效果,并建立了酵母菌厌氧发酵体系。
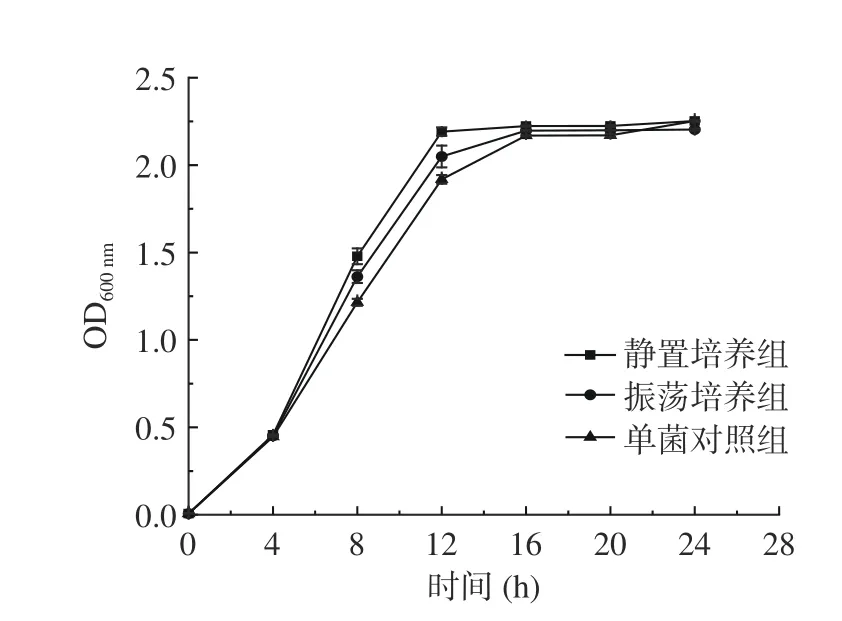
图1 酿酒酵母不同代谢产物对植物乳杆菌的生长的影响Fig.1 Effects of different metabolites of S. cerevisiae on the growth of L. plantarum
2.4 接种顺序对菌株生长情况的影响
从图2A 的结果分析,先接种植物乳杆菌J05 培养12 h,后接种酿酒酵母Y21,结果显示与单菌J05 组相比,共培养J05 的生长无明显差异,与单菌Y21 组相比,共培养Y21 在16 h 时生长受到抑制,20 h 后恢复正常。结合图2C 中pH 结果,酿酒酵母Y21 在接种前期可能受到酸抑制,适应环境后,利用植物乳杆菌J05 的部分代谢产物加速生长。从图2B与图2D 的结果分析,先接种酿酒酵母Y21 培养12 h,后接种植物乳杆菌J05,结果显示与单菌Y21组相比,共培养Y21 的生长状态改善,且在16 和20 h时活菌数显著高于对照组(P<0.05),表明加入植物乳杆菌J05 后促进了酿酒酵母Y21 的生长;接入植物乳杆菌J05 后,共培养J05 活菌数较单菌对照组提高,在20 h 时差异显著(P<0.05),表明此时酿酒酵母Y21 的代谢产物可以促进植物乳杆菌J05 的生长。在共培养菌株的接种顺序研究中,周钰涵等[30]研究发现,酿酒酵母与球拟酵母接种顺序不同,对发酵体系中还原糖含量及CO2总失重有不同程度影响;吴轩德[31]在对酿酒酵母与巴氏醋杆菌相互作用的研究中表明,在酵母菌发酵24 h 后接种醋酸菌对酵母酒精发酵影响最大。因此本实验中不同接种顺序下菌株表现出不同的生长情况,推测与共培养体系中不同时段的代谢产物的差异相关。
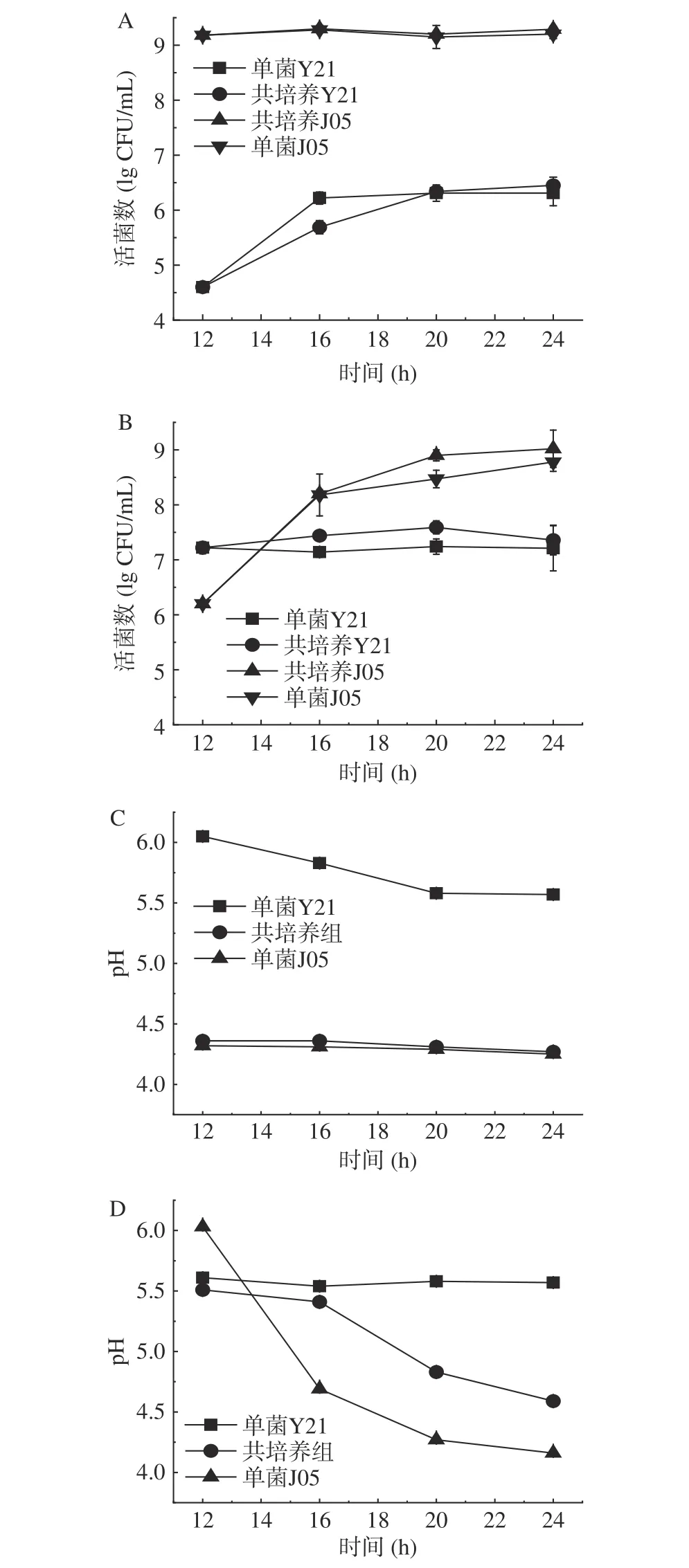
图2 不同接种顺序下植物乳杆菌和酿酒酵母的活菌数及pHFig.2 Number of viable strains and pH of L. plantarum and S.cerevisiae in different inoculation sequences
2.5 接种比例对菌株生长情况的影响
结果如图3 所示,菌株复配比例对菌株生长有一定影响,在12 h 时,与单菌对照组相比,各复配组的活菌数出现明显差异(P<0.05),而在18 h 和24 h时没有明显差别,该结果与闫彬等[32]的研究结果较为接近,而与Xu 等[11]的结果有一定差异,可能是各菌株分泌有利代谢物质的时间有差异所致[33]。在12 h 时,不同菌株比例对复配组中植物乳杆菌J05 的生长均有促进作用,对酿酒酵母Y21 的生长影响有差异,说明复配对植物乳杆菌J05 生长促进效果明显,而对酿酒酵母Y21 的影响有限。其中30:1和40:1 的比例是菌株复配的较佳比例,在这两个比例下,复配组的活菌数均显著高于单菌组。

图3 不同接种比例植物乳杆菌和酿酒酵母的活菌数Fig.3 Number of viable strains of L.plantarum and S.cerevisiae under different inoculation ratios
2.6 泡菜发酵过程中pH 和总酸的变化
pH 作为泡菜发酵过程中一项重要指标,对微生物生长和代谢产物形成具有重要影响[34]。由表5 可知,除酵母组外,所有组在0~2 d 之间pH 均急速下降,第10 d 至发酵过程完结,各组pH 趋于稳定,互促组pH 最低(P<0.05),而互抑组和对照组的pH 最高。由图4 可知,在发酵过程中,各组总酸含量均逐渐增加到10 d 后趋于稳定,其中互促组总酸含量维持在较高水平,稳定期与其他组相比总酸含量最高(P<0.05)。所有组别在发酵过程中总酸含量均低于国内贸易行业标准SB/T 10439-2007(≤2 g/100 g),结果与pH 变化情况基本一致。对照组与互抑组总酸增加缓慢,在2~10 d 内,总酸含量均低于互促组和单菌组。各实验组接种菌量相同的情况下,互促组产酸量大,说明发酵能力最强,互抑组从第8 d 开始,酸产量不再增加,总酸产量比空白对照组低,说明发酵能力最差。
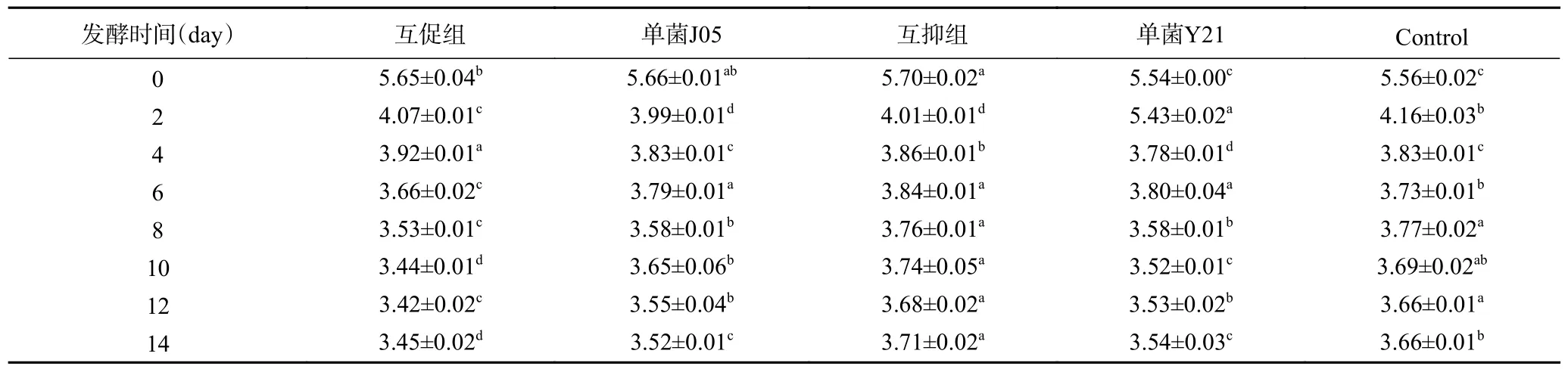
表5 泡菜发酵过程中pH 变化Table 5 Change of pH during pickle fermentation
研究表明,在泡菜发酵过程中,其pH 达到3.5~3.8 可认为发酵结束,泡菜此时为成熟状态,理论上风味最佳,可进行食用[35]。本实验中,互促组pH 在第6 d 下降到3.66,且一直维持在最低水平,结合总酸含量变化情况分析,随着发酵过程的进行,各组发酵泡菜中总酸含量不断增加,在总酸的积累量上,互促组都要高于其他组别,这是因为互促组乳酸菌与酵母菌为互利共生菌组,生长繁殖速度更快,产酸更多。而其他组别中的乳酸菌与酵母菌未能形成互促关系,相比于互促组,发酵繁殖周期较长,成为优势菌种所需时间更久,产酸量和产酸速率都要低于互促组,所以到达发酵结束时间也就越久。凌荣秀等[36]研究表明泡菜酸性环境可抑制有害菌的生长和代谢,有利于乳酸菌的发酵,陈影等[37]研究表明,泡菜发酵体系中乳酸菌量增加有助于降低pH 与提升总酸含量,缩短泡菜发酵时间。
2.7 泡菜发酵过程中还原糖含量变化
由图5 所示,发酵泡菜的还原糖含量均呈现先增加后降低的变化趋势,除对照组外,添加菌组都在第2 d 到达峰值。泡菜发酵初期,微生物活动较弱,泡菜叶中淀粉、多糖类物质被降解成还原糖,当还原糖溶解速度大于微生物利用的速度,导致泡菜液中的还原糖含量上升,随着发酵过程的进行,大量的微生物生长繁殖消耗碳源,导致还原糖含量逐渐降低[38],符合微生物对碳源分解利用的规律[39]。其中酿酒酵母单菌Y21 组的还原糖含量最高,有利于其后期的发酵利用。而互促组的还原糖含量在整个发酵过程中均维持在较低水平,表明该组别中微生物对还原糖利用率较高,因此发酵充分,该结果与产酸结果相一致。互促组的还原糖含量在第2 d 时处于各组别中最低值,可能由于酵母产的还原糖被乳酸菌快速利用,两菌在代谢上存在相互作用,有利于发酵的进行。而互抑组在整个发酵过程中还原糖含量较高,而产酸量较低,说明发酵能力较差。
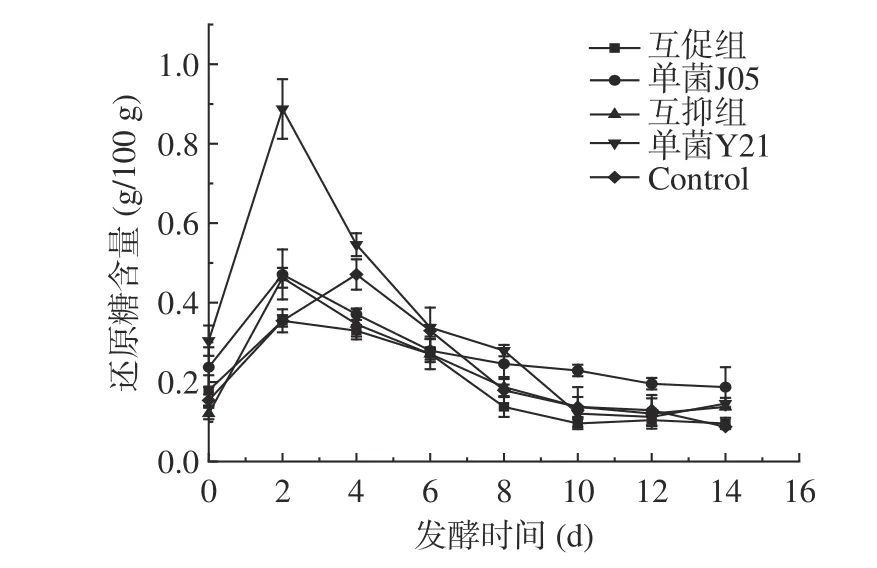
图5 泡菜发酵过程中还原糖含量的变化Fig.5 Changes of reducing sugar content in the fermentation of pickle
2.8 泡菜发酵过程中亚硝酸盐含量变化
亚硝酸盐含量作为判断泡菜产品是否可以安全食用的一项重要指标,得到消费者关注[40],在《食品中污染物限量国家标准》中有明确规定,其残留量在酱菜中不得超过20 mg/kg[41]。由图6 可知,各组中“亚硝峰”都出现在第2 d,其中对照组峰值最高为8.03 mg/kg,互促组峰值含量为5.38 mg/kg,均未超过20 mg/kg;发酵第10 d,所有组别中亚硝酸盐含量都下降到3 mg/kg 以下,远低于标准限量值。
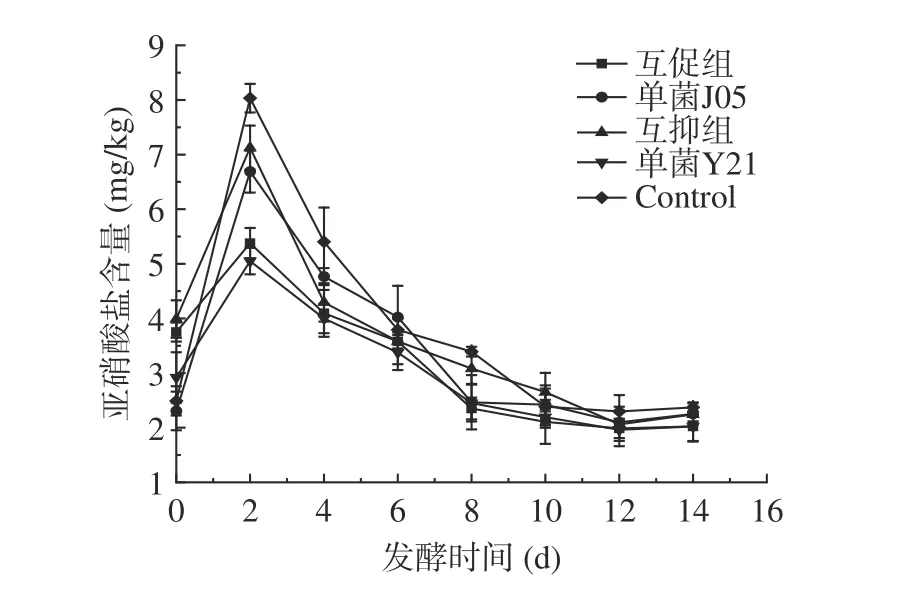
图6 泡菜发酵过程中亚硝酸盐含量的变化Fig.6 Changes of nitrite content in the fermentation of pickle
本实验各处理组亚硝酸盐含量均在发酵第2 d达到高峰,随后逐渐下降。泡菜发发酵过程中产酸可抑制硝酸盐还原菌的生长,逐渐降低亚硝酸盐含量;且在酸性条件下,亚硝酸根离子可与氢离子结合形成亚硝酸,发生自身歧化反应生成二氧化氮和一氧化氮,从而降低亚硝酸盐含量[42]。在所有实验组中,自然发酵的对照组亚硝酸盐含量最高,说明添加发酵微生物有利于抑制泡菜亚硝酸盐的生成,互促组与酿酒酵母Y21 组中亚硝酸盐含量较低,结合pH 和总酸发酵结果分析,说明发酵充分,能有效抑制硝酸盐还原菌生长,有利于降低亚硝酸盐含量。较多研究表明,人工接种复合乳酸菌进行泡菜发酵,可起到抑制亚硝酸盐含量的作用。任亭等[34]研究复合菌种对青菜头泡菜品质的影响,结果显示,接种组亚硝酸盐峰值为2.61 mg/kg,对照组为6.12 mg/kg,接种组较对照组低。陈大鹏等[38]以娃娃菜的尾菜为原料,接种混合菌种发酵泡菜,自然发酵泡菜的“亚硝峰”出现在发酵的第3 d,为32.1 mg /kg,而人工接种发酵泡菜的“亚硝峰”出现在发酵第2 d,峰值较低,为9.03 mg /kg。本实验得到结果与上述相似。
3 结论
本研究通过代谢产物与菌株共培养初筛,乳酸菌与酵母菌共培养复筛,筛选出一对具有相互促进作用的植物乳杆菌J05 与酿酒酵母Y21,对该菌组间培养方式、接种顺序、接种比例等进行探究,再将筛选得到的菌组应用到人工接种发酵泡菜中,研究各菌组的发酵性能。发现互促组可较快进入发酵成熟期,缩短泡菜发酵周期,其还原糖含量在整个发酵过程中均维持在较低水平,各添加菌组亚硝酸盐含量均要低于自然发酵组,其中互促组在整个发酵过程亚硝酸盐含量较低,提高了泡菜食用的安全性。上述结果为乳酸菌与酵母菌互作关系研究及人工接种发酵泡菜的工业化生产,提供了一定的科学理论依据。
