胍锚定淀粉基抗菌包装膜在鲍鱼中的应用
2023-08-12唐淑蓉丁勇郝义田志航刘卓琳陈霄汉李立
唐淑蓉,丁勇,郝义,田志航,刘卓琳,陈霄汉,李立
胍锚定淀粉基抗菌包装膜在鲍鱼中的应用
唐淑蓉a,b,丁勇a,b,郝义a,b,田志航a,b,刘卓琳a,b,陈霄汉a,b,李立a,b
(上海海洋大学 a.食品学院 b.食品热加工工程技术研究中心,上海 201306)
开发一种接枝性抗菌包装并应用于水产品保鲜,为进一步将接枝型包装薄膜应用于生产提供一种新的途径。将聚六亚甲基双胍盐酸盐(Polyhexamethylene Biguanide Hydrochloride, PHMB)和聚六亚甲基单胍盐酸盐(Polyhexamethyleneguanidine Hydrochloride, PHMG)接枝到淀粉上,再将其与聚乳酸(Polylactic Acid, PLA)和聚己二酸/对苯二甲酸丁二酯(Poly (Butyleneadipate-Co-Terephthalate), PBAT)共混改性,通过流延挤出工艺制备接枝性抗菌薄膜,并应用于鲍鱼保鲜。淀粉接枝胍类物质后实现了淀粉的抗菌化,添加了PHMB和PHMG的PLA/PBAT薄膜阻隔性能显著增强(<0.05),并且赋予了薄膜抑菌性,延缓了鲍鱼菌落总数、硫代巴比妥酸和挥发性盐基氮值的上升。淀粉接枝PHMB和PHMG后改善了薄膜的阻隔性,Starch-g-PHMB/PLA/PBAT和Starch-g-PHMG/PLA/PBAT薄膜可有效抑制微生物作用,延缓鲍鱼氧化和腐败速率,可有效延长鲍鱼货架期。
接枝;聚六亚甲基双胍盐酸盐;聚六亚甲基单胍盐酸盐;淀粉;鲍鱼保鲜
鲍鱼是消费者青睐的优质健康食品,但是很容易受到多种细菌的影响。此外,鲍鱼的水分和蛋白质的含量都比较高,很容易发生腐败变质[1]。因此研究鲍鱼的贮藏保鲜技术、延长鲍鱼的保质期有着重要的意义。功能性食品包装薄膜已被广泛应用于水产品储存和销售过程中,以维持水产品的品质和提升其商业价值。但传统石油基包装材料难以在土壤和自然环境中降解[2],对自然环境和人类健康造成很大威胁。因此,研究和开发能够替代传统石油基塑料的绿色可循环功能性食品包装已成为食品包装行业的研究重点。具有抗菌活性的可降解活性包装膜因其能有效抑制细菌生长,延缓食品腐败变质,获得了广泛关注[3]。
聚六亚甲基双胍盐酸盐(Polyhexamethylene Biguanide Hydrochloride, PHMB)和聚六亚甲基单胍盐酸盐(Polyhexamethyleneguanidine Hydrochloride, PHMG)是2种主链含胍基的抗菌聚合物,因其对细菌具有明显的抑制作用而被广泛应用于食品工业[4]。有研究表明,胍类聚合物的抗菌原理主要是由于胍类阳离子与细菌细胞膜的阴离子表面之间发生静电作用,从而导致细胞成分损伤,最终导致细胞死亡[5]。胍类抗菌聚合物已被应用于保存莴苣、海鲈鱼等[6-7]。然而,由于胍类聚合物在极性溶剂(包括水)中的高溶解度,导致其应用于抗菌材料的抑菌效果受到限制[6],通过将胍类物质化学接枝到淀粉上可以有效解决这一限制。
淀粉(Starch)具有资源丰富、污染小、价格低、可再生、成膜性好等潜在优势[7]。淀粉是开发生物降解包装膜的一种有前景的生物聚合物基质,它是自然界中重要和丰富的多糖之一[8-9]。聚乳酸(Polylactic Acid, PLA)有良好的力学性能、高透明度以及易于加工和成型[10]。然而,PLA的脆性和低热稳定性大大限制了其在包装薄膜中的应用[11]。聚(对苯二甲酸丁二醇酯)(Poly(Butylene Adipate Co-Terephthalate), PBAT)具有良好的延展性、耐热性和抗冲击性。将淀粉与PBAT和PLA结合起来可以降低生产成本,提高材料的力学性能[3]。
本研究通过将PHMB和PHMG接枝到淀粉上,然后与PLA/PBAT熔融混合,通过流延工艺制备2种活性抗菌包装,探究改性淀粉以及制备薄膜的性能变化,并进一步应用于在−4 ℃下鲍鱼的保鲜。通过保鲜指标测试评价抗菌包装对鲍鱼品质的影响,为进一步应用于水产品的接枝型包装薄膜的开发和利用提供有效参考。
1 实验
1.1 材料和仪器
主要材料:PLA 721,浙江海正生物材料股份有限公司;PBAT 1200,上海胜翔国际贸易有限公司;玉米淀粉,上海麦克林生化科技股份有限公司;鲍鱼,采购于上海市浦东新区海鲜批发市场。
主要仪器:D8 ADVANCE X-射线扫描仪,德国Bruker;Q5000热重分析仪,美国TA Instruments;XSS–300 转矩流变仪,上海科创像塑机械设备有限公司;211-101F螺旋测微仪,上海宪南实业有限公司;SU5000热场发射扫描电镜,日本Hitachi;PERMATRAN-W1/50G水蒸气透过率测试仪,美国MOCON;Synergy2自动酶标仪,美国BioTek;NIR Flex N500傅里叶变换红外光谱仪,美国Thermo Fisher Scientific;XLW智能电子拉力试验机、G2/132 气体渗透测试仪,济南兰光机电有限公司。
1.2 方法
1.2.1 抗菌淀粉的制备
将玉米淀粉在80 ℃干燥48 h,然后与顺丁烯二酸酐混合(质量比为10∶10),低温球磨10 min后,80 ℃加热处理2 h,再用丙酮清洗,将清洗后收集的淀粉放在烘箱烘干,得到酯化淀粉(Esterified Starch)。然后称取质量分数为10%的酯化淀粉分散在二甲基亚砜中,加热并搅拌至溶液呈透明黏稠状;同时,将异佛尔酮二异氰酸酯(IPDI)与酯化淀粉混合((IPDI)∶(酯化淀粉)=1∶2),再与PHMB按质量比5∶2混合后置于圆底烧瓶加热反应,以二月桂酸二丁基锡为催化剂,二甲苯洗涤并过滤产物。将溶解的淀粉加入黏性IPDI-PHMB中间产物,并转移到新的圆底烧瓶中,在60 ℃下加热搅拌3 h,得到产物,再用乙醇清洗干净得到淀粉微粒,最后放在45 ℃烘箱烘干,得到PHMB接枝淀粉(Starch-g- PHMB)。Starch-g-PHMG的制备方法同上。
1.2.2 抗菌膜的制备
将3种淀粉分别与甘油((淀粉)∶(甘油)=10∶3)混合塑化,分别称取质量分数为30%塑化后的淀粉加入到质量分数为56%的PBAT/PLA((PBAT)∶(PLA)=4∶1)中,混合,再与质量分数为1%的抗氧化剂和质量分数为1%的扩链剂混合均匀,通过XSS–300转矩流变仪制备得到厚度为(60±5)μm的薄膜。转矩流变仪1—7区的温度参数为145、155、165、175、170、165、160 ℃,转速为60 r/min。根据淀粉的种类,标记了3种薄膜,分别为Starch/PLA/PBAT、Starch-g-PHMB/PLA/PBAT和Starch-g-PHMG/PLA/PBAT薄膜。
1.2.3 抗菌淀粉的性能测试
1.2.3.1 傅里叶红外光谱
使用NIR Flex N500傅里叶红外光谱仪(FTIR)采集了淀粉样品的红外光谱数据,光谱分辨度为4 cm−1,波数范围为4 000~500 cm−1,扫描次数为64次。
1.2.3.2 X-射线衍射(X-Ray Diffraction, XRD)
在40 mA和40 kV的铜Kα辐射(=0.154 06 nm)下对样品进行表征。此外,样品的完整PXRD模式采集范围(2)为3°~40°,扫描速度为1(°)/min,步长为2=0.02°。
1.2.3.3 淀粉抑菌性能测定
为了验证抑菌性,选取2种典型的革兰氏阴性菌(大肠杆菌)和革兰氏阳性菌(金黄色葡萄球菌)进行抑菌实验。采用牛津杯法进行测试[12],将大肠杆菌和金黄色葡萄球菌分别加入10 mL胰酪大豆胨液体培养基中,在37 ℃、180 r/min条件下摇床振荡培养12 h。将培养好的菌悬液稀释到浓度约为107CFU/mL。将15~20 mL大豆酪蛋白琼脂培养基倾注平皿,待冷凝后,将100 μL活化的大肠杆菌和金黄色葡萄球菌分别加入不同培养基涂布,然后在培养基上放上牛津杯。将粉末用蒸馏水配制成5%的悬浮液放在紫外线下照射30 min,然后取100 μL的悬浮液注入牛津杯中,放在37 ℃恒温培养箱中培养24 h。
1.2.4 薄膜的性能测试
1.2.4.1 形貌表征
通过在液氮中冷冻破碎薄膜,将破碎后的薄膜固定在导电胶上,然后进行喷金处理。在5 kV的加速电压下,用扫描电镜观察。
1.2.4.2 力学性能
根据GB/T 1040.3—2006[13]中的方法,测定可降解薄膜的拉伸强度和断裂伸长率。将薄膜上切割出(15 mm×100 mm)矩形试样,使用智能电子拉力试验机以150 mm/min的拉伸测试速度进行测试。
1.2.4.3 阻隔性能
利用水蒸气透过率测试仪测定薄膜的水蒸气透过率。简单来说,将制备好的薄膜裁成小块(5 cm×5 cm),并测量薄膜片的厚度。在相对湿度为100%、温度为37.8 ℃的条件下测定。薄膜的氧气透过率的测试参考GB/T 1038—2000[14],设置试验温度为23 ℃,将样品密封后贴于仪器的检测腔内进行测试。
1.2.4.4 薄膜的抑菌实验
通过比浊法测定了薄膜的抑菌性能,在37 ℃将金黄色葡萄球菌()和大肠杆菌()活化12 h后,取100 μL菌悬液置于10 mL液体培养基试管中进行稀释处理至菌液浓度约为107CFU/mL。将薄膜剪碎后用紫外线照射进行杀菌处理后,浸泡在10 mL的菌悬液中,在120 r/min、37 ℃的条件下连续培养8 h。然后,将培养好的菌悬液移取100 μL至琼脂平板中,在37 ℃下进一步培育24 h。每次实验重复3次。
将薄膜装在铝箔袋放置一年后,进行相同的抑菌实验,观察薄膜的抑菌性。
1.2.5 鲍鱼保鲜
1.2.5.1 样品制备
将新鲜鲍鱼去除内脏,并用4 ℃无菌生理盐水冲洗干净,将鲍鱼肉随机分装于预制的包装袋(尺寸为25 cm×35 cm、厚度为(60±5)μm)中。将鲍鱼随机分为4组,每组(70±2)g,分别为未包装的鲍鱼(CK)、Starch/PLA/PBAT薄膜包裹的鲍鱼、Starch-g-PHMB/ PLA/PBAT薄膜包裹的鲍鱼、Starch-g-PHMG/PLA/ PBAT薄膜包裹的鲍鱼。所有的鲍鱼都被放置在(4±1)℃的冰箱中储存18 d,每3 d测量样品的指标。
1.2.5.2 菌落总数(TVC)
参照GB 4789.2—2022《食品卫生微生物学检验菌落总数测定》[15]的方法称取5 g鲍鱼肉,然后置于无菌袋中,加入45 mL无菌生理盐水均质2 min,再进行一系列稀释梯度培养。在30 ℃恒温恒湿培养箱培养72 h后,计总菌落数。
1.2.5.3 总挥发性盐基氮(TVB-N)
TVB-N的测定方法参照Ojogbo等[16]的方法。称取10 g鲍鱼肉样品,加入2 g轻质氧化镁,使用全自动凯氏定氮仪测定鲍鱼样品的TVB-N含量。TVB-N值表示为每100 g鲍鱼的毫克氮含量(mg/hg)。
1.2.5.4 硫代巴比妥酸值(TBA)
根据Zhang等[6]的方法,采用水萃取TBA法进行测量,测定硫代巴比妥酸(TBARS)以评估鲍鱼在储存过程中脂质氧化的程度。将鲍鱼肉样品(每个5.0 g)在25 mL体积分数为7.5%的三氯乙酸(含体积分数为0.10%的乙二胺四乙酸)中以8 000 r/min均质3 min,将均质后的混合液静置15 min,然后过滤。将10 mL的过滤液与10 mL浓度为0.02 mol/L的硫代巴比妥酸液相混合,在90 ℃反应40 min。随后于室温下冷却,在8 000 r/min、4 ℃条件下离心5 min。将5 mL三氯甲烷添加入离心后的溶液中反应,测定其在532 nm和600 nm波长下的吸光光度值,并以3个平行的方式进行。根据式(1)计算TBARS的含量((MDA))。

式(1)的结果以100 g鲍鱼肉中所含丙二醛(MDA)量表示,单位为mg/hg。
1.2.6 统计分析
使用IBM SPSS Statistics for Windows(Version 23, SPSS Inc., USA)进行样品间的方差分析(ANOVA),并在95%的置信水平下进行Tukey检验,结果以平均值±标准值表示。采用Origin 2019b、Microsoft Office PowerPoint、Word等软件进行分析作图。
2 结果与分析
2.1 薄膜的性能测试
2.1.1 傅里叶红外光谱
从图1可以看出,淀粉接枝马来酸酐后除含有原淀粉的特征吸收峰以外,在1 726 cm−1附近出现了羰基(C=O)吸收峰[17]。由于样品已经通过丙酮清洗干净,所以可以证明马来酸酐已接枝到淀粉上。加入PHMB和PHMG后,在1 550 cm−1附近处出现了胍类物质(−NH)的特征峰[16]。这可能是由于PHMB/PHMG与酯化淀粉的羰基发生了共价接枝反应,生成了Starch-g-PHMB和Starch-g-PHMB。
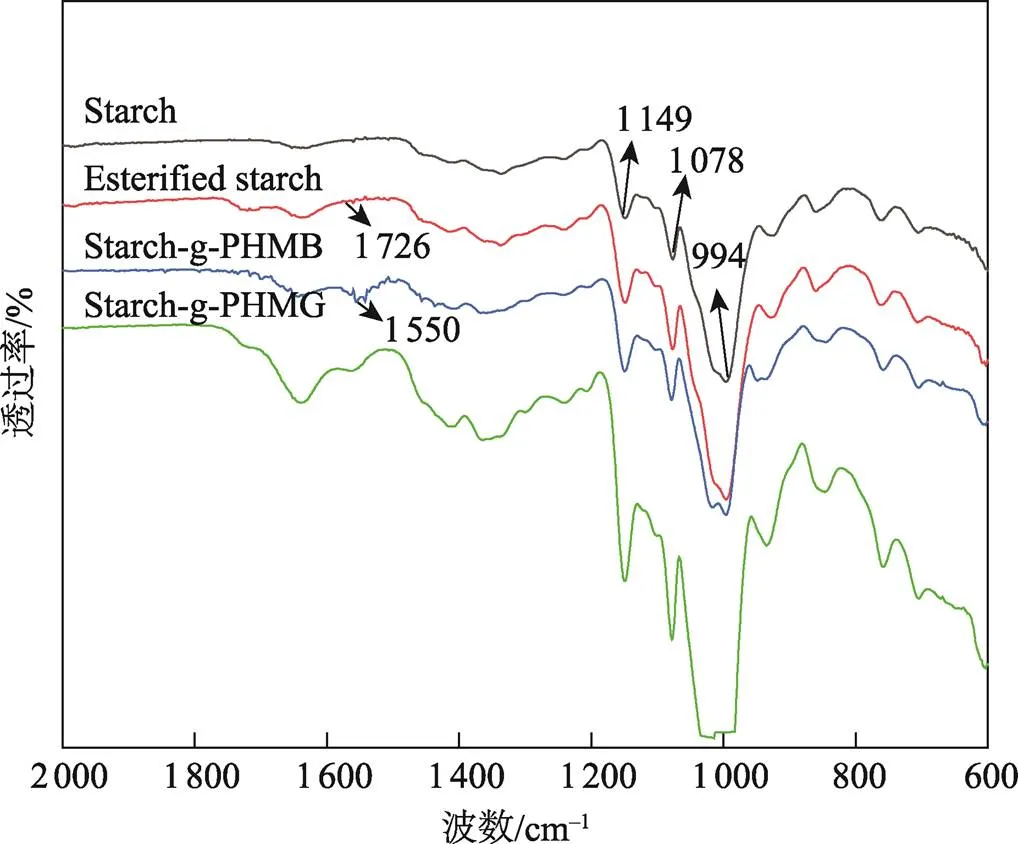
图1 淀粉的红外光谱图
2.1.2 淀粉X-射线衍射图
由图2所示,原淀粉在2为15°、17°、18°和23°处出现衍射峰,其中17°和18°附近为相连的双峰,此为典型的A型结晶[18]。在原淀粉经过改性后,其衍射峰的位置并未发生变化,这说明了反应主要发生在淀粉的非晶体区域。与原淀粉相比,Starch-g-PHMB和Starch-g-PHMG衍射峰的强度要弱一些,这说明该反应可以一定程度地破坏淀粉的晶体结构[17]。由于晶体结构的破坏,使其分子之间的氢键强度减弱。

图2 淀粉的X射线衍射图
2.1.3 淀粉的抑菌性
图3分别是Starch-g-PHMG、Starch-g-PHMB对的抑制性以及2种抑菌淀粉的抑菌性对比。通过图3a和图3b可以看出,相比于原淀粉,2种抗菌淀粉具有明显的抑菌圈,说明2种抗菌淀粉对具有明显的抑制作用。通过图3c可以看出,2种抑菌淀粉周围的抑菌圈相似,说明2种抑菌物质对的抑菌性没有明显差别。图3d—f分别是Starch-g-PHMG、Starch-g-PHMB对的抑制性以及两者抑菌性的对比。Starch-g-PHMG和Starch-g- PHMB对同样具有明显的抑制作用,并且Starch-g-PHMG比Starch-g-PHMB的抑菌效果略弱。
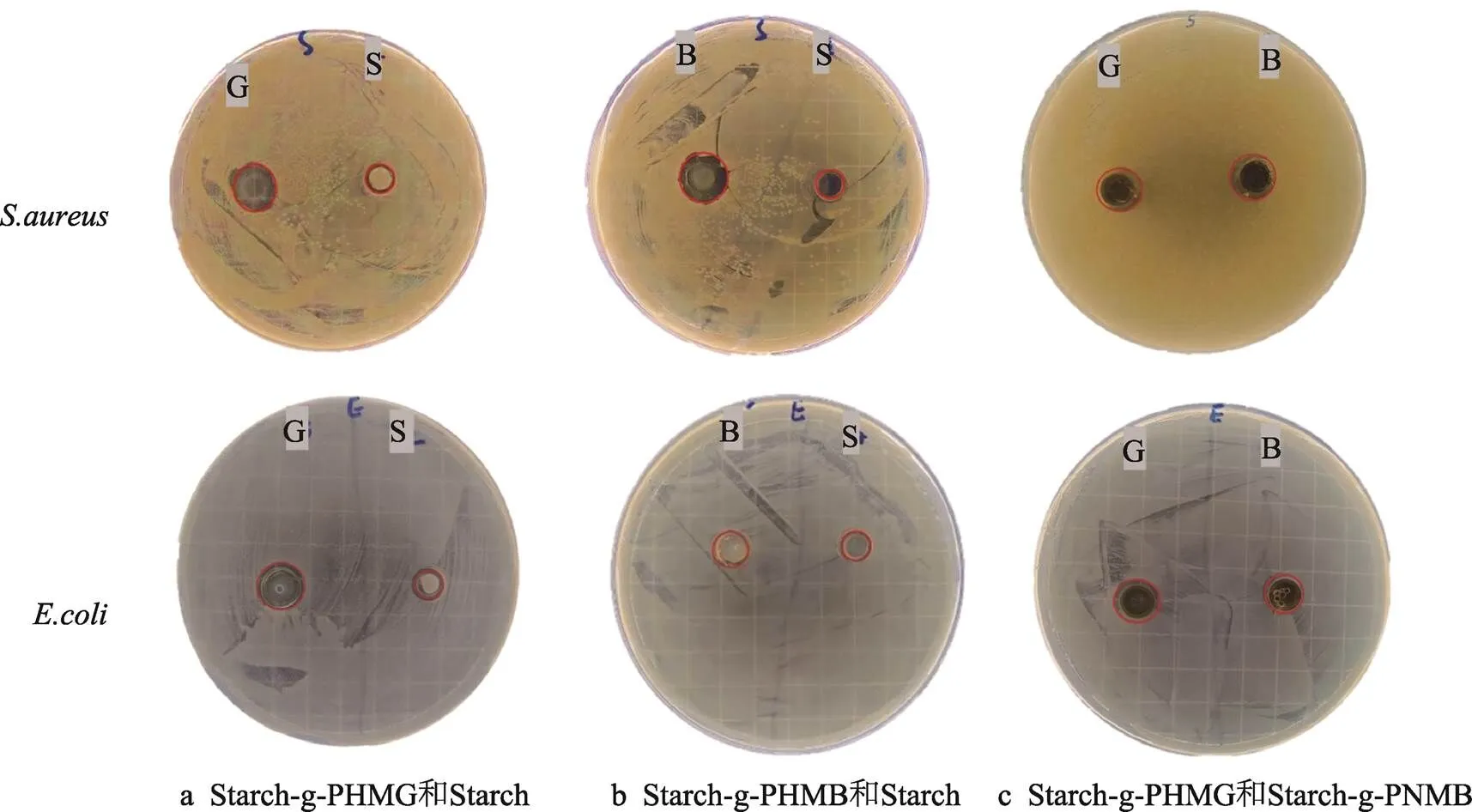
图3 淀粉的抑菌性
2.2 薄膜的性能测试
2.2.1 薄膜的微观结构
图4显示了3种复合膜的微观形貌结构和薄膜实物图。从图4a—c可以看出,Starch/PLA/PBAT薄膜的表面有很多空隙和裂纹,Starch-g-PHMB/PLA/PBAT和Starch-g-PHMG/PLA/PBAT薄膜的表面粗糙,且观察到淀粉颗粒在表面均匀分散。图4d—f是3种薄膜的截面形态,可以看出,Starch/PLA/PBAT薄膜内部凹凸不平,界面相容性差,Starch-g-PHMB/PLA/PBAT薄膜和Starch-g-PHMG/PLA/PBAT薄膜的内部结构更加紧凑致密,表现出成分之间良好的相互作用。这是由于淀粉改性后亲水基被取代,疏水性增强,与疏水性材料PLA/PBAT的相容性更好。通过图4g—i可以看出,3种薄膜表面均匀,透明度良好,可应用于食品包装袋中。
2.2.2 薄膜的力学性能
如表1所示,抗菌淀粉的加入影响了薄膜的力学性能。Starch/PLA/PBAT薄膜的拉伸强度为(12.83±0.79)MPa,断裂伸长率为(36.36±0.47)%。加入改性淀粉Starch-g-PHMB后薄膜的纵向拉伸强度从12.83 MPa下降到10.91 MPa,断裂伸长率从36.36%上升到113.16%。Starch-g-PHMG薄膜的拉伸强度下降为10.64 MPa,断裂伸长率上升为68.2%。从X-射线衍射图结果显示,接枝胍类物质后淀粉结晶度下降。结晶度降低,分子链排列变得松散,孔隙率增加,分子间相互作用力减少,链段运动变得简单,从而影响了淀粉膜的力学性能。
2.2.3 薄膜的阻隔性能
由表2可以看出,Starch/PLA/PBAT薄膜的氧气透过率(OTR)和水蒸气透过率(WVP)分别为770.33 cm3/ (m2·24 h·0.1 MPa)和(707.90±5.23)g/(m·Pa·s)。接枝性抗菌薄膜的OTR值和WVP值显著低于Starch/ PLA/PBAT薄膜的(<0.05),这表明接枝性抑菌薄膜阻隔性能增强。这可能由于是薄膜分子间隙减少,薄膜结构的紧密性增加,导致气体和水蒸气传输减少,从而增强了薄膜的阻隔性能。

图4 薄膜的扫描电镜图和外观
表1 不同包装薄膜力学性能

Tab.1 Mechanical properties of different packaging films
注:同列之间的不同上标字母a—c表示显著差异(<0.05)。
2.2.4 薄膜的抑菌性
通过测量液体介质在波长为600 nm处的吸光度(OD600值)(表3)可以看出,将薄膜置于和菌悬液中培养8 h后,Starch/PLA/PBAT薄膜在波长为600 nm处的吸光度值升高,Starch- g-PHMB/PLA/PBAT和Starch-g-PHMG/PLA/ PBAT薄膜的吸光度值没有明显差异(>0.05)。正如平板涂布所显示的结果(见图5),Starch-g-PHMB/ PLA/PBAT和Starch-g-PHMG/PLA/PBAT薄膜对和均有较好的抑菌活性。Starch-g- PHMB/PLA/PBAT薄膜和Starch-g-PHMG/PLA/PBAT薄膜对的抑制效果要优于对的抑制效果。胍类物质具有抑菌性主要是因为胍基的阳离子与细菌细胞膜的阴离子表面的静电作用,使得细胞膜损伤,直接导致细胞成分的流失,最终导致细胞死亡[19](见图6)。
在相同的条件下,对存放一年后的薄膜进行了同样的抑菌试验。将薄膜放入37 ℃的菌悬液中8 h后,Starch/PLA/PBAT薄膜在波长为600 nm处的吸光度值从0.093 5增加到0.624 0;Starch-g-PHMB/PLA/ PBAT和Starch-g-PHMG/PLA/PBAT薄膜的吸光度值没有明显差异(>0.05);Starch-g-PHMB/PLA/PBAT薄膜和Starch-g-PHMG/PLA/PBAT薄膜仍具有很强的抑菌性。
表2 不同包装薄膜氧气透过率、水蒸气透过率

Tab.2 Oxygen transmission rate and water vapor transmission rate of different packaging films
注:同列之间的不同上标字母a—c表示显著差异(<0.05)。
表3 薄膜的抑菌性(OD600值)

Tab.3 Bacteriostatic properties of films (OD600 value)
注:同列之间的不同上标字母a—b表示显著差异(<0.05);A代表1年前的抑菌实验,B代表1年后的抑菌实验。

图5 薄膜的抑菌性

图6 薄膜的抑菌机理
2.3 鲍鱼保鲜
2.3.1 薄膜对鲍鱼的菌落总数的影响
不同包装的鲍鱼的菌落总数如图7所示,新鲜鲍鱼的起始菌落总数为2.3 log(CFU/g)左右,鲍鱼在贮藏期间的TVC呈上升趋势。前3天各组间无显著性差异(>0.05),可能是由于贮藏前期微生物比较少。第3天到第6天,对照组和其他3组有显著性差异(<0.05),但是3种膜包装的鲍鱼菌落总数无显著性差异,这可能是由于薄膜可以减少微生物进入包装,并且在温度为−4 ℃时细菌增长缓慢。抑菌包装主要通过与鲍鱼表面直接接触以抑制细菌生长。前6天到贮藏结束时,空白组的菌落总数最高,达到11.36 log(CFU/g)。Gram等[20]提出鱼类和鱼类产品的微生物上限一般为6 log(CFU/g),感觉排斥发生在8 log(CFU/g)时。在贮藏期间2种抑菌包装的菌落总数低于原淀粉组的。

图7 冷藏期间鲍鱼的菌落总数(TVC)变化
2.3.2 薄膜对鲍鱼总挥发性盐基氮的影响
4组鲍鱼冷藏期间总挥发性盐基氮(TVB-N)变化如图8所示。新鲜鲍鱼样品的初始TVB-N值为(1.296 7±0.17)mg/h。在储存过程中,鲍鱼的TVB-N值逐渐增加,从图8可以看出,前6天,各组样品之间TVB-N值变化平缓,各组样品之间无显著性差异(>0.05)。这有可能是由于在储藏的早期,微生物的数量较少,并且对蛋白质的降解程度较低,所以TVB-N值的变化并不明显。贮藏6 d后,空白组和其他各组的TVB-N值的显著性增加(<0.05)。对照组在15 d时达到35.13 mg/hg,超过GB 2733—2015《食品安全国家标准鲜、冻动物性水产品》[21]中规定的贝类TVB-N阈值。Starch-g-PHMB/PLA/ PBAT薄膜组和Starch-g-PHMG/PLA/PBAT薄膜组的TVB-N值显著性低于Starch/PLA/PBAT薄膜组的(>0.05)。

图8 冷藏期间鲍鱼的总挥发性盐基氮值变化
2.3.3 薄膜对鲍鱼硫代巴比妥酸的影响
在储存过程中,脂质氧化会导致鲍鱼的肌肉损伤,鲍鱼肉质量较差。从图9可知,鲍鱼的初始TBARS值为(0.210 8±0.002 68)mg/kg,每组样品的TBARS值逐步增加。这可能是在过氧化物的分解过程中,会产生较低级别的醛、酮和羧酸,从而导致在自氧化过程中,脂肪的TBARS值持续升高[22]。从第3天开始,Starch/PLA/PBAT薄膜组与Starch-g- PHMB/PLA/PBAT和Starch-g-PHMG/PLA/PBAT薄膜组显著性增加(<0.05)。可能是由于影响脂肪氧化的因素有氧气、水、微生物等,抑菌膜的氧气透过率比原淀粉膜的小,氧气不容易渗透到包装内,从而降低了鲍鱼的氧化酸败。
2.3.4 鲍鱼贮藏期间的外观变化
鲍鱼在贮藏期间的实物变化如图10所示。随着时间的推移,鲍鱼质地先变硬后变软,鲍鱼的气味逐渐增大。可能是由于鲍鱼死亡后,它的肌动蛋白和肌球蛋白会生成肌动球蛋白,导致它的肌肉丧失了伸展能力,从而导致它的硬度增加。鲍鱼体内含有蛋白酶和微生物分解蛋白质,导致鲍鱼后期变软,并且蛋白质分解过程中会产生氨、硫化氢、三甲胺等物质[23],导致鲍鱼产生腐败气味。

图9 冷藏期间鲍鱼的TBARS变化

图10 贮藏期间鲍鱼的外观变化
3 结语
将PHMB和PHMG接枝到淀粉上以实现淀粉的抗菌功能化。此外,将改性淀粉制成薄膜后,薄膜的阻隔性能增强,同时表现出良好的抗菌活性。当薄膜应用于鲍鱼保鲜时,薄膜通过对细菌的抑制性和对氧气和水蒸气的高阻隔性,抑制了鲍鱼脂质氧化、蛋白质水解,延缓了鲍鱼的腐败变质,有效延长了鲍鱼的保质期。
[1] 贡湘磊, 黄娟. 水产品腐败及保鲜控制[J]. 现代食品, 2022, 28(6): 66-69.
GONG Xiang-lei, HUANG Juan. Corruption and Preservation Control of Aquatic Product[J]. Modern Food, 2022, 28(6): 66-69.
[2] ZHAI Xiao-song, WANG Wen-tao, ZHANG Hui, et al. Effects of High Starch Content on the Physicochemical Properties of Starch/PBAT Nanocomposite Films Prepared by Extrusion Blowing[J]. Carbohydrate Polymers, 2020, 239: 116231.
[3] MZ A, ZZ A, HONG C, et al. Controlled Moisture Permeability of Thermoplastic Starch/Polylactic Acid/ Poly Butylene Adipate-Co-Terephthalate Film for the Autolysis of Straw Mushroom Volvariella Volvacea[J]. Food Chem, 2022, 373: 131409.
[4] CHEN Sheng, LI Cheng-peng, HOU Ting-ting, et al. Polyhexamethylene Guanidine Functionalized Chitosan Nanofiber Membrane with Superior Adsorption and Antibacterial Performances[J]. Reactive and Functional Polymers, 2019, 145(10): 104379.
[5] WANG Bin, LIU Bai-ling, PENG Gang, et al. Synthesis and Antimicrobial Properties of a Guanidine-Based Oligomer Grafted with a Reactive Cationic Surfactant through Michael Addition[J]. Journal of Applied Polymer Science, 2013, 130(5): 3489-3497.
[6] ZHANG Ying-ying, YANG Lan, DONG Qing-feng, et al. Fabrication of Antibacterial Fibrous Films by Electrospinning and Their Application for Japanese Sea Bass (Lateolabrax Japonicus) Preservation[J]. Lebensmittel Wissenschaft Und-Technologie, 2021, 149(1): 111870.
[7] XU H, CHENG H, CHEN L, et al. Enhancing the Physicochemical Properties and Functional Performance of Starch-Based Films Using Inorganic Carbon Materials: A Review[J]. Carbohydrate Polymers, 2022, 295: 119743.
[8] LEAL I, ROSA Y, PENHA J, et al. Development and Application Starch films: PBAT with Additives for Evaluating the Shelf Life of Tommy Atkins Mango in the Fresh-Cut State[J]. Journal of Applied Polymer Science, 2019, 136(1): 48150.
[9] KOBUN R, JOSEPH V, SULAIMAN N, et al. Development of Biodegradable Hybrid Polymer Film for Detection of Formaldehyde in Seafood Products[J]. Sensing and Bio-Sensing Research, 2019, 27: 100310.
[10] ISSAADI K, HABI A, GROHENS Y, et al. Effect of the Montmorillonite Intercalant and Anhydride Maleic Grafting on Polylactic Acid Structure and Properties[J]. Applied Clay Science, 2015, 107: 62-69.
[11] WANG Li, XU Jing-ge, ZHANG Meng-meng, et al. Preservation of Soy Protein-Based Meat Analogues by Using PLA/PBAT Antimicrobial Packaging Film[J]. Food Chemistry, 2022, 380: 132022.
[12] 刘健, 王海雁, 赵淑江. 牛津杯法测定五倍子对大黄鱼病原弧菌的体外抑菌活力[J]. 海洋科学, 2009, 33(11): 44-47.
LIU Jian, WANG Hai-yan, ZHAO Shu-jiang. Determination of the Antibacterial Activity of Galla Chinensis on Pathogen Vibrio of Pseudosciaena Crocea by Oxford Plate Assay System[J]. Marine Sciences, 2009, 33(11): 44-47.
[13] GB/T 1040.3—2006, 塑料拉伸性能的测定第3部分:薄膜和薄片的试验条件[S].
GB/T 1040.3—2006, Determination of Tensile Properties of Plastics Part 3: Test Conditions for Films and Sheets[S].
[14] GB/T 1038—2000, 塑料薄膜和薄片气体透过性试验方法压差法[S].
GB/T 1038—2000, Test Method for Gas Permeability of Plastic Films and Sheets Differential Pressure Method[S].
[15] GB 4789.2—2022, 食品卫生微生物学检验菌落总数测定[S].
GB 4789.2—2022, Microbiological Test for Food Hygiene Determination of Total Bacterial Colony[S].
[16] OJOGBO E, WARD V, MEKONNEN T H. Functionalized Starch Microparticles for Contact-Active Antimicrobial Polymer Surfaces[J]. Carbohydrate Polymers, 2020, 229: 115422.
[17] ZUO Ying-feng, GU Ji-you, YANG Long, et al. Synthesis and Characterization of Maleic Anhydride Esterified Corn Starch by the Dry Method[J]. International Journal of Biological Macromolecules, 2013, 62: 241-247.
[18] WANG Hong-lu, YANG Qing-hua, GAO Li-cheng, et al. Functional and Physicochemical Properties of Flours and Starches from Different Tuber Crops[J]. International Journal of Biological Macromolecules, 2020, 148: 324-332.
[19] OLEWNIK-KRUSZKOWSKA E, GIERSZEWSKA M, JAKUBOWSKA E, et al. Antibacterial Films Based on PVA and PVA-Chitosan Modified with Poly(hexamethylene guanidine)[J]. Polymers, 2019, 11(12): 2093.
[20] GRAM L, HUSS H H . Microbiological Spoilage of Fish and Fish Products[J]. Int.j.food Microbiol, 1996, 33(1): 121-37.
[21] GB 2733—2015, 食品安全国家标准鲜,冻动物性水产品[S].
GB 2733—2015, National Food Safety Standard for Fresh and Frozen Animal Fishery Products [S].
[22] PRABHAKAR P K, VATSA S, SRIVASTAV P P, et al. A Comprehensive Review on Freshness of Fish and Assessment: Analytical Methods and Recent Innovations[J]. Food Research International, 2020, 133: 109157.
[23] 姜悦. Nano-TiO2改性抑菌薄膜制备及其对鲢鱼保鲜的应用研究[D]. 上海: 上海海洋大学, 2020.
JIANG Yue. Preparation of Nano-TiO2Modified Antibacterial Film and Its Application in Preservation of Silver Carp[D]. Shanghai: Shanghai Ocean University, 2020.
Application of Guanidine Anchored Starch-based Antimicrobial Packaging Films in Abalone
TANG Shu-ronga,b, DING Yonga,b, HAO Yia,b, TIAN Zhi-hanga,b, LIU Zhuo-lina,b, CHEN Xiao-hana,b, LI Lia,b
(a. College of Food Sciences and Technology b. Engineering Research Center of Food Thermal-processing Technology, Shanghai Ocean University, Shanghai 201306, China)
The work aims to develop a grafted antibacterial packaging and apply it to the preservation of aquatic products, so as to provide a new way for further application of grafted packaging films in production. First, polyhexamethylene biguanide hydrochloride (PHMB) and polyhexamethyleneguanidine hydrochloride (PHMG) were grafted onto starch. Then, they were subject to blending modification with polylactic acid (PLA) and poly (butylene adipate co-terephthalate) (PBAT) to prepare a grafted antibacterial packaging film by casting extrusion and apply the film to preservation of abalone. The antimicrobialization of starch was achieved by grafting PHMB and PHMG onto starch.The barrier property of the PLA/PBAT film with PHMB and PHMG was significantly improved (<0.05). It imparted bacteriostasis properties to the film, and delayed the increase of the total colonies, thiobarbituric acid and volatile base nitrogen in abalone. The grafting of PHMB and PHMG onto starch effectively improves the barrier property of the film. The starch-g-PHMB/PLA/PBAT and starch-g-PHMG/PLA/PBAT films can effectively inhabit the microbial action, delay the oxidation and spoilage of abalone and effectively extend the shelf life of abalone.
graft; polyhexamethylene biguanide hydrochloride; polyhexamethyleneguanidine hydrochloride; starch; abalone preservation
TS254.4
A
1001-3563(2023)15-0094-09
10.19554/j.cnki.1001-3563.2023.15.013
2023−05−18
上海市地方能力建设专项(19050502000)
唐淑蓉(1997—),女,硕士生,主攻食品加工与贮藏。
李立(1977—),男,博士,教授,主要研究方向为食品加工与贮藏。
责任编辑:曾钰婵
