花色苷微胶囊的制备及其理化性质研究
2023-08-12冯志强张阮冰段邓乐张佳生蔡哲妍王琴余元善肖更生
冯志强,张阮冰,段邓乐,张佳生,蔡哲妍,王琴,余元善,肖更生
花色苷微胶囊的制备及其理化性质研究
冯志强1,张阮冰1,段邓乐1,张佳生1,蔡哲妍1,王琴1,余元善2,肖更生1
(1.仲恺农业工程学院 a.广东省岭南特色食品科学与技术重点实验室 b.农业农村部岭南特色食品绿色加工与智能制造重点实验室,广州 510225;2.广东农业科学院 蚕业与农产品加工研究所/广东省农产品加工重点实验室,广州 510610)
针对花色苷易降解不稳定等问题,采用复合壁材对花色苷进行微胶囊化处理以提高其加工稳定性。以蓝莓花色苷为芯材,改性玉米淀粉/明胶作为复合壁材,利用真空冷冻干燥法制备花色苷微胶囊。以花色苷的包埋率为评价指标,考察壁芯比、改性玉米淀粉/明胶的质量比、包埋温度和包埋时间对包埋率的影响。通过傅里叶变换红外光谱(FTIR)、扫描电镜(SEM)、热重分析(TGA)对其进行表征并测定其抗氧化性。当壁芯比为8∶1、改性玉米淀粉/明胶质量比为1∶2、包埋温度为60 ℃、包埋时间为40 min时,制备的微胶囊具有更高的包埋率。FTIR结果表明花色苷被成功地包埋。制备的微胶囊呈不规则的片层结构,整体表现光滑,表面无团聚现象。微胶囊化后的花色苷热稳定性、抗氧化能力均有所提高。所制备的花色苷微胶囊具有热稳定性高、抗氧化性强、壁材间相容性好等特点,在食品工业化应用方面具有巨大潜力。
花色苷;微胶囊;冷冻干燥;性质分析
花青素是植物中最大的一类天然水溶性色素[1],通常以糖苷形式存在,称为花色苷。花色苷在自然界中含量丰富,具有多种有益健康的活性,如抗炎、抗糖尿病、抗癌、与生物系统高度相容等,并且无毒,因此花色苷被认为是非常适合在食品工业中应用的天然抗氧化剂[2]。然而,花色苷是一类不稳定的化合物,容易受到pH、光线、温度、酶、氧气和金属离子等因素的影响[3]。因此需要采取一定的措施来保护花色苷免受外界不良条件的影响。
微胶囊化是一种令人满意的封装技术,其可以有效保护花色苷免受恶劣环境如高温、光照、金属离子、碱性和氧气等的影响。在微胶囊化过程中,作为活性核心材料的芯材被捕获到作为壁材或载体材料的聚合物中,形成一个多组分结构,因此壁材可以防止芯材活性丧失或降解。其次,微胶囊化可以促进目标吸附区域的受控释放,微胶囊化还解决了花色苷在食品工业中应用的有关难题[4]。这种封装技术通过在花色苷与外部不良条件之间建立起一道物理化学的屏障,以达到保护核心材料的目的。目前,这类尺寸从微米到纳米的微胶囊日益受到人们的关注,在制药、化妆品、食品和农业等行业都有广泛的应用[5]。因此,本文以蓝莓花色苷为芯材,以改性玉米淀粉与明胶作为复合壁材,利用冷冻干燥法制备微胶囊。通过单因素实验来探究其最佳制备工艺,利用FTIR、SEM对其进行表征,并对其抗氧化活性、热稳定性进行评价。为蓝莓花色苷的开发利用提供研究基础,为花色苷微胶囊在食品工业中的应用提供技术方法和理论参考。
1 实验
1.1 材料与试剂
主要材料与试剂:蓝莓花色苷提取物,实验室自提;改性玉米淀粉,山东众友生物科技有限公司;明胶,天津大茂化学试剂厂;氯化钾、醋酸钠、柠檬酸、柠檬酸钠、盐酸、无水乙醇、磷酸二氢钾、2, 2-联苯基-1-苦基肼基(DPPH),均为分析纯;2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
主要仪器与设备:HH-J2磁力搅拌水浴锅,常州金坛精达仪器制造公司;TU-1900紫外分光光度计,北京普析通用仪器有限公司;YP2002分析天平,上海佑科仪器仪表有限公司;SCIENTZ-50F真空冷冻干燥机,宁波新芝生物科技股份有限公司;L550离心机,湖南湘仪实验室仪器开发有限公司;酶标仪INFINITE M PLEX,德国帝肯;Nicolet IS5傅里叶变换红外光谱仪,美国赛默飞公司;EVO 18扫描电镜,德国蔡司;同步热分析仪,NETZSCH STA 449F3,德国耐驰。
1.3 花色苷提取及微胶囊的制备
称取30 g蓝莓浆液,加入适量的体积分数为70%的酸化乙醇(如无特殊说明,均含体积分数为0.1%的HCl),然后放入超声波微波组合反应系统中反应提取(超声功率为180 W、微波功率为300 W)。提取后的样品在4 000 r/min下离心15 min,取上清液置于旋转蒸发仪内进行蒸发浓缩,浓缩后定容至250 mL,用于后续的分析测定。以改性玉米淀粉与明胶为复合壁材,蓝莓花色苷为芯材,利用饱和溶液法制备花色苷微胶囊。改性玉米淀粉和明胶以一定比例放入磁力搅拌水浴锅中进行均质处理,混合完全后,按比例加入蓝莓花色苷,继续搅拌一定时间即可获得微胶囊溶液,预冻后转移至冻干机中干燥48 h,取出研磨后即可得到花色苷微胶囊粉末。
1.4 包埋率计算
包埋率的计算参考宛美志的方法[6]并作一定修改。微胶囊总花色苷含量的测定:准确称量200 mg样品粉末,加入少量pH=3.0的柠檬酸-柠檬酸钠缓冲溶液进行研磨,用研锤和研钵粉碎样品,然后用10 mL容量瓶定容;定容后以4 000 r/min的转速离心10 min,取上清液,根据pH示差法测量过滤后样品的总花色苷含量。
微胶囊表面花色苷含量的测定:准确称取200 mg样品粉末,用无水乙醇快速冲洗微胶囊表面,转移至10 mL容量瓶中定容;以4 000 r/min的转速离心10 min,取上清液计算表面花色苷的含量。
根据pH示差法计算花色苷含量():
(mg/g)={[(520–700)pH1.0–(520–700)pH4.5]×w×F×103×}/(××) (1)
微胶囊包埋率()参照式(2)来计算。
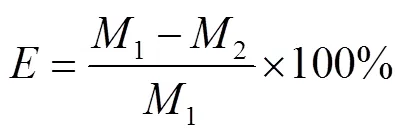
式中:1为微胶囊总花色苷的含量,mg/mL;2为微胶囊表面花色苷的含量,mg/mL。
1.5 单因素实验
1.5.1 壁芯比对微胶囊包埋率的影响
考察壁芯比(4∶1、8∶1、12∶1、14∶1、16∶1)对蓝莓花色苷微胶囊包埋率的影响,质量分数为10%的复合壁材(玉米淀粉和明胶质量比3∶1)溶液与芯材溶液混合后50 ℃水浴加热并搅拌30 min[7],样品冷却后置于−80 ℃冰箱中预冻12 h,然后进行真空冷冻干燥,干燥至恒重后研磨得到微胶囊粉末。计算包埋率,以产物的包埋率为指标,确定较佳的壁芯比。
1.5.2 改性玉米淀粉和明胶质量比对微胶囊包埋率的影响
其他处理条件不变,以最佳壁芯比条件下包埋,确定最佳的改性玉米淀粉与明胶质量比(1∶2、1∶1、2∶1、3∶1、4∶1)。
1.5.3 包埋温度对微胶囊包埋率的影响
其他处理条件不变,以最佳壁芯比、改性玉米淀粉和明胶比例对花色苷进行包埋,分析确定包埋温度(30、40、50、60、70 ℃)对蓝莓花色苷微胶囊包埋率的影响。
1.6 包埋时间对微胶囊包埋率的影响
其他处理条件不变,以最佳壁芯比、改性玉米淀粉和明胶比、包埋温度对花色苷进行包埋,分析确定包埋时间(20、30、40、50、60 min)对蓝莓花色苷微胶囊包埋率的影响。
1.7 傅里叶变换红外光谱(FTIR)
采用溴化钾压片,厚度为0.1~1 mm,利用红外光谱仪进行分析。光谱扫描范围为500~4 000 cm−1,分辨率为4 cm−1,扫描次数为32次。
1.8 SEM分析
在样品台贴上一层导电双面胶,将购买的明胶、改性玉米淀粉、冻干的花色苷与微胶囊粉末分别附于导电胶上,并用洗耳球吹去多余的粉末;样品喷金后设置加速电压15 kV,在适当的倍数下观察微胶囊粉末的表面形态结构。
1.9 TG分析
用同步热分析仪进行热分析。将所检测的样品以10 min/℃的恒定升温速率加热至600 ℃。
1.10 蓝莓花色苷微胶囊体外抗氧化活性测定
1.10.1 DPPH清除活性测定
0.4 mmol DPPH溶液配制:称取0.016 g的DPPH,用无水乙醇定容至100 mL。花色苷溶液分别用体积分数为70%的乙醇稀释至质量浓度分别为0.1、0.05、0.02、0.01、0.005 mg/mL。然后分别将2 mL样品溶液加入到2 mL的DPPH溶液和体积分数为70%的乙醇中,并在室温避光条件下充分混合。30 min后测定517 nm处的吸光度,以2 mL 70%乙醇+2 mL DPPH作为空白对照。DPPH清除能力按式(3)计算。

式中:为DPPH清除率,%;r为2 mL体积分数为70%的乙醇和2 mL DPPH溶液在517 nm处的吸光值;t为2 mL样品和2 mL DPPH溶液在517 nm处的吸光值;0为2 mL样品+2 mL体积分数为70%的乙醇在517 nm处的吸光值。
1.10.2 ABTS抗氧化活性测定
ABTS法又称TEAC(Trolox Equivalent Antioxidant Capacity)法,根据ABTS试剂盒说明书进行操作测定蓝莓花色苷微胶囊的总抗氧化能力。ABTS对自由基的清除活性表示为每毫升样品溶液相当于几毫摩尔的Trolox,单位为mmol/mL。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 壁芯质量比对微胶囊包埋率的影响
在微胶囊的制备过程中,壁芯比是影响微胶囊制备的一个重要因素。合理的壁芯比可以保证微胶囊保持良好的稳定性与包埋率,且不影响微胶囊的特性。由图1可知,壁芯比为8∶1时包埋率最高为62.07%,随着壁芯比的提高,包埋率有所波动,但总体呈下降趋势。这是因为改性玉米淀粉和明胶混合物适当的增加,使其可以与花色苷的共价结合键得到加强,使壁与芯之间的结合更加牢固,包埋率明显提高。适量的多酚可以改善花青素-明胶凝胶的网络结构和稳定性,这是提高包封率的关键因素。多酚的存在增加了明胶中β-转角的含量,降低了明胶中β-折叠的含量,多酚的共价和非共价交联可以提高明胶微观结构的有序性和包封率。

图1 壁芯比对包埋率的影响
2.1.2 改性玉米淀粉和明胶质量比对微胶囊包埋率的影响
由图2可知,改性玉米淀粉的比例与花色苷微的胶囊包埋率呈负相关关系,改性玉米淀粉和明胶比例为1∶2时包埋率最高(74.5%)。原因可能是明胶与淀粉之间发生了交联,酯化和键合作用使分子之间更加紧密[8]。党旭岗等[9]提到利用改性淀粉的羰基与明胶分子上的赖氨酸和羟赖氨酸残基上的ε-氨基发生交联,可以形成结构稳定的席夫碱(Schiffs Base),改善了复合壁材中明胶的作用,使得花色微胶囊的包埋率不断上升。

图2 改性玉米淀粉和明胶质量比对包埋率的影响
2.1.3 包埋温度对微胶囊包埋率的影响
包埋温度对微胶囊包埋率的影响如图3所示,随温度的升高,包埋率缓慢上升,在60 ℃达到最高值,然后呈下降趋势。当包埋温度为40~70 ℃时,其包埋率均在40%以上。这可能是因为温度在30~60 ℃时,改性玉米淀粉进行的热处理处于一个淀粉糊化的可逆吸水和不可逆吸水的阶段,淀粉颗粒吸水后体积变大,但结晶区胶束还未完全消失;当温度高于60 ℃时,淀粉颗粒发生解体,减少了淀粉颗粒中可用的水结合位点的数量,所以包埋率随之下降[10]。Wang等[11]也提到,在高温(70~90 ℃)下,玉米淀粉颗粒的晶体结构被破坏。特别是玉米淀粉颗粒中的氢键被破坏,水与游离羟基相结合。在此过程中,玉米淀粉颗粒中的支链淀粉双螺旋完全打开,晶体结构完全消除。此外,温度过高使花色苷降解也是包埋率下降的一个重要原因。花色苷微胶囊化后具有更高的耐热性,随着温度的升高,可以推断耐热性的影响更加明显[12]。

图3 包埋温度对包埋率的影响
2.1.4 包埋时间对微胶囊包埋率的影响
如图4所示,当包埋时间为40 min时,花色苷的包埋率最高,达到75%,然后随着包埋时间的延长而呈现减小趋势。研究结果表明,短时间磁搅拌处理可以提高花色苷核心材料的包埋率,这可能是因为磁搅拌处理可以将聚合物分子向外延伸,复合壁材与花色苷紧密结合,从而提高花色苷包埋率。随着时间延长,热处理后改性玉米淀粉受损。搅拌也会降低淀粉颗粒的绝对尺寸,从而影响淀粉的热特性和糊化特性[13]。因此当包埋时间过长时,花色苷微胶囊的包埋率会呈现下降趋势。
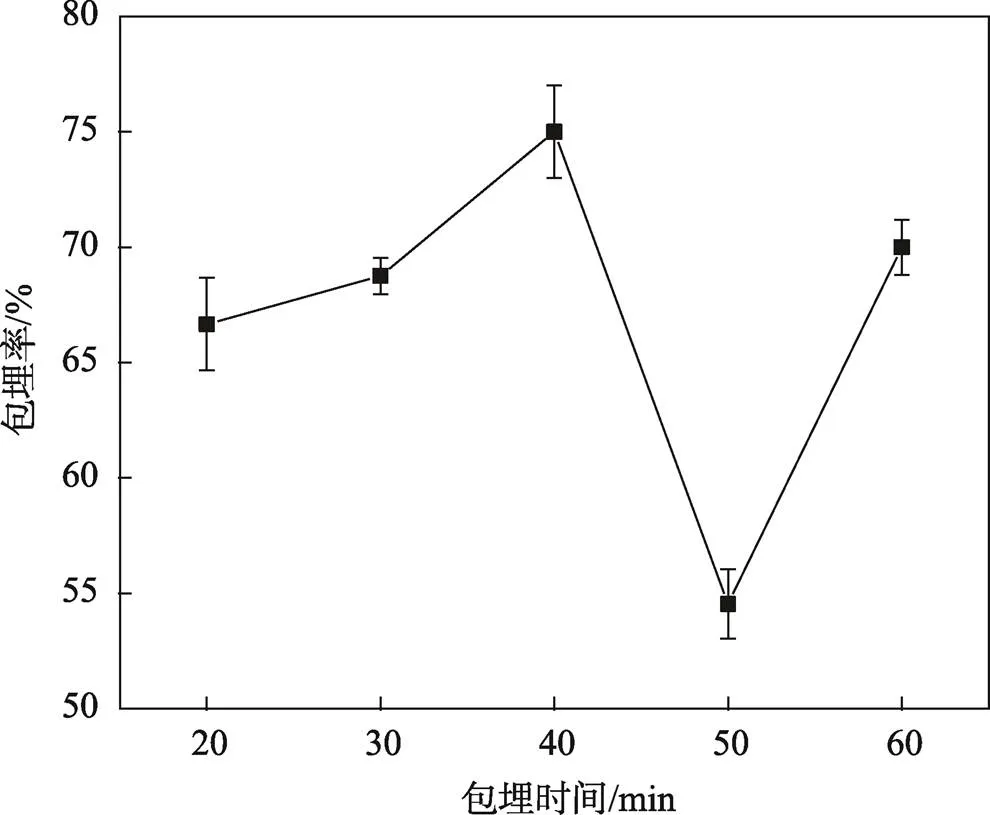
图4 包埋时间对包埋率的影响
2.2 FTIR分析
如图5所示,明胶在3 080 cm−1处的酰胺A带出现在微胶囊中,表明复合壁材成功制备。改性玉米淀粉在2 930、1 640 cm−1处附近的尖峰,分别属于淀粉所含的葡萄糖中饱和烃C−H产生的伸缩振动吸收峰和分子内水分子的吸收峰;3 290 cm−1附近的条带与O−H键相关;花色苷在1 730 cm−1处的峰与酮羰基C=O基团的伸展有关,但在微胶囊中消失,表明花色苷提取物的吸收峰被壁材多糖的碳骨架掩盖,证明花色苷被成功地包埋在改性淀粉/明胶复合壁材中。鲍杰[14]在其研究中也有相似的结果。

图5 微胶囊、明胶、花色苷及玉米变性淀粉FTIR谱图
2.3 微观结构分析
花色苷、明胶、改性玉米淀粉及微胶囊在扫描电子显微镜观察的结果如图6所示。冻干的花色苷粉末呈现不规则的颗粒状,明胶与改性玉米淀粉分别呈现出块状与球形。制备的微胶囊呈现不规则的片层结构,整体表现光滑,表面无团聚现象。这表明玉米变性淀粉与明胶具有较好的相容性,但少数微胶囊样品表面有刮痕与皱褶,这可能是研磨过程中导致的。

图6 微胶囊、明胶、花色苷及改性玉米淀粉SEM图
2.4 热稳定性分析
微胶囊、明胶、花色苷及改性玉米淀粉的TG、DTG分析如图7所示,质量损失主要有3个阶段。第1阶段的质量损失出现在100 ℃以下,这是由于表面水分蒸发所导致的。可以从DTG图中发现花色苷的初始降解温度较低,这一阶段花色苷最大质量损失率出现在58 ℃。可以认为花色苷被包埋前吸湿性较高,因此在第1阶段的质量损失较多,微胶囊较小的吸湿性将有利于保持其颜色和生物活性。第2阶段是100~200 ℃,在此期间,样品由于结合水和挥发成分的损失,导致质量缓慢损失。在此阶段微胶囊的结合水和挥发性成分都被有效地阻挡在内部,不会很快受到高温的影响。第3阶段发生在200~370 ℃,这一阶段花色苷的质量由于糖苷的热降解而不断损失,微胶囊质量损失主要是由于壁材的热降解,产生了二氧化碳和水等中间体,最后样品碳化变成灰分。可以发现,微胶囊始终保持较高的热稳定性。

图7 花色苷微胶囊及花色苷TG、DTG图
2.5 蓝莓花色苷微胶囊体外抗氧化活性测定结果与分析
2.5.1 DPPH自由基清除能力
由图8可知,蓝莓花色苷及微胶囊的DPPH清除率均随着质量浓度的增加而升高。DPPH自由基是一种以氮为中心的稳定自由基。DPPH自由基清除实验是基于DPPH被抗氧化剂猝灭的能力。据报道,DPPH清除率与酚类化合物如花色苷密切相关,样品的浓度与抗氧化活性呈正相关关系[15]。从图8中可以明显看出,花色苷微胶囊的DPPH清除率比未包埋的花色苷的高,证明改性玉米淀粉和明胶做的壁材对花色苷起了一定的保护作用,提高了抗氧化活性,且壁材里明胶中的连接区是由氢键稳定的,类似于天然胶原蛋白中的氢键,连接区通过柔性多肽链(弹性段)相互连接,也具有一定抗氧化的能力。

图8 花色苷及其微胶囊的DPPH自由基清除能力
2.5.2 总抗氧化活性(ABTS法)测定
在氧化剂存在的条件下,ABTS会被氧化成ABTS+。由图9可知,随着样品质量浓度的增加,ABTS自由基清除率上升。ABTS测定抗氧化活性的原理与DPPH很相似,都是涉及电子转移[16]。花色苷微胶囊化后ABTS+清除能力略有提高,这可能是因为花色苷微胶囊通过改性玉米淀粉和明胶的复合壁材将花色苷包埋在壁材内部,对花色苷具有一定的保护作用。花色苷微胶囊的抗氧化活性也相对较高,且蓝莓的提取物本身含有酚类化合物,具有一定的抗氧化活性,因此抗氧化能力比其他物质要强。乔世豪等[17]提到花色苷的多酚羟基可与明胶的氨基/羟基相互作用(如氢键),可改变其颜色和抗氧化性能等。

图9 蓝莓花色苷及其微胶囊的总抗氧化活性
3 结语
以改性玉米淀粉和明胶作为复合壁芯,利用真空冷冻干燥法制备蓝莓花色苷微胶囊。结果得出最佳制备条件:壁芯比为8∶1、改性玉米淀粉/明胶质量比为1∶2、包埋温度为60 ℃、包埋时间为40 min,得到的花色苷微胶囊包埋率为75%。包埋后热稳定性有所提高,DPPH、ABTS实验表明花色苷和微胶囊的抗氧化性与浓度呈正相关关系,且经过微胶囊化的花色苷抗氧化活性比未处理的花色苷抗氧化活性要强,表明微胶囊化有利于保护花色苷。
花色苷普遍存在于自然界中,是一种对人体有益的物质。本实验运用微胶囊化技术对其进行包埋,对花色苷的保存和传递具有一定的意义。随着我国食品行业的不断发展、人们生活水平的提高,大多数人的饮食习惯和健康营养意识也在不断改善和提高,均衡的营养膳食结构逐渐成为人们的追求。现如今新型的食品加工和营养学通过对食品及其成分的干预来实现食品功能营养最大化,服务于有此追求的人们。微胶囊化是一种新兴技术,有很大的发展前景。除了在食品行业,微胶囊化在药物输送、纺织工业、生物技术、农业等方面都有一定的应用,具有很广阔的市场前景。
[1] ZHAO Lei, PAN Fei, MEHMOOD A, et al. Improved Color Stability of Anthocyanins in the Presence of Ascorbic Acid with the Combination of Rosmarinic Acid and Xanthan Gum[J]. Food Chemistry, 2021, 351: 129317.
[2] WU Ying-mei, XU Long-quan, LIU Xiao-yi, et al. Effect of Thermosonication Treatment on Blueberry Juice Quality: Total Phenolics, Flavonoids, Anthocyanin, and Antioxidant Activity[J]. LWT- Food Science and Technology, 2021, 150: 112021.
[3] TAN Chen, WANG Jing, SUN Bao-guo. Polysaccharide Dual Coating of Yeast Capsules for Stabilization of Anthocyanins[J]. Food Chemistry, 2021, 357: 129652.
[4] FLORES F, SINGH R, KONG Fan-bin. Anthocyanin Extraction, Microencapsulation and Release Properties during in Vitro Digestion[J]. Food Reviews International, 2015, 32(1): 46-67.
[5] WANG Feng, FENG Jun, GAO Chang-you. Manipulating the Properties of Coacervated Polyelectrolyte Microcapsules by Chemical Crosslinking[J]. Colloid and Polymer Science, 2008, 286(8): 951-957.
[6] 宛美志. 蔓越莓花色苷提取纯化工艺优化及微胶囊制备研究[D]. 沈阳: 沈阳农业大学, 2018: 52-53.
WAN Mei-zhi. Optimization of Extraction and Purification Process of Cranberry Anthocyanins and Preparation of Microcapsules[D]. Shenyang: Shenyang Agricultural University, 2018: 52-53.
[7] XU Qing, LI Bing-jing, WANG Dai-bo, et al. Microencapsulation and Stability Analysis of Blueberry Anthocyanins[J]. IOP Conference Series: Earth and Environmental Science, IOP Publishing, 2019, 252(5): 052133.
[8] 李建峰, 雷洪, 霍冀川, 等. 明胶改性玉米淀粉用于玻纤浸润成膜剂的研究[J]. 玻璃, 2015, 42(3): 17-23.
LI Jian-feng, LEI Hong, HUO Ji-chuan, et al. Gelatin Modified Corn Starch and Its Application as Film-Forming Agent in Glass Fibre Sizing[J]. Glass, 2015, 42(3): 17-23.
[9] 党旭岗, 单志华, 陈慧. 氧化玉米淀粉/明胶复合材料的制备及吸水性能研究[J]. 中国皮革, 2016, 45(5): 36-39.
DANG Xu-gang, SHAN Zhi-hua, CHEN Hui. Preparation and Water Absorption Capacity of Oxidized Corn Starch/Gelatin Composite Material[J]. China Leather, 2016, 45(5): 36-39.
[10] BAKOWSKA-BARCZAK A. Black Currant Polyphenols: Their Storage Stability and Microencapsulation[J]. Industrial Crops and Products, 2011, 34(2): 1301-1309.
[11] WANG Bin, GAO Wei, KANG Xue-min, et al. Structural Changes in Corn Starch Granules Treated at Different Temperatures[J]. Food Hydrocolloids, 2021, 118(2): 106760.
[12] BLENNOW A, HANSEN M, SCHULZ A, et al. The Molecular Deposition of Transgenically Modified Starch in the Starch Granule as Imaged by Functional Microscopy[J]. Journal of Structural Biology, 2003, 143(3): 229-241.
[13] JIAO Gui-ai, WEI R, TANG Shao-qing, et al. Stirring Affects Starch Granule Morphology and the Functional Properties of Rice Flour[J]. Starch - Starke, 2017, 70(3): 1700247.
[14] 鲍杰. 微胶囊化对玫瑰花渣色素理化性质及稳定性的影响研究[D]. 北京: 北京林业大学, 2019: 36-40.
BAO Jie. Effect of Microencapsulation on Physicochemical Properties and Stability of Rose Residue Pigment[D]. Beijing: Beijing Forestry University, 2019: 36-40.
[15] RIGON R T, ZAPATA NOREÑA C P. Microencapsulation by Spray-Drying of Bioactive Compounds Extracted from Blackberry (Rubus Fruticosus)[J]. Journal of Food Science and Technology, 2016, 53(3): 1515-1524.
[16] KRIENGSAK T, UNAROJ B, KEVIN C. Comparison of ABTS, DPPH, FRAP, and ORAC Assays for Estimating Antioxidant Activity from Guava Fruit Extracts[J]. Journal of Food Composition and Analysis, 2006, 19: 669-675.
[17] 乔世豪, 王强, 胡露丹, 等. 花青素在食品质量指示中的应用进展[J]. 包装工程, 2022, 43(17): 49-58.
QIAO Shi-hao, WANG Qiang, HU Lu-dan, et al. Application Progress of Anthocyanins in Food Quality Indication[J]. Packaging Engineering, 2022, 43(17): 49-58.
Preparation and Physicochemical Properties of Anthocyanin Microcapsules
FENG Zhi-qiang1,ZHANG Ruan-bing1, DUAN Deng-le1,ZHANG Jia-sheng1, CAI Zhe-yan1, WANG Qin1,YU Yuan-shan2, XIAO Geng-sheng1
(a. Guangdong Provincial Key Laboratory of Lingnan Specialty Food Science and Technology b. Key Laboratory of Green Processing and Intelligent Manufacturing of Lingnan Specialty Food, Ministry of Agriculture, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China; 2. Sericulture and Agri-Food Research Institute/Guangdong Key Laboratory of Agricultural Products Processing, Guangdong Academy of Agricultural Sciences, Guangzhou 510610, China)
In view of the easily degradable anthocyanin, the work aims to conduct microcapsule treatment on anthocyanin with compound wall material. In this thesis, anthocyanin microcapsules were prepared by vacuum freeze-drying with blueberry anthocyanin as the core material and modified corn starch and gelatin as the compound wall material. The effects of wall-core ratio, mass ratio of modified corn starch/gelatin, embedding temperature and embedding time on the embedding rate were investigated with anthocyanin embedding rate as evaluation index. It was characterized and its oxidation resistance was determined by Fourier transform infrared spectroscopy (FTIR), scanning electron microscopy (SEM) and thermogravimetric analysis (TGA). The microcapsules prepared at wall-core ratio of 8∶1, modified corn starch/gelatin ratio of 1∶2, embedding temperature of 60 ℃ and embedding time of 40 min had high embedding rate. The FTIR results showed that the anthocyanin was successfully embedded. The microcapsules prepared had irregular lamellar structure, smooth overall performance and no agglomeration on the surface. The thermostability and the antioxidant capacity of the microencapsulated anthocyanin were improved. It can be concluded that anthocyanin microcapsules prepared are featured with high thermal stability, strong antioxidant capacity and good compatibility between wall materials, and have great potential in industrial application of food.
anthocyanin; microcapsule; freeze-drying; property analysis
TS201.1
A
1001-3563(2023)15-0009-07
10.19554/j.cnki.1001-3563.2023.15.002
2022−12−19
广东省岭南特色食品科学与技术重点实验室项目(2021B1212040013);2022大学生创新创业训练计划(X202211347171,X202111347156);东源县蓝莓产业园科技支撑服务项目(D122207C1);广东省普通高校青年创新人才项目(2021KQNCX029)
冯志强(1998—),男,硕士生,主攻食物资源高效开发利用。
段邓乐(1992—),女,博士,副教授,主要研究方向为食物资源高效开发利用。
责任编辑:曾钰婵
