樟芝深层发酵多糖对抗生素相关性腹泻小鼠肠道菌群的调节作用
2023-08-12李华祥陆春雷叶青雅赵灵惠高亚军杨振泉
李华祥,吉 丹,陆春雷,叶青雅,赵灵惠,高亚军,高 璐,杨振泉
(扬州大学食品科学与工程学院,江苏 扬州 225127)
人类的肠道菌群是一个由数万亿细菌组成的微生物生态系统,其中绝大多数属于厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),包括双歧杆菌(Bifidobacterium)、乳酸杆菌(Lactobacillus)、肠球菌(Enterococcus)、产气荚膜梭菌(Clostridium perfringens)和假单胞菌(Pseudomonas)等[1]。肠道菌群的组成、代谢、生理、营养和免疫活动通常高度稳定,但也可能受到年龄、饮食、生活方式、抗生素的使用等多种因素的影响[2]。目前,抗生素参与疾病治疗的现象越来越普遍,但广谱抗生素的大量使用不仅会影响目标病原体,还会干扰肠道中其他共生微生物,降低其定植能力,导致肠道细菌的多样性、均匀度和分类丰富度迅速下降[3]。在长期使用抗生素的过程中,有益菌大量流失[4],同时耐药的有害微生物数量不断增加,导致有害菌逐渐占据主导地位,最终导致患抗生素相关性腹泻及其他慢性疾病的风险急剧增加[3,5-6]。有研究指出,即使是短期服用抗生素也会导致耐药菌群在人类肠道中稳定存在数年[7]。可见,调节肠道菌群稳态和恢复肠道菌群结构对防治部分慢性疾病至关重要。
益生元是一种可促进胃肠道中有益菌生长并对致病菌发挥拮抗作用的活性物质,而一些不易被消化的寡糖和多糖常常具有与益生元相似的功能[8]。自然界中的多糖按来源可分为植物多糖、动物多糖及微生物多糖[9]。其中,微生物多糖中的真菌多糖能够通过选择性刺激有益于宿主健康的一种或有限数量细菌的生长活性来调节肠道菌群并发挥益生元作用[10-11]。此外,真菌多糖还具有改善肠道完整性及减轻肠黏膜损伤等功效,有利于调节肠道菌群平衡[12]。
樟芝(Antrodia cinnamomea)又名牛樟芝、牛樟菇等,是一种珍稀的药食两用蕈菌,具有解酒保肝、抗炎、抗癌、抗肿瘤、抗病毒、降血脂及调剂免疫等多种生物活性[13]。近年来,研究者从樟芝子实体和发酵菌丝体中分离出200余种活性物质[14],其中,多糖是最主要的活性物质之一,具有较高的研发价值。但目前关于樟芝多糖的研究主要集中于活性及药理方面[15-16],对其调节小鼠肠道菌群的相关研究较少。因此,本实验首先提取和纯化樟芝深层发酵所产胞内多糖(Antrodia cinnamomeaintracellular polysaccharides,AIPS)及胞外多糖(Antrodia cinnamomeaexopolysaccharides,AEPS),再对其进行组成分析及结构表征,最后探究其对抗生素相关性腹泻小鼠肠道菌群的调节作用。
1 材料与方法
1.1 动物、材料与试剂
小鼠为无特定病原体(SPF)级ICR小鼠(6 周龄、体质量(20±2)g,使用许可证号:SYXK(苏)2016-0019),均由扬州大学比较医学中心提供。动物实验操作均按扬州大学实验动物伦理委员会的相关规定执行。
樟芝菌株(ATCC 200183)购自美国菌种保存中心,目前保存于扬州大学食品科学与工程学院食品质量与安全控制实验室。
盐酸林可霉素(lincomycin hydrochloride,LIH)上海生工生物工程有限公司;低聚果糖 上海麦克林生化科技股份有限公司;胃蛋白酶 福州飞净生物科技有限公司;BCA蛋白试剂盒 上海碧云天生物技术有限公司;α-淀粉酶(4 000 U/g) 上海源叶生物科技有限公司;无水乙醇、正丁醇、三氯甲烷、苯酚、硫酸、多糖分子质量标准品及单糖标准品 国药集团化学试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
Infinite F50酶标仪 上海勒菲生物科技有限公司;RE-52B旋转蒸发仪 上海雅蓉生化仪器设备有限公司;AlpHA1-2LD冷冻干燥机 德国Martin Christ公司;670-IR+610-IR红外光谱仪 美国Varian公司;5 L发酵罐 汇森生物设备镇江有限公司;1525高效液相色谱仪 美国Waters公司;ICS-5000离子色谱仪美国戴安公司。
1.3 方法
1.3.1 樟芝5 L罐深层发酵
将5 L玻璃发酵罐空消(121 ℃、30 min)后,向其中装入3 L发酵培养基(葡萄糖 20 g/L、酵母浸出粉2 g/L、MgSO4·7H2O 3 g/L、KH2PO43 g/L,pH 4.5)并进行实消(121 ℃、20 min)。冷却后,按1×106个/mL的接种量进行接种,在26 ℃、150 r/min及0.3 m3/h通气量条件下发酵10 d。
1.3.2 樟芝多糖的提取及纯化
1.3.2.1 樟芝胞内多糖的提取
将5 L罐樟芝发酵液用4 层纱布过滤,收集滤渣(菌丝体)并75 ℃烘干。称取10 g干燥并粉碎的樟芝菌丝体粉末,加入100 mL去离子水,95 ℃水浴提取2 h,重复提取2 次,合并上清液并蒸发浓缩至20 mL,加入3 倍体积的无水乙醇,4 ℃静置过夜,离心(8 000 r/min、10 min、4 ℃)、弃上清液,沉淀用超纯水复溶后真空冷冻干燥,即得樟芝胞内粗多糖粉末。为获得足够量的AIPS,上述操作可重复多次。
1.3.2.2 樟芝胞外多糖的提取
将5 L罐樟芝发酵液用4 层纱布过滤,收集滤液,离心(6 000 r/min、10 min、4 ℃)去沉淀,收集上清并蒸发浓缩至20 mL,再加入3 倍体积的无水乙醇,4 ℃静置过夜,离心(8 000 r/min、10 min、4 ℃)弃上清液,沉淀用超纯水复溶后真空冷冻干燥,即得樟芝胞外粗多糖粉末。为获得足够量的AEPS,上述操作可重复多次。
1.3.2.3 樟芝多糖的纯化
采用Sevag法[17]除去樟芝多糖(AEPS及AIPS)中的蛋白质。具体步骤:将正丁醇和三氯甲烷按照体积比1∶4混合,将混合液加入至5 倍体积的樟芝多糖水溶液中,剧烈振荡1 min,4 000 r/min离心10 min,取上层水相,重复多次后,蒸发浓缩去除有机溶剂即可。
1.3.3 樟芝多糖组成分析
1.3.3.1 总糖及蛋白质量分数测定
总糖质量分数测定:以葡萄糖为标准品,用苯酚-硫酸法测定樟芝多糖中的总中性糖质量分数;蛋白质量分数测定:采用BCA蛋白试剂盒测定樟芝多糖中的总蛋白质量分数,操作步骤严格按照说明书进行。
1.3.3.2 单糖组成测定
采用HPLC法检测单糖组成。样品前处理:用2 mol/L的HCl溶液于96 ℃水解多糖样品4 h,再用2 mol/L的NaOH溶液中和;检测条件:仪器为ICS-5000离子色谱仪,色谱柱为CarboPac PA20,柱温为45 ℃,流动相为98.2%的水和1.8%的250 mmol/L NaOH溶液,流速为0.5 mL/min,洗脱30 min;单糖标准品:阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸及葡萄糖醛酸,纯度均为色谱纯。
1.3.4 樟芝多糖分子质量分布的测定
采用高效凝胶过滤色谱法(high performance gel filtration chromatography,HPGFC)测定樟芝多糖的分子质量分布情况。检测条件:仪器为1525高效液相色谱仪,色谱柱为Ultrahydrogel™水溶性凝胶柱(300 mm×7.8 mm),柱温为45 ℃,流动相为0.1 mol/L的NaNO3溶液,流速为0.9 mL/min;右旋糖酐(Dextran)多糖标准品:相对分子质量分别为135 350、3 800、9 750及2 700,纯度均为色谱纯。
1.3.5 樟芝多糖的红外光谱分析
在室温下,称取干燥的樟芝多糖粉末与光谱级KBr粉末一起充分研磨,压片,以纯KBr粉末薄片作为空白背景,在4 000~400 cm-1的波数范围内进行扫描分析。
1.3.6 樟芝多糖体外抗消化能力的测定
1.3.6.1 抗α-淀粉酶消化能力的测定
抗α-淀粉酶消化能力的测定参照文献[18],取10 mL磷酸盐缓冲液,用1 mol/L的HCl溶液调节pH值至6.8,加入100 mg樟芝多糖粉末,再加入20 mgα-淀粉酶使其终浓度为8 U/mL。37 ℃水浴反应150 min,每30 min取样测定释放的还原糖含量,并计算水解度。还原糖含量采用DNS法测定,初始总糖含量(即最初还原糖含量)采用苯酚-硫酸法测定,水解度按照下式计算。
1.3.6.2 抗模拟胃液消化能力的测定
抗模拟胃液消化能力的测定参考文献[19]。首先,配制人工模拟胃液。称取胃蛋白酶3.0 g,用300 mL生理盐水溶解,等体积分为3 份,用盐酸溶液(2 mol/L)分别调节pH值至2.0、3.0和4.0,再用微孔滤膜(0.22 μm)过滤除菌备用。随后,各取10 mL上述不同pH值的模拟胃液,加入100 mg樟芝多糖粉末,37 ℃水浴反应180 min,每30 min取样测定释放的还原糖含量,按照上式计算水解度。
1.3.7 小鼠实验
1.3.7.1 小鼠造模
设置3 个LIH灌胃剂量,分别为2.7、3.7、4.2 g/kgmb,进行连续3 日灌胃造模,每日灌胃两次(上午9点和下午7点各一次)。停止给药后,观察小鼠在随后1~4 d的毛发、饮食、活动及粪便形态等指标,以确定小鼠造模所用LIH的最适给药剂量。
1.3.7.2 小鼠分组及处理
将30 只实验小鼠随机分为5 组(n=6):正常组(NC组)、模型组(RG组)、樟芝胞外多糖处理组(AEPS组)、樟芝胞内多糖处理组(AIPS组)及低聚果糖阳性对照组(FOS组)。随后,在1~3 d,NC组按3.7 g/kgmb的剂量灌胃无菌生理盐水;RG组、AEPS组、AIPS组及FOS组按3.7 g/kgmb的剂量灌胃LIH。各组每日均灌胃两次(上午9点和下午7点各一次);接下来的4~6 d,NC组和RG组每日下午7点按0.03 g/kgmb的剂量灌胃无菌生理盐水,AEPS组按0.03 g/kgmb的剂量灌胃AEPS,AIPS组按0.03 g/kgmb的剂量灌胃AIPS,FOS组按0.03 g/kgmb的剂量灌胃低聚果糖。
1.3.7.3 小鼠粪便16S rDNA测序
第7天处死小鼠并采集小鼠粪便样本,液氮速冻后置于干冰中寄送至北京诺禾致源科技股份有限公司进行16S rDNA测序。采用Illumina NovaSeq6000测序平台。使用正向引物(5’-CCTACGGGNGGCWGCAG-3’)和反向引物(5’-GGACTACHVGGGTATCTAAT-3’)通过聚合酶链式反应(polymerase chain reaction,PCR)扩增16S rDNA基因的V3~V4区域。初始DNA片段用Flash软件进行读取,使用QIIM软件对拼接数据进行质量控制,然后对所有样本的有效Tags以97%的一致性(Identity)进行操作分类单元(operational taxonomic units,OTU)聚类和物种分类分析。
1.4 数据处理与分析
每组实验及检测均设置至少3 个重复。所有数据均以平均值±标准差的形式表示,采用Origin 2021软件绘图。
2 结果与分析
2.1 樟芝多糖的结构分析
用Sevag法经8 次脱蛋白处理后,检测樟芝多糖组成情况。由表1可知,AEPS和AIPS的总中性糖质量分数分别为82%和88%,蛋白质量分数均小于1.5%,纯度已足以用于小鼠实验[20]。此外,AEPS和AIPS的主要组成单糖均为葡萄糖、半乳糖及甘露糖,但含量差异较大。其中,在葡萄糖相对含量方面,AEPS为84.73%,而AIPS为55.31%;在半乳糖相对含量方面,AEPS为7.84%,AIPS却高达28.52%;在甘露糖相对含量方面,AEPS为5.27%,AIPS高达14.34%。此外,AEPS中还含有葡萄糖醛酸和半乳糖醛酸,相对含量分别为0.76%和1.4%,而AIPS中则含有1.83%的氨基半乳糖。
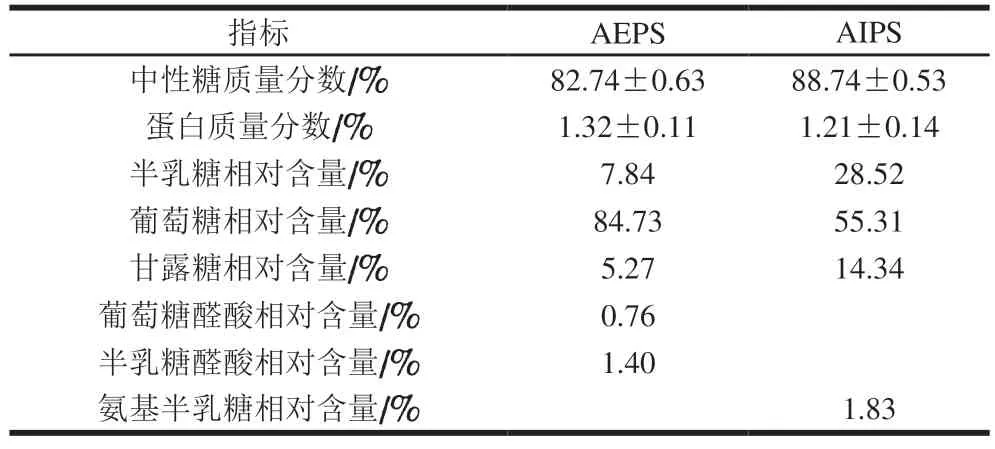
表1 AEPS及AIPS的组成测定结果Table 1 Monosaccharide composition of AEPS and AIPS
2.2 樟芝多糖的分子质量分布
樟芝多糖的分子质量分布结果如图1所示,AEPS主要由3 种不同分子质量的多糖组成,其中分子质量为1 013 kDa的多糖占比为77.96%,分子质量为233 kDa的多糖占比为18.04%,分子质量为28 743 kDa的多糖占比为3.99%。AEPS的平均分子质量为4.16×105Da;AIPS主要由2 种不同分子质量的多糖组成,其中分子质量为12 452 kDa的多糖占比为49.54%,分子质量为1 623 kDa的多糖占比为50.46%。AIPS的平均分子质量为3.52×106Da。可见,AEPS和AIPS在多糖组成上亦有着明显差异。
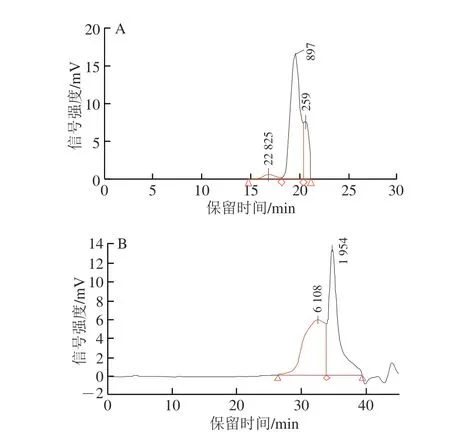
图1 AEPS(A)和AIPS(B)的分子质量分布Fig.1 Molecular mass distribution of AEPS (A) and AIPS (B)
2.3 樟芝多糖的红外光谱分析
樟芝多糖红外光谱分析结果如图2 所示,在4 000~400 cm-1范围内,AEPS在3 400 cm-1左右有强而宽的吸收峰,这主要是由多糖中羟基的伸缩振动引起的;在1 673 cm-1左右有强而宽的吸收峰,这主要是由羰基(C=O)的伸缩引起的,表明AEPS具有酰胺结构;在1 100 cm-1处有强而宽的吸收峰,这主要是由吡喃环结构的C—O键引起的,说明AEPS具有吡喃糖环[21];在944 cm-1处有强而宽的吸收峰,说明AEPS存在β-型糖苷键(图2A)。AIPS在3 276 cm-1左右有强而宽的吸收峰,这主要是由多糖羟基中分子间的氢键伸缩振动引起的[22];在3 000 cm-1左右有吸收峰,这主要是由—CH—键引起的,表明AIPS具有—C≡C—H结构;在1 642 cm-1左右存在强吸收峰,表明A I P S 存在酰胺结构;在1 074 cm-1和1 047 cm-1处存在强吸收峰,表明AIPS存在C—O结构(图2B)。
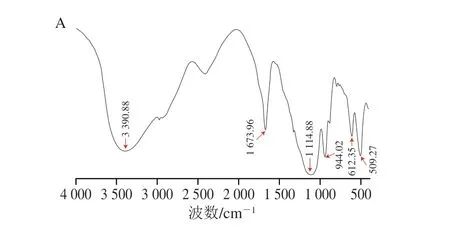
图2 AEPS(A)和AIPS(B)傅里叶变换红外光谱Fig.2 Fourier transform infrared spectra of AEPS (A) and AIPS (B)
2.4 樟芝多糖的体外抗消化能力
建立体外消化模型,对樟芝多糖的抗消化能力进行测定,结果如图3所示。AEPS在α-淀粉酶的作用下,水解度随着时间的延长而增加,在150 min后水解度变化不明显,约为0.02%(图3A)。AEPS在不同pH值的胃模拟液中水解度也较低,在不同pH值条件下的水解度都会随着时间的延长而增加(图3B),其中在pH 2.0条件下水解度最高,210 min时约为0.05%,AEPS在pH 3.0胃模拟液中的水解度高于pH 4.0胃模拟液中的水解度。此外,AIPS在α-淀粉酶的作用下,180 min时的水解度为0.028%(图3C)。AIPS在不同pH值的胃模拟液中水解度较AEPS高,AIPS同样也在pH 2.0的胃模拟液中水解度最高,210 min时为0.064%(图3D)。上述结果表明,AEPS及AIPS均具有较强的抗消化能力,即若口服樟芝多糖,其可顺利进入肠道并发挥作用。
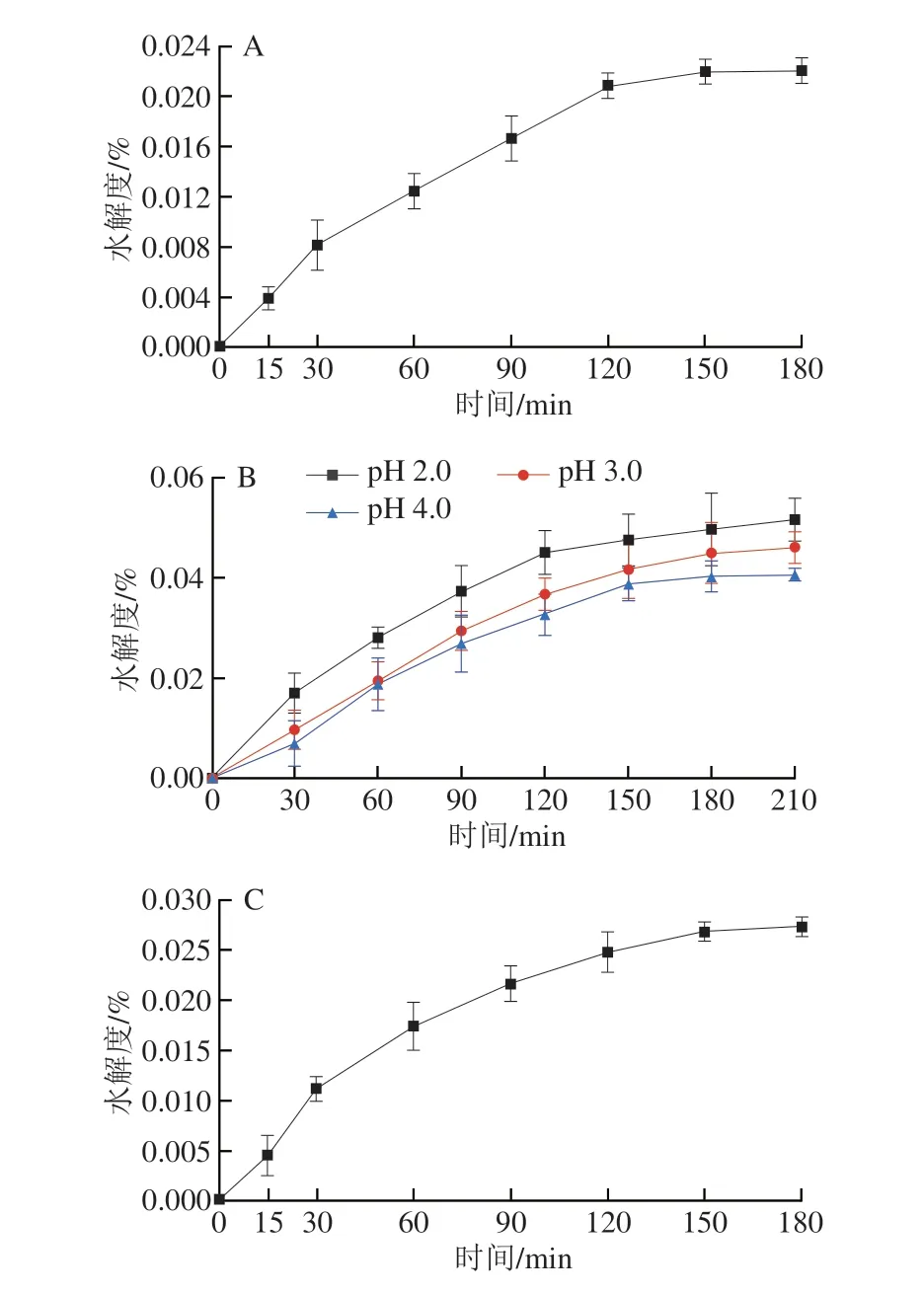
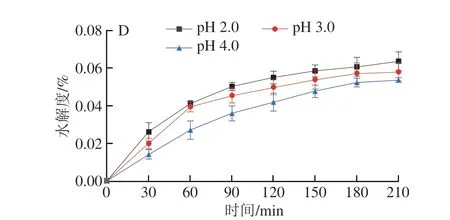
图3 樟芝多糖的体外抗消化能力Fig.3 In vitro digestive resistance of polysaccharides from Antrodia camphorata
2.5 樟芝多糖对抗生素相关性腹泻小鼠肠道菌群的调节作用
2.5.1 不同剂量LIH对小鼠状态的影响
如图4所示,不同LIH剂量组小鼠停药后4 d内的状态和表现差异较为明显。灌胃2.7 g/kgmbLIH的小鼠毛发状态与正常对照组相比没有明显的变化,均较为平滑;此外,小鼠活动正常,摄食量与正常对照组相比无明显差异。灌胃3.7 g/kgmbLIH的小鼠出现轻微的脱毛现象,并且活动迟缓、毛发粗糙、食欲减退,摄食量与正常对照组相比明显减少;灌胃4.2 g/kgmbLIH的小鼠出现多处大面积的脱毛现象,行为活动迟缓、烦躁少动、食欲不振,几乎不摄食。此外,从小鼠粪便形态来看,灌胃2.7 g/kgmbLIH的小鼠出现轻微腹泻,并在停药1 d后即完全恢复正常;灌胃3.7 g/kgmbLIH的小鼠粪便稀软、不成形,呈烂泥状,表现为中度腹泻,并在停药4 d后恢复正常;灌胃4.2 g/kgmbLIH的小鼠粪便稀溏,稀薄如水,呈现水样便,表现为严重腹泻,并在停药4 d后仍持续腹泻。综上所述,最终选择3.7 g/kgmb作为后续小鼠建模的LIH给药剂量。

图4 不同剂量LIH下小鼠停药2~4 d的状态Fig.4 Conditions of mice at 2–4 days after LIH withdrawal
2.5.2 AEPS及AIPS对小鼠肠道菌群的影响
2.5.2.1 肠道菌群多样性分析
为了解各组小鼠体内肠道菌群的物种丰富度和均一性,首先对小鼠肠道菌群测序结果进行α-多样性分析,结果如图5所示。RG组小鼠肠道菌群的多样性明显低于NC组,说明LIH严重破坏了小鼠体内的肠道菌群平衡,并抑制或杀死了大量微生物;同时,灌胃AEPS、AIPS及FOS(低聚果糖)均有助于调节和恢复小鼠肠道菌群的多样性,且AEPS的效果优于AIPS和FOS。
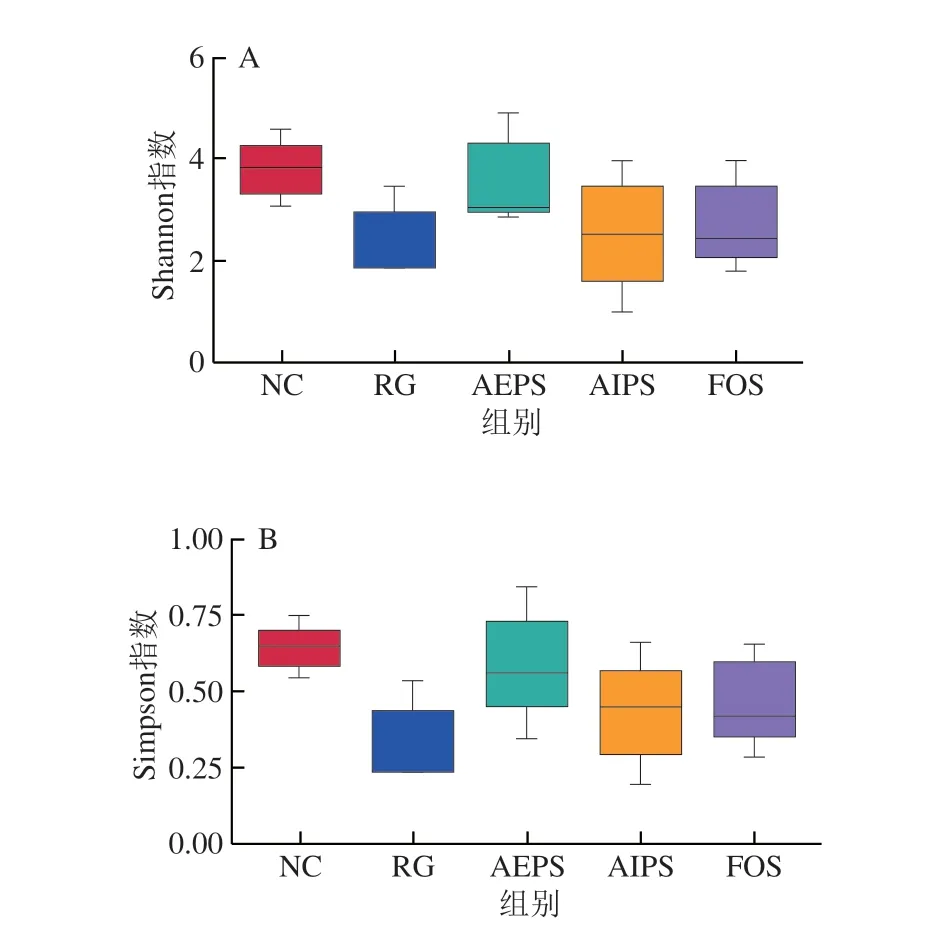
图5 肠道菌群α-多样性分析的Shannon指数(A)和Simpson指数(B)Fig.5 Shannon (A) and Simpson (B) indexes of α-diversity analysis of intestinal microbiota
为了比较不同处理组间小鼠肠道菌群结构的差异,对测序结果进行了β-多样性分析(主坐标分析(principal co-ordinates analysis,PCoA)和非度量多维尺度(non-metric multidimensional scaling,NMDS)分析)(图6)。结果表明,不同处理组之间的小鼠肠道菌群结构均具有明显差异,说明灌胃LIH、AEPS、AIPS及FOS均对小鼠肠道菌群结构产生了较为明显的影响,也说明樟芝多糖对小鼠肠道菌群多样性具有明显的调节作用。此外,从各组中重复样本间的距离来看,各组重复样本均较为集中,说明各重复样本的差异较小,重复性较好。
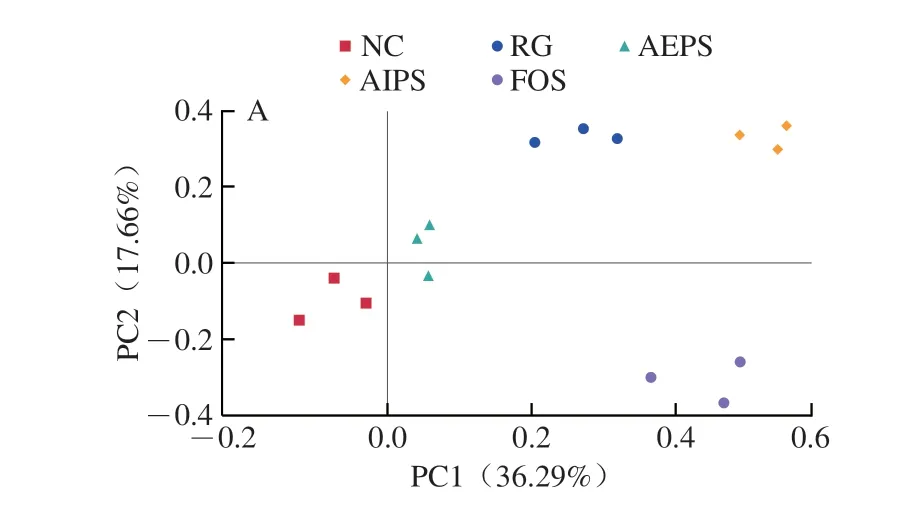
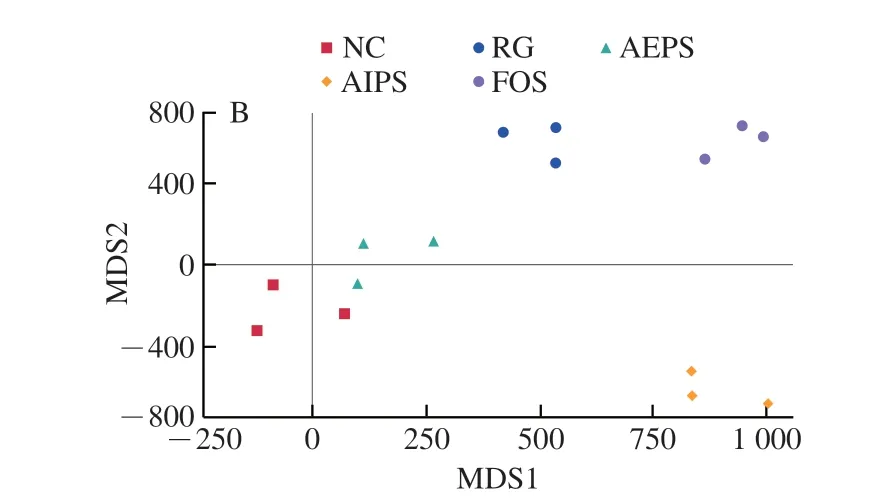
图6 肠道菌群结构的PCoA(A)和NMDS分析(B)Fig.6 Principal co-ordinates analysis (A) and non-metric multidimensional scaling analysis (B) of intestinal flora structure
2.5.2.2 肠道菌群结构分析
为直观查看各组小鼠肠道菌群在不同分类水平上相对丰度较高的物种及其比例,根据各样本在属水平上的物种注释和丰度信息,分别绘制了各组小鼠肠道菌群在门水平、科水平及属水平上丰度排名前10的微生物相对丰度柱形图。结果表明,从门水平来看,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和变形菌门(Proteobacteria)为主要的优势菌群,所占的比例约为总菌群的95%(图7A)。此外,在变形菌门的占比上,NC组明显低于RG、AEPS、AIPS及FOS组,但在拟杆菌门的占比上,NC组明显高于RG、AEPS、AIPS及FOS组;厚壁菌门在各处理组小鼠肠道中的相对丰度较低,但与NC组相比,AEPS组中厚壁菌门的相对丰度大幅增加(图8A)。
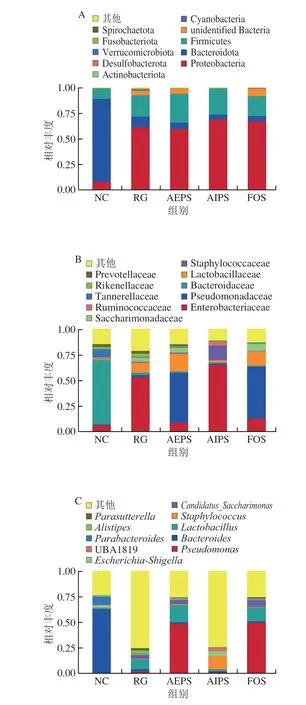
图7 各组小鼠肠道菌群在门水平(A)、科水平(B)及属水平(C)的相对丰度Fig.7 Relative abundance of intestinal flora in mice from different groups at the phylum (A),family (B),and genus (C) levels
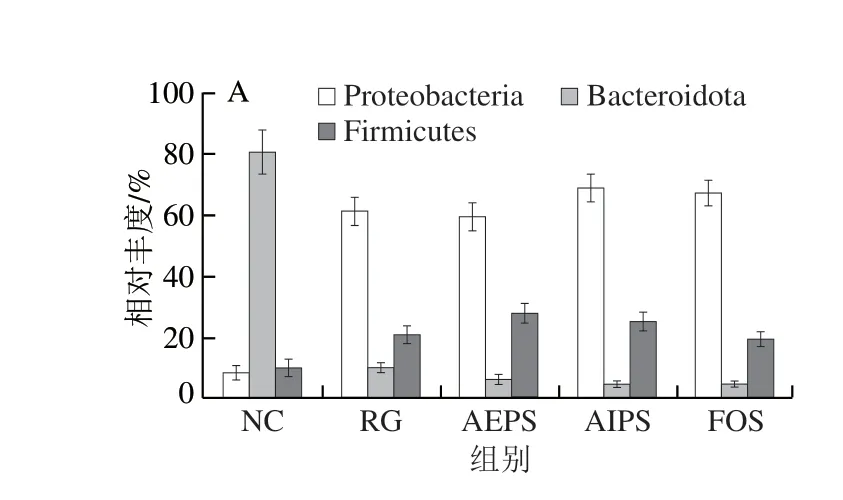
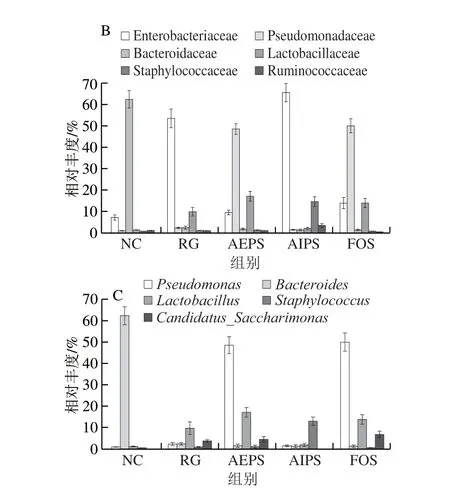
图8 各组小鼠肠道菌群在不同水平上的相对丰度Fig.8 Relative abundance of intestinal bacteria in different groups at different levels
从科水平来看,葡萄球菌科(Staphylococcaceae)、乳酸杆菌科(Lactobacillaceae)、拟杆菌科(Bacteroidaceae)、假单胞菌科(Pseudomonadaceae)、肠杆菌科(Enterobacteriaceae)及疣微菌科(Ruminococcaceae)为主要的优势菌群,所占的比例约为总菌群的80%(图7B)。乳酸杆菌是益生菌群,AEPS组中乳酸杆菌科的相对丰度明显高于NC、RG及AIPS组(图8B),表明灌胃AEPS可以大幅提升小鼠肠道内乳酸杆菌科的相对丰度;肠杆菌科在RG及AIPS组中的相对丰度明显高于NC、AEPS及FOS组。从图8B中可看出,灌胃AIPS后,小鼠肠道内Staphylococcaceae的相对丰度较NC及RG组急剧上升,这一现象在AEPS及FOS组中均未出现,而Staphylococcaceae为有害菌[23]。此外,AIPS组中Ruminococcaceae的相对丰度较其他组明显增加,而Ruminococcaceae亦为有害菌[24]。
从属水平来看,假丝酵母菌属(Candidatus_Saccharimonas)、葡萄球菌属(Staphylococcus)、乳酸菌属(Lactobacillus)、拟杆菌属(Bacteroides)及假单胞菌属(Pseudomonas)为主要优势菌群(图7C、8C)。
为了进一步分析不同组间小鼠肠道菌群相对丰度差异较大的微生物物种,选取微生物相对丰度排名前35 的属,根据其在每个组中的丰度信息,从物种和样本两个层面进行聚类,绘制成热图。如图9 所示,另枝菌属(Alistipes)、拟杆菌属(Bacteroides)、副杆菌属(Parabacteroides)、丹毒杆菌属(Erysipelatoclostridium)、普拉梭菌属(Faecalibacterium)、肠球菌属(Enterococcus)、葡萄球菌属(Staphylococcus)及乳酸菌属(Lactobacillus)等为主要菌群,且在不同组中的相对丰度差异明显。
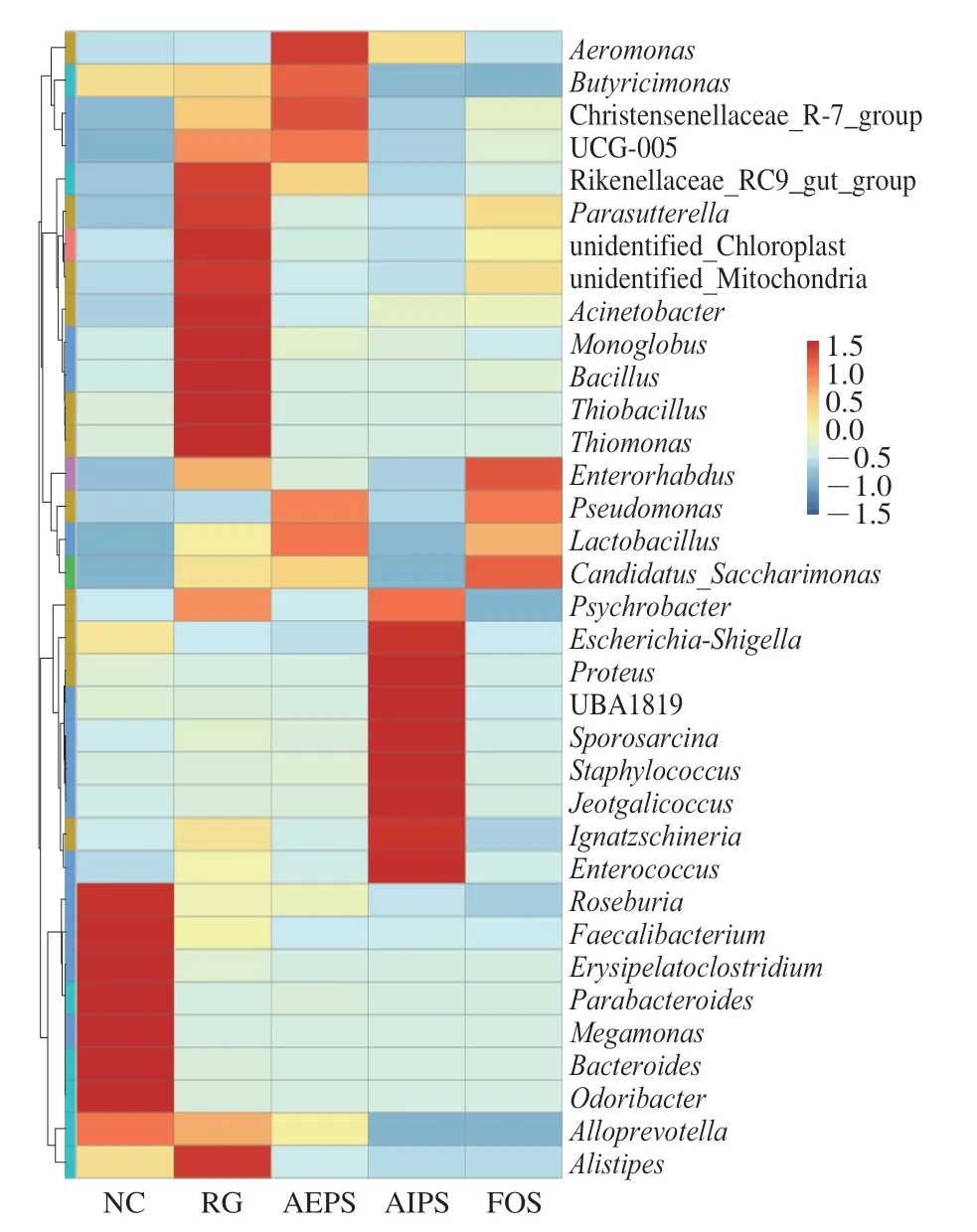
图9 各组小鼠肠道菌群在属水平的相对丰度Fig.9 Relative abundance of intestinal flora at the genus level in mice from different groups
此外,从图9中可以看出,与NC、AEPS、AIPS及FOS组相比,RG组小鼠肠道中Parasutterella、Thiomonas、Thiobacillus、Bacillus等菌属的相对丰度明显增加。与AEPS及FOS组相比,AIPS组小鼠肠道菌群中Enterococcus及Staphylococcus的相对丰度明显增加,而Enterococcus和Staphylococcus的相对丰度与炎症程度呈正相关[25]。此外,在AEPS和FOS组中,Lactobacillus的相对丰度较RG及AIPS组明显增高,而Lactobacillus对肠道疾病有治疗作用,能减轻高浓度抗生素引起的腹泻症状[26]。
3 讨论
多数真菌多糖具有与益生元相似的功能,能通过刺激特定肠道菌群的生长或活性而使宿主受益。这是因为大多数真菌多糖属于β-葡聚糖类,对胃及肠道中的消化酶具有较强的抵抗性,通常是不可被消化的[27]。Nowak等[28]提取了53 种真菌子实体多糖,同时测定了这些多糖对嗜酸乳杆菌(Lactobacillus acidophilus)和两株鼠李糖乳杆菌(Lactobacillus rhamnosus)生长的影响,并通过人工胃液对真菌多糖的体外抗消化能力进行了研究。结果发现,真菌多糖比菊粉或FOS等益生元对乳酸杆菌生长的促进效果更为明显;检测这些多糖的体外消化率得知,真菌多糖经人工胃液处理后,90%以上未被消化,表明这些真菌多糖具有良好的抗胃液消化能力。本研究中体外消化模拟实验结果表明,AEPS及AIPS均呈现出较强的抗消化能力。
真菌多糖相比较菊粉、低聚果糖等益生元更能促进有益菌(如双歧杆菌和乳酸杆菌等)的生长[28]。Zhang Rongjun等[29]研究发现,金针菇多糖可通过调节肠道菌群导致的Toll样受体4(Toll-like receptor 4,TLR4)/核因子(nuclear factor,NF)-κB炎症信号通路下调,最终改善了葡聚糖硫酸钠(dextran sulfate sodium,DSS)引发的结肠炎症状;Ren Yilin等[30]研究发现,猴头菇多糖可下调氧化应激和炎症因子标志物,并逆转DSS诱导的炎症C57BL/6小鼠肠道菌群紊乱,维持肠道屏障的稳定性。而樟芝作为一种新兴的珍贵药食两用真菌,其多糖具有抗氧化、抗炎症、抗病毒及调节免疫等多种生物活性,在益生元方面亦具有较大的研究价值及开发潜力[31]。
本研究结果表明,AEPS和FOS的摄入会显著增加小鼠肠道中Lactobacillus相对丰度(P<0.05),且AEPS组中志贺氏菌属(Shigella)相对丰度明显低于AIPS组(图7C)。益生菌乳酸菌属(Lactobacillus)是人类胃肠道中最丰富的微生物之一,与良好的肠道健康有关。研究表明,益生菌能够治疗和预防多种肠道疾病,包括Clostridium-difficile诱导的结肠炎[32],Kanwal等[33]通过灌胃菱形藻多糖提升了炎症小鼠肠道中Lactobacillus的相对丰度,同时降低了Proteobacteria、Gammaproteobacteria和Bacteroides的相对丰度,从而改善了DSS诱导的炎症反应。Hempel等[34]研究证明了Lactobacillus和Bifidobacterium能够治疗抗生素引起腹泻的症状。Friedman[26]认为,益生菌Lactobacillus可以通过分泌黏蛋白增加上皮细胞紧密连接,提供定植抗性,产生细菌素,促进免疫球蛋白A的分泌,产生平衡T辅助细胞反应,增加IL-10的含量,从而增强肠道黏膜屏障功能,有助于抗生素损伤后正常肠道平衡的恢复。Shigella能够侵入人类肠黏膜,从而导致细菌性痢疾(一种急性直肠结肠炎)[35]。
在AIPS组中,Staphylococcus的相对丰度明显高于AEPS、FOS及RG组。而Staphylococcus是医院感染和术后感染中常见的微生物,它被认为是引发抗生素相关性腹泻最常见的原因之一[25]。Bendali等[36]发现,健康兔子灌胃Staphylococcus诱发持续性腹泻发症状后,灌胃Lactobacillus paracasei可使腹泻停止并使肠道绒毛恢复,且能够明显降低Staphylococcus在粪便中的相对丰度。Liu Guanwen等[23]发现,Lactobacillus rhamnosus在体外和体内均能有效抑制具有多重耐药性的Staphylococcus,具体表现为有效降低Staphylococcus的相对丰度,抑制炎症因子肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)-6的表达,恢复血液中白细胞和中性粒细胞的水平,有效修复因Staphylococcus感染而受损的肠道屏障和恢复免疫器官的结构损伤。从图7C可以看出,AEPS组中Lactobacillus的相对丰度明显高于RG组(P<0.05),说明AEPS可明显降低Staphylococcus的相对丰度,从而缓解腹泻症状及肠道损伤。
从图9可以看出,Parasutterella在RG组中的相对丰度最高。Parasutterella是来自变形杆菌门的一种革兰氏阴性、严格厌氧的球菌属。有报道称,肠道内Parasutterella相对丰度的增加会导致胃肠道生态失调及肠道菌群多样性的降低,进而引发肠道疾病或代谢疾病,如炎症性肠病和肥胖[37]。同时,在AIPS组中,Enterococcus的相对丰度较高,而Onderdonk等[38]发现,大鼠结肠炎与Enterococcus丰度之间存在正相关性。
4 结论
AEPS及AIPS经过8 次Sevag法脱蛋白处理后,蛋白质量分数均低于1.5%,总中性糖质量分数分别约为83%及89%,纯度较高;采用HPLC法分析樟芝多糖(AEPS及AIPS)的单糖组成,结果表明AEPS主要由半乳糖、葡萄糖、甘露糖、葡萄糖醛酸、半乳糖醛酸组成,相对含量分别为7.84%、84.73%、5.27%、0.76%及1.40%;而AIPS主要由半乳糖、葡萄糖、甘露糖、氨基半乳糖组成,相对含量分别为28.52%、55.31%、14.34%及1.83%;采用HPGFC法分析樟芝多糖的分子质量分布,发现AEPS的平均分子质量为4.16×105Da,AIPS的平均分子质量为3.52×106Da,二者之间存在明显差异;分析樟芝多糖在4 000~400 cm-1范围内红外光谱发现,AEPS具有吡喃糖环,且存在β-型糖苷键;而AIPS具有酰胺结构,且存在(—C≡C—H)、C—O官能团;体外模拟消化实验结果表明,AEPS及AIPS均具有较强的抗消化能,表明口服樟芝多糖后,其可顺利进入肠道并发挥作用;小鼠体内实验结果表明,灌胃AEPS可大幅增加小鼠肠道菌群中的部分有益微生物(如Lactobacillus)的相对丰度,同时明显降低小鼠肠道菌群中部分有害微生物(如Enterococcus、Staphylococcus、Parasutterella及Shigella)的相对丰度。其中,AEPS对小鼠肠道菌群的调节效果明显优于AIPS。
