药用植物核心种质研究进展
2023-08-11赵慧马芹刘振华蒲高斌张芳李佳张永清
赵慧,马芹,刘振华,蒲高斌,张芳,李佳,张永清
(山东中医药大学药学院,山东 济南 250300)
种质资源是重要的战略资源,是衡量综合国力的指标之一。 我国植物种质资源极为丰富,这不仅是选育优良品种的物质基础,也是生物多样性不可或缺的组成部分,对生态文明建设和经济可持续发展具有重要支撑作用。 保存利用好植物种质资源意义重大,但因其数量巨大,对每份植物种质资源都开展保存、评价和利用工作比较困难[1]。 基于植物种质资源调查及遗传多样性研究[2,3],通过建立核心种质资源库来保存和管理种质资源,已经成为该领域研究的热点[4,5]。 由于核心种质以最少数量种质最大限度地代表了整个种质资源的遗传多样性[6],因此它很好地解决了上述难题。 目前开展核心种质研究的植物多是粮食作物和经济作物,如水稻[7]、玉米[8]、茄子[9]、番茄[10]、陆地棉[11]等。 而关于药用植物核心种质的研究则相对滞后[12,13],但随着通过生产种植才能满足需要的药材种类越来越多,加强其核心种质研究、做好种质保存工作、推进优良品种选育,成为药材生产中保证质量、提高产量需要解决的关键技术问题[14]。 因此,本文对已有药用植物核心种质及其构建研究进行系统归纳总结,旨在为深化药用植物核心种质研究、推进中药资源高质量可持续利用提供参考。
1 核心种质概述
1984 年Frankle[6]首次提出核心种质概念,后来Brown[15]对其进一步完善,认为核心种质是以最少数量的种质最大程度地保存整个种质资源丰富的遗传变异。 该概念是相对的,种质数量和遗传变异都是相对于所收集到的种质而言;同时它也是动态变化的,可以通过后续补充收集新的种质,可对已有的核心种质进行调整。 1999 年,李自超等[16]提出了核心种质动态四级结构,即保留种质、初级核心种质、核心种质和核心应用种质。其中,保留种质是指筛选出核心种质后剩余的所有种质资源,为核心种质的补充;初级核心种质包含原始种质95%以上的遗传多样性,是核心种质的基础;核心种质包含70%~80%的遗传多样性,占原始种质数量的5%~10%;核心应用种质包含种质数量更少,是应用所需的优异种质,对生产和研究利用更具价值和指导意义。 2008 年,王建成等[17]又提出了合成核心种质、分级核心种质、微型核心种质新概念。 其中,合成核心种质是指由不同国家或地区通过合作共同构建而成的核心种质;分级核心种质是根据不同数据分层来依次构建的核心种质;微型核心种质是为适应很大数量规模的种群而构建的核心种质库,约占原始种质数量的1%。 药用植物核心种质组成相对其它植物具有一定特殊性,不仅要包含主要变异类型、避免遗传重复,还要包括药效成分及其调控基因[18]。 药用植物核心种质代表着该物种的性状特征、地理分布和遗传多样性,具有代表性、异质性、动态性和有效性[1]。
2 药用植物核心种质构建
我国药用植物种质资源数量庞大[19],保护、管理工作投入大。 核心种质去除了一定的遗传冗余,更加关注与质量、产量及农艺性状相关的遗传变异,依此进行优良品种筛选将有助于提高选育效率[20]。 因此,核心种质构建是有效保护利用药用植物种质资源的关键。 构建核心种质的基本步骤有数据收集、数据分析、种质筛选、核心种质有效性检验等[21]。
2.1 数据收集
收集整理种质资源相关数据是构建核心种质的首要工作,包括基本数据、特征数据、评价鉴定数据。 基本数据包括种质采集地的生态地理特征、繁殖与培育、分类体系等数据;特征数据包括表型、分子标记、生理生化等数据;评价鉴定数据是指质量、产量及抗性等数据[16]。 其中,以表型、分子标记数据最为常用。 表型数据是构建核心种质的传统数据,分为数量性状和质量性状,能直观地反映物种的遗传多样性[22],可为核心种质构建提供直接依据[23]。 例如,李秀诗[24]、彭锐[25]等根据数量性状和质量性状构建的薏苡(Coix lacryma-jobiL.)与青蒿(Artemisia annuaLinn.)的核心种质。
由于植物形态特征易受环境影响,不能直接反映种质遗传多样性,而分子标记数据不受季节和环境等因素影响[26],能在DNA 序列水平上直接反映物种遗传变异信息和种群间的遗传关系,因此备受重视[27,28]。 目前常用的分子标记有限制性片段长度多态性(RFLP)、随机扩增多态性DNA(RAPD)、扩增片段长度多态性(AFLP)、简单重复序列(SSR、ISSR)、相关序列扩增多态性(SRAP)、单核苷酸多态性(SNP)等[29]。 在构建药用植物核心种质过程中应用较多的分子标记为SSR 和ISSR,其次是SRAP。 例如Liu[30]、耿雅萍[31]、Sa[32]、林丹[33]等利用SSR 分子标记构建了降香(Dalbergia odoriferaT.Chen)、黄芪[蒙古黄芪(Astragalus mongholicusBunge)和膜荚黄芪(Astragalus membranaceus(Fisch.) Bunge)]、紫苏(Perilla frutescensL.)等核心种质,林丹[33]、白成科[34,35]、杨孟莉[36]、Li[37]、刘向宇[38]等利用ISSR分子标记构建了白木香[Aquilaria sinensis(Lour.)Spreng.]、黄芩(Scutellaria baicalensisGeorgi)、山茱萸(Cornus officinalisSieb.et Zucc.)、山药(Dioscorea oppositaThunb.)等核心种质。
整合利用表型与分子标记数据,将宏观性状与微观分子结合构建的核心种质将更具有代表性。 例如,程江波[39]根据表型性状和SRAP 分子标记数据构建了海巴戟(Morinda citrifoliaLinn.)的核心种质。 另外,药用植物与一般植物不同,在构建核心种质时,除应考虑种质表型性状和分子标记数据外,还应考虑活性成分含量。 例如,廖丹[40]根据生物学性状(包括多糖、维生素、总黄酮和香豆素含量)及ISSR 分子标记构建了海巴戟核心种质;刘曼[41]依据蛇床子素、二氢欧山芹醇、当归酸酯含量及SSR 分子标记构建了独活(Angelica pubescensMaxim.f.biserrataShan et Yuan)核心种质。 又如,李嘉惠[42]在构建何首乌[Fallopia multiflora(Thunb.) Harald.]核心种质、刘秀容[43]在构建黄芩核心种质时均将活性成分含量纳入分析数据中。
2.2 数据分析
收集种质并获得一定信息数据后,需通过数据分析才能明确种质遗传多样性及其亲缘关系,据此将所有种质分组,并选取代表性样品构建核心种质[16,44]。 数据分析常用方法为主成分分析和聚类分析。 主成分分析多用于大量表型性状数据,目的是筛选出与变异相关的主要性状。 孙亚强[45]采用主成分分析法对酸枣52 个数量性状进行分析后,得到5 个主成分因子,包含果实色光值、单核重、果核横径、叶片长、叶片宽等25 个性状。 聚类分析是目前使用最广泛的分析方法[46],可用于分析各种类型数据,包括最长距离法(COMPIETE)、最短距离法(SINGLE)、中间距离法(MEDIAN)、类平均法(AVERAGE)、重心法(CENTROID)、非加权配对平均法(UPGMA)和离差平方和法(WARD)等[47]。 构建核心种质时以UPGMA 法应用最多,绝大多数药用植物核心种质都是依据UPGMA 法进行聚类分组,包括白木香[33]、山茱萸[37]、黄芩[34]、山药[38]、独活[48]、青蒿[25]、降香[30]、紫苏[32]、大枣(Ziziphus jujubaMill.var.jujuba)[49]、三叶木通[Akebia trifoliata(Thunb.) Koidz.][50]等。 也有学者采用类平均法进行聚类分析,如海巴戟[39]、酸枣[Ziziphus jujubaMill.var.spinosa(Bunge) Hu ex H.F.Chow][45]等核心种质。 系统发育树邻接法(NJ)和群体结构法(STRUCTURE)也被用于种质分组[31,51],但使用较少。
聚类分析常用的遗传距离为欧式距离和马氏距离。 欧式距离易受性状间不同量纲影响,马氏距离与性状间测量单位无关、不受量纲影响[47]。基于表型数据构建核心种质时,可通过数量性状标准化来解决不同量纲影响问题[52]。 除上述两种遗传距离外,还有SM 系数、Jaccard 系数、Nei’s遗传距离等,它们都能代表原始种质的遗传多样性,但以Jaccard 系数得出的各项参数值最大,为最佳遗传距离[35,40]。
2.3 取样方法和取样比例
取样方法、比例对种质筛选效果都有影响。良好的取样方法不仅能去除原种质遗传冗余,而且能最大限度地保留其遗传多样性[53],因此选择最优的取样方法是构建核心种质的重中之重。 取样方法包括随机取样法和系统取样法。 其中,系统取样法又包括比例取样法(P 策略)、平方根比例法(S 策略)、对数取样法(L 策略)、遗传多样性比例法(G 策略)、等位基因最大化法(M 策略)等;随机取样法虽然可得到无偏样本,但得到的核心种质遗传结构和多样性与原始种质往往相差较大[54],因此很少单独应用,多结合聚类分析采用逐步聚类随机取样法(SCR)。
系统取样法要根据方法和材料的特点来选择[55]。 组内取样方法有优先取样、偏离度取样、最小距离逐步取样(LDSS)等。 构建药用植物核心种质应用最多的首先是最小距离逐步取样[56],该法通过逐步聚类删除遗传距离接近的冗余样品,得到的核心种质能很好地保留原始种质的遗传变异[57],且不受聚类方法的影响[58];其次是等位基因最大化法(M 策略),该法依据物种多样性自动生成抽样比例,广泛应用的是进阶等位基因最大化法,包括拉斯维加斯式随机算法、启发式算法和模拟退火算法,各算法在构建药用植物核心种质时均有应用[31,50];优先取样也较常用,是通过逐步聚类优先选择性状极值[59]或稀有等位基因(位点优先取样)而组成核心种质,也能很好保留原始群体的遗传多样性。 李嘉惠[42]提出的STRUCTURE 分类-比例取样法,是根据组间遗传多样性的比值确定取样数量,从而避免了取样不均,得到的核心种质同样具有良好代表性,与最小距离逐步聚类法相比操作简便。 当然,取样方法间没有绝对的优劣之分,在构建核心种质时应考虑药用植物遗传特征等实际情况,对各种取样方法进行评估以找到最适方法,保证构建出最佳核心种质。
关于取样比例,Brown[15]提出5%~10%的取样比例可代表总样品70%以上的遗传变异,Yonezawa 等[60]则认为最佳取样比例为20%~30%,也有学者提出取样比例应随原始种质数量的增加而减小[61]。 药用植物核心种质的取样比例绝大部分在10%~30%之间。 构建核心种质时,往往根据总体种质资源规模大小和遗传多样性、遗传结构来调整取样比例[62]。 刘曼[41]在构建独活核心种质时,因种质数量多且遗传多样性水平高而选择10%~40%的取样比例,目的是为保存更完整的遗传变异。 此外,优异特殊种质、性状极值种质数量少且利于生产和选出性状突出的品种,应直接选入核心种质。
2.4 核心种质检验及评价
核心种质构建完成后要进行有效性检验,明确它们对原始种质遗传变异的代表性及在生产实践中的实用性。 对基于表型数据构建的核心种质,要以核心种质和原始种质各性状均值和方差作为评价参数进行t检验或F检验,看是否具有显著性差异,再通过比较均值、变异系数、方差差异百分率、极差符合率对核心种质进行评价。 Diwan 等[63]指出,核心种质均值和方差与原始种质存在显著差异的性状不大于30%,且变异幅度不低于原始群体的70%,就可认为该核心种质对原始种质遗传变异具有良好代表性。 对基于分子标记数据构建的核心种质,要以等位基因数量(Na)、有效等位基因数量(Ne)、观察杂合度(Ho)、Shannon and Weaver’s 信息指数(I)、Nei’s遗传多样性指数(H)、多态性信息含量(PIC)作为评价参数,利用t检验确定其差异显著性,同时计算各参数保留率来评价核心种质有效性。 耿雅萍[31]在检验评价黄芪核心种质时,得到其观测杂合度的保留率为97.425%,其余各评价参数保留率均大于100%,表明该核心种质有效保留了原始种质的遗传多样性,且由于种质数量减少而使核心种质整体遗传变异升高。 良好的核心种质还应去除一定的遗传冗余:李荣荣[64]利用主成分分析比较核心种质与原始种质各株系相互重叠的分布程度,发现核心种质遗传冗余明显降低,从而验证了初级核心种质的有效性;此外,还利用主坐标分析对比核心种质与原始种质的遗传结构几何分布,验证了核心种质的代表性和全面性。 目前,实用性检验只出现在农作物核心种质构建中,药用植物尚未见报道,该评价指标有待于发展和补充。
3 药用植物核心种质构建进展
李秀诗等[24]根据株高、茎粗、叶长、叶宽、总分蘖数、主茎分枝数、主茎节数、粒长、粒宽、百粒重共10 个数量性状和果壳颜色、总苞形状、总苞光泽、总苞条纹这4 个质量性状,从248 份薏苡种质中构建了67 份初级核心种质。 彭锐等[25]收集到63 份青蒿种质,并根据株高、冠幅、分枝数、地上部鲜重、叶鲜重、叶鲜重占地上部鲜重比率、节间距和青蒿素含量共8 个数量性状,构建了20 份核心种质。
Liu 等[30]利用SSR 分子标记,从42 份野生降香、210 份栽培降香种质中,构建了31 份核心种质。 耿雅萍[31]采用SSR 分子标记,从380 份蒙古黄芪和膜荚黄芪种质中,构建了136 份核心种质。Sa 等[32]利用22 个SSR 分子标记,从韩国400 份紫苏种质中检测到173 个等位基因,每个位点的等位基因数为4 ~15(平均值=7.9),共筛选出44份核心种质,占整个紫苏种质的11.0%。 林丹等[33]利用ISSR 分子标记,对232 份白木香种质进行核心种质初建,最终获得82 份核心种质,保留原始种质97%以上的遗传多样性。 白成科等[34]以4 个主产区的40 份黄芩种质为研究对象,采用改良的CTAB 法提取基因组,利用筛选出的15 条ISSR 引物进行分子标记,共获得248 条清晰条带,其中多态性条带241 条,多态性百分率97.17%,表明收集的黄芩种质资源在分子水平上有较高的遗传多样性,构建的12 份核心种质既能代表原有群体的遗传变异,又有广泛的地域代表性。 杨孟莉[36]以11 个省(市)129 份山茱萸种质为研究对象,利用ISSR 分子标记研究其遗传多样性,筛选出多态性好、条带清晰的引物11 条,共扩增到87 条条带,多态性条带总数为87 条,多态性比例达100%,构建的34 份核心种质能够代表原种质的遗传多样性。 白成科等[35]利用ISSR 分子标记,从48 份山茱萸种质中构建了15 份核心种质,后来Li[37]进行更新并构建了18 份核心种质。刘向宇等[38]利用ISSR 分子标记,对35 份山药种质进行遗传多样性分析,筛选出12 条有效引物,共扩增出142 个位点,多态性比率为97.18%,构建了11 份核心种质,多态位点率达到97.8%。 目前已构建的药用植物核心种质情况如表1 所示。
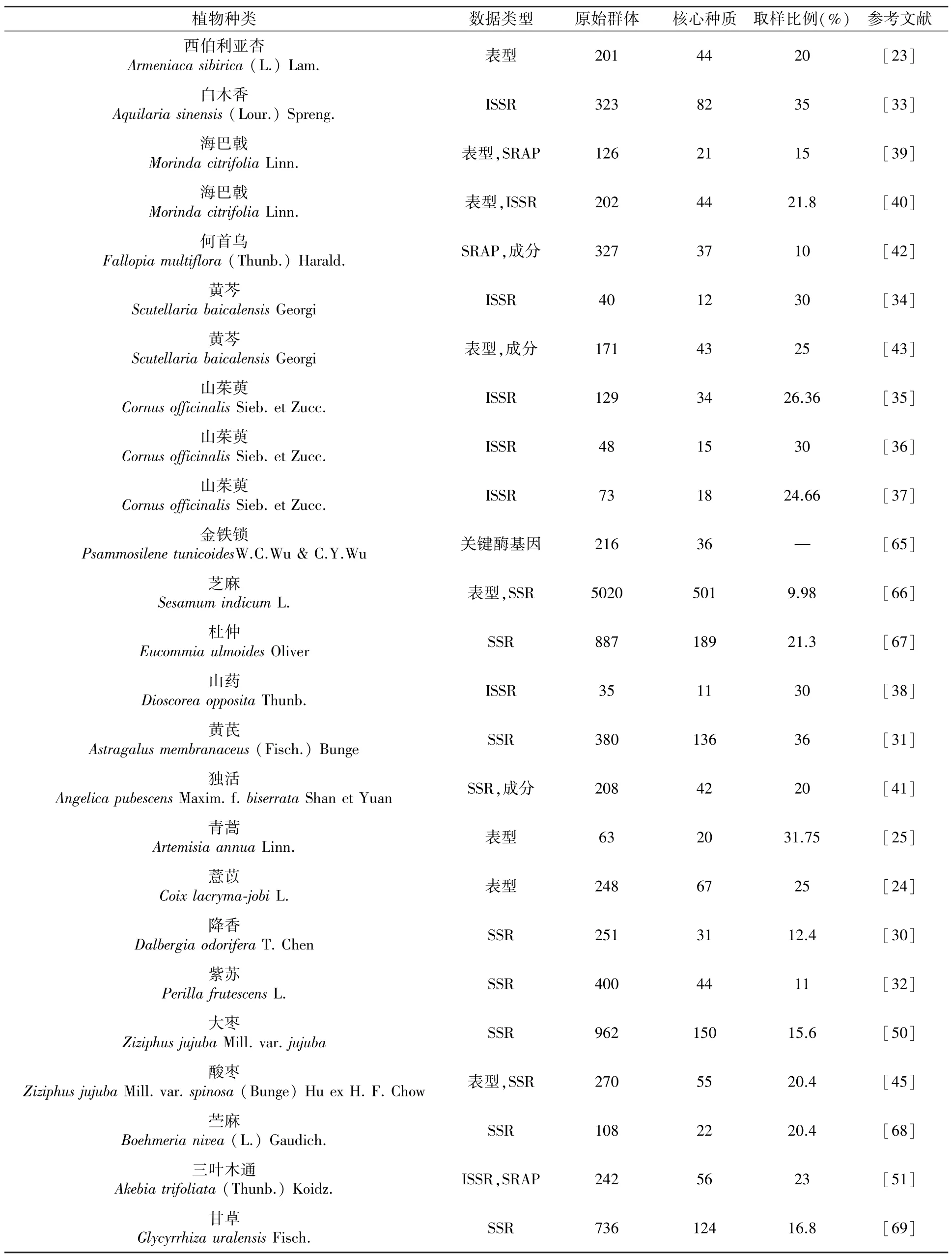
表1 药用植物核心种质构建情况
4 小结
我国药用植物资源丰富,据统计有383 科2 309属11 146 个种及种下类群[70],但已构建核心种质的药用植物仅是其中极少一部分。 随着市场需求变化,通过生产种植才能满足需要的药用植物种类越来越多,栽培面积越来越大。 一些道地药材由于长期种植,其种质发生明显分化,形成数量众多的种质,成为其道地性的重要体现,对这些种质进行收集、整理、保存对于保证药材质量意义重大。 由于核心种质最大限度地保留了遗传多样性,从中选育优良品种可以大幅度提高选育效率,是提高药材产量与质量的有效途径,但目前药用植物核心种质构建研究尚处于起步阶段,已构建核心种质的药用植物还很少,需要加大研究力度,尽快构建一批道地药材核心种质,将优质药材基因保存下来。
构建药用植物核心种质的最终目的还是为了更好地挖掘利用,为发展中医药产业服务。 质量是药材的生命,药用植物核心种质要体现出药材优质性,这与一般植物不同。 因此,构建药用植物核心种质应注意吸收先进科学技术,将与药材质量有关的基因挖掘出来加以利用。 基因测序技术在挖掘药用植物抗逆性、药材产量质量相关优异基因等方面发挥着重要作用,例如构建陆地棉核心种质时,重测序技术就被用于影响纤维质量和产量基因的挖掘[71]。 总之,核心种质构建可为优良品种选育提供优质材料,是中医药产业可持续高质量发展的物质基础,必须予以足够重视。
