基于GC-MS/MS的40种农药检测方法优化及蔬菜基质筛选的研究
2023-08-10杨雨馨明俊吕珍珍冯吉
杨雨馨,明俊,吕珍珍,冯吉
(1.德阳市食品药品安全检验检测中心,四川 德阳 618000;2.德阳市食品检验重点实验室,四川 德阳 618000)
随着现代农业的发展,蔬菜农药残留问题日益突出,蔬菜中农药残留的准确分析有助于提高蔬菜的产品质量。但生产过程中使用的农药类别多,化学结构和性质各异,待测组分复杂,农药残留量检测又属痕量分析等,需要高精确度和灵敏性的检测手段[1-2]。GC-MS/MS技术结合了气相色谱的高分离性能与质谱的高选择性能,能够快速准确进行定性定量[3]。然而,在实际检测中发现,基质效应对农残测定结果影响很大。基质效应,是指样品中其他成分对待测物的影响,通常有基质增强效应和基质减弱效应[4-5]。已知可能影响基质效应的因素涉及几个方面内容:(1)基质的浓度、种类和性状;(2)分析物的化学结构、性质和浓度;(3)进样技术、进样口的结构、活性位点的数量;(4)衬管、柱子的污染状况;(5)检测器、载气的流速、压力、分析时间、分析温度等[6-8]。
在日常工作中解决基质效应问题最常用的、最方便的方法是配制基质标准曲线来校正基质效应[9]。
QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe),是近年来国际上最新发展起来的一种用于农产品检测的快速样品前处理技术,利用吸附剂填料与基质中的杂质相互作用,吸附杂质从而达到除杂净化的目的。QuEChERS 方法的步骤可以简单归纳为:样品粉碎;单一溶剂乙腈提取分离;加入MgSO4等盐类除水;加入乙二胺-N-丙基硅烷(PSA)等吸附剂除杂;上清液进行GC-MS、LC-MS 检测。
因此,本文首先使用QuEChERS结合GC-MS/MS技术,分别对气相色谱和质谱条件进行优化,建立起蔬菜中40种农药残留GC-MS/MS多重反应监测(multiple reaction monitoring,MRM)分析方法。在优化好的GC-MS/MS条件下,对质量浓度为0.02,0.50 μg/mL的待测物在10种基质与空白溶剂中响应结果进行比对,确定基质效应的影响情况,找到一类代表性基质,解决基质效应给日常农残检测工作带来的困扰。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
气相色谱-三重四级质谱联用仪:Agilent 7890B+7000D (Agilent,美国);MS205DU型电子天平(Mettler-Toledo,美国);MTN-5800A型氮吹浓缩装置(天津奥特赛恩斯仪器;中国);VG3 S025型涡旋振荡器(IKA,德国 );TGL-16A型台式高速冷冻离心机(长沙平凡仪器仪表;中国)。
1.1.2 试剂
1.1.2.1 试剂与耗材
乙腈,乙酸乙酯(色谱纯),购买于德国Merck公司;QuEChERS净化管,购买于山东青云化学科技有限公司。
1.1.2.2 标准物质
灭线磷、马拉硫磷、倍硫磷、高效氟氯氰菊酯、氯氟氰菊酯、三唑磷、杀扑磷、腈菌唑、甲基异柳磷、腐霉利、乙酰甲胺磷、联苯菊酯、氯氰菊酯、高效氯氰菊酯、甲拌磷、水胺硫磷、氧乐果、毒死蜱、哒螨灵、溴氰菊酯、敌敌畏、异菌脲、对硫磷、六六六(1 000 μg/mL,坛墨质检科技);肟菌酯、甲氰菊酯、异丙威、乐果、氟氯氰菊酯、丙溴磷、氯唑磷、腈苯唑、二甲戊灵、甲胺磷、苯醚甲环唑、倍硫磷砜、倍硫磷亚砜、甲拌磷砜、甲拌磷亚砜(1 000 μg/mL,广州硕谱生物技术);高效氯氟氰菊酯(1 000 μg/mL,上海安谱实验科技)。
1.1.2.3 材料
茄子、辣椒、番茄、黄瓜、白菜、芹菜、菠菜、韭菜、豇豆、姜均为市售,采购于本地市场,经筛查为阴性。
1.2 实验方法
1.2.1 标准溶液的配制
1.2.1.1 标准混合储备液
将40种农药(1 000 μg/mL)用乙酸乙酯稀释到质量浓度10.0 μg/mL备用。
1.2.1.2 标准工作曲线
用乙酸乙酯、辣椒基质、豇豆基质、韭菜基质配制0.02~0.50 μg/mL的标准曲线。
1.2.1.3 阳性样品
将混合储备液用乙酸乙酯、茄子、辣椒、番茄、黄瓜、白菜、芹菜、菠菜、韭菜、豇豆、姜等基质配制成0.20,0.50 μg/mL的质量浓度。
1.2.2 蔬菜样品处理
按《食品安全国家标准 食品中农药最大残留限量》[10]附录A要求取样,将样品制成匀浆。提取:称取10 g试样于50 mL离心管中,加入10 mL乙腈,4 g硫酸镁,1 g氯化钠,1 g柠檬酸钠,0.5 g柠檬酸氢二钠,振荡1 min,离心。吸取6 mL上清液加到内含900 mg硫酸镁及150 mg PSA的15 mL离心管中,涡旋混匀,离心。取2 mL上清液,氮吹至近干,加1 mL乙酸乙酯复溶,加入内标,过滤,上机测定。
1.2.3 仪器条件
GC-MS/MS条件:载气为氦气(99.999%),恒定流量为1.2 mL/min,色谱柱HP-5MS(Agilent,30 m×0.25 mm,025 μm);进样口温度:300 ℃;不分流进样:进样量1 μL;流速:1 mL/min;色谱-质谱接口温度:280 ℃,离子源温度:230 ℃,EI电子能量:70 eV。
2 结果与分析
2.1 气相色谱条件
建立满足同时测定蔬菜中40种农药残留的气相色谱升温程序。具体为:初始温度为40 ℃,保持1 min;以30 ℃/min升温至130 ℃;然后以10 ℃/min升温至200 ℃;再以2 ℃/min升温至260 ℃;最后以25 ℃/min升温至300 ℃,保持6 min。
2.2 质谱离子对优化
(1)全扫描模式(SCAN)扫描范围50~550,确定各化合物扫描离子、保留时间;
(2)选择离子监测模式(MRM)扫描离子,建立40种农药残留MRM分析方法,质谱离子分段优化条件见表1;
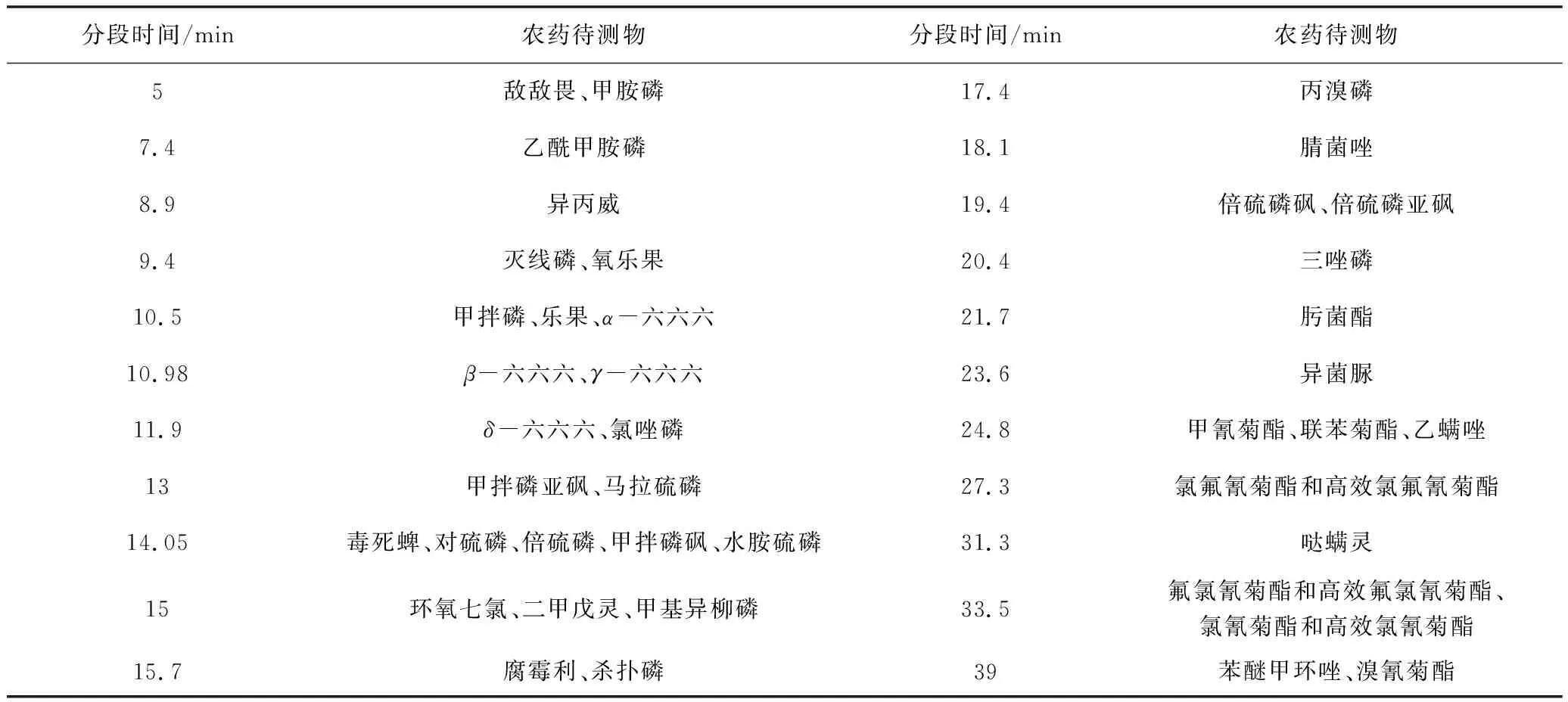
表1 质谱离子分段条件
(3)根据仪器响应,选择丰度强且稳定的碎片离子作为定性与定量离子,对GB 23200.113—2018附录B[11]中敌敌畏、氧乐果、马拉硫磷、毒死蜱、腐霉利、异菌脲等6种农药离子对信息进行优化,离子对条件优化见表2。

表2 农药的特征离子信息优化对照
2.3 溶剂与基质MRM模式测定结果
(1)图1为甲胺磷在不同基质和空白溶剂中的色谱图。实验通过对40种待测物在10种基质和空白溶剂中的测定,发现甲胺磷、乙酰甲胺磷、氧乐果、乐果、甲拌磷砜、甲拌磷亚砜、倍硫磷砜、倍硫磷亚砜、异菌脲、苯醚甲环唑等10种待测物在纯溶剂中的峰型拖尾、毛躁、偏移且响应低,而在基质中待测物峰型光滑平整、尖锐对称,峰响应高,满足实验的校正曲线相关系数大于0.995和回收率60%~120%的相关要求[12]。
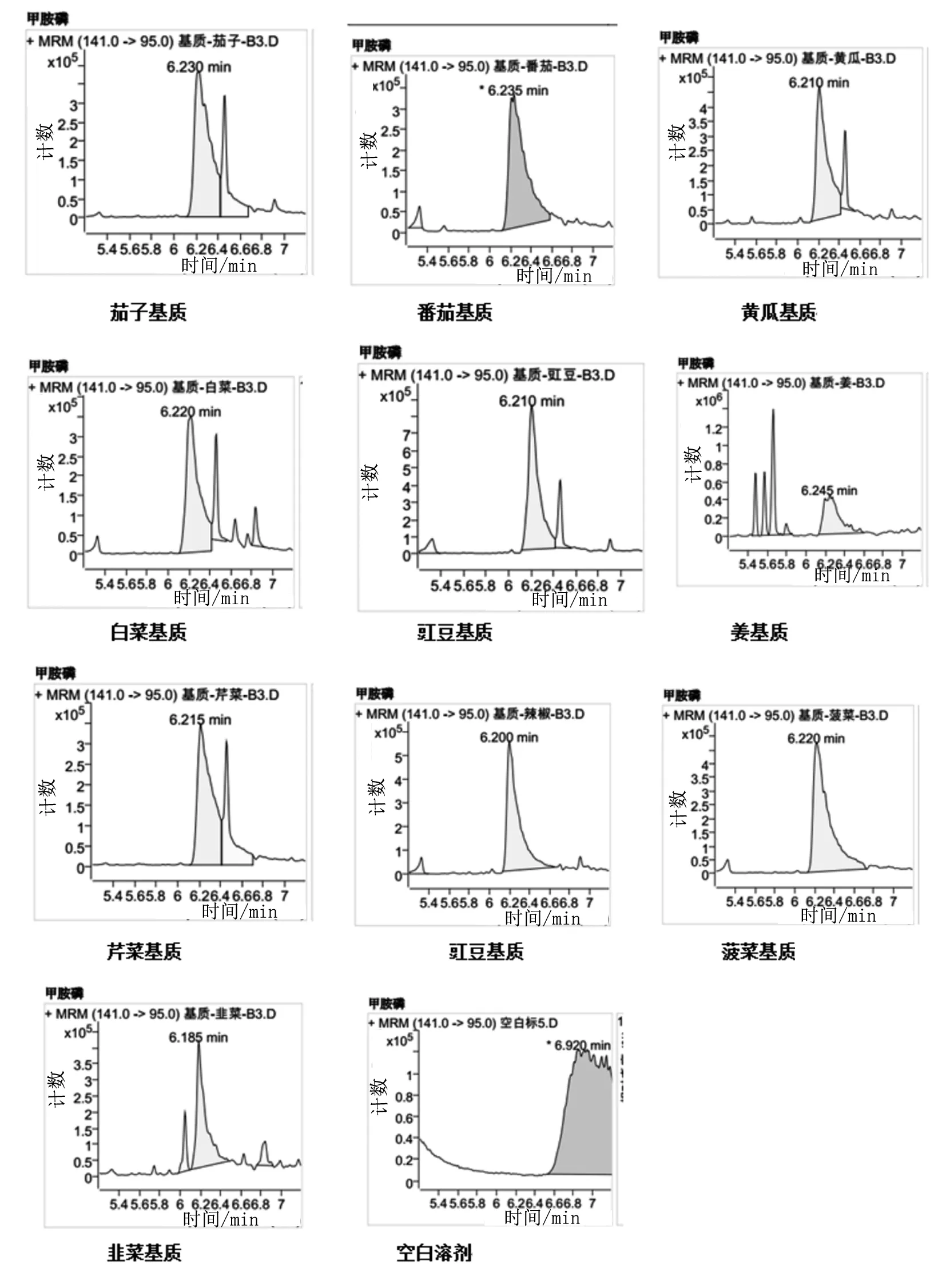
图1 甲胺磷在不同基质中MRM模式下的色谱图
(2)实验采用含有待测物0.20,0.50 μg/mL的茄子、辣椒、番茄、黄瓜、白菜、芹菜、菠菜、韭菜、豇豆、姜等10种基质,并同时测定这10种基质的农残待测物。图1可看出姜杂质峰过多,不考虑作为基质的选择;菠菜颜色过深,茄子、番茄、黄瓜、白菜、芹菜基质中待测物的响应处于中等水平,都不作为基质的首要选择。辣椒、韭菜、豇豆的响应好、峰型平整对称,可以作为基质配制标准校正曲线。
2.4 基质校正结果
选择辣椒、韭菜、豇豆作为基质,配制基质校正曲线,配制质量浓度为0.02~0.50 μg/mL,校正不同样品中待测物的含量。表3为实际样品中部分待测物(0.05 μg/mL)在豇豆基质校正曲线中的测定结果。结果显示基质校正曲线的相关系数大于0.995,同时测定的不同样品待测物回收率在70%以上。表4是含量为0.05 μg/mL乙酰甲胺磷的阳性蔬菜样品在辣椒、韭菜、豇豆3种基质校正曲线下的测定结果。蔬菜中的乙酰甲胺磷回收率在韭菜基质校正中50%~85%左右,在辣椒基质校正中80%~130%左右,在豇豆基质校正中70%~105%左右。这是由于样品中的杂质分子与待测物分子竞争进样口或柱头的金属离子、硅烷基以及不挥发性物质等所形成的活性位点,从而使待测物与活性位点的交互反应机会减少、待测物分子的损失减少,因此相同含量的待测物响应值高[13]。韭菜基质杂质分子比其他蔬菜多,待测物分子损失减少程度低,用做基质标准校正曲线时,韭菜基质中待测物含量高,使得其他蔬菜中的待测物含量定量结果偏低,可能导致假阴性结果。因此,选择豇豆作为标准曲线基准物质。
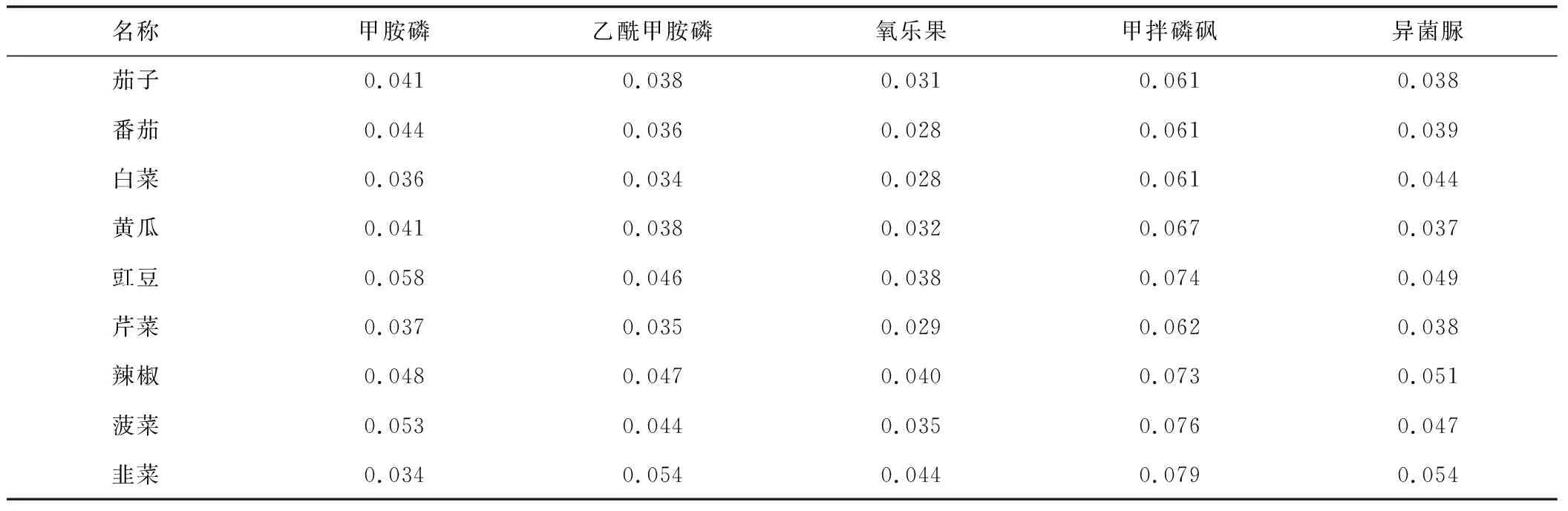
表3 0.05 μg/mL实际样品部分待测物的测定结果** 单位:μg/mL
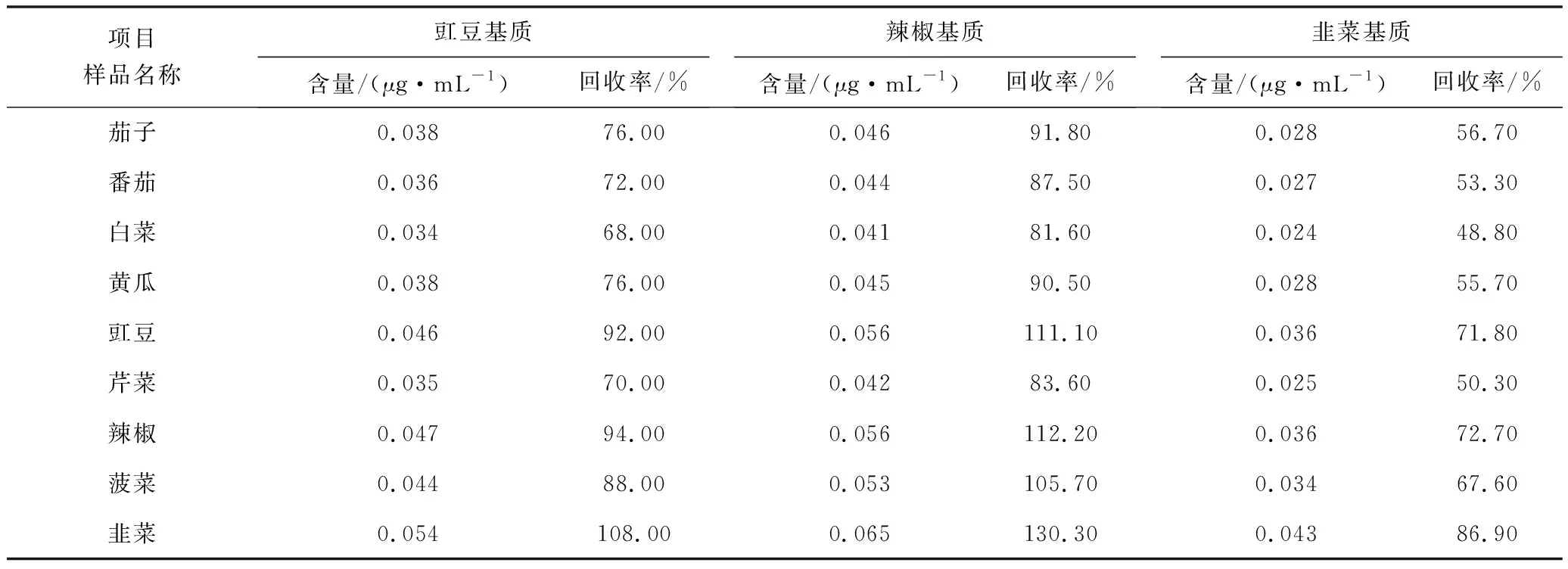
表4 含0.05 μg/mL乙酰甲胺磷阳性样品在不同基质中的测定结果
3 结论
本研究采用GC-MS/MS结合QuEChERS测定蔬菜中的农药残留,优化实验条件,基本能满足同时测定40种农残待测物。通过比对10种基质和空白溶剂中0.02,0.50 μg/mL待测物的响应结果,选择出适合作为基质的蔬菜有辣椒、韭菜和豇豆。通过配制辣椒、韭菜、豇豆不同基质校正曲线测定9种蔬菜农药残留量,发现基质影响的大小是韭菜最大,豇豆次之,辣椒最小。但是由于韭菜本身农药残留方面的问题比较突出,韭菜基质作为标准曲线校正时需要注意样品假阴性的情况。因此,在充分考虑各影响因素以后,如果在同批次测定种类繁多的农产品时,豇豆可作为标准校正曲线基质的来兼顾准确度和工作效率。
4 局限性
由于本研究时间、经费和样品来源的限制,在利用QuEChERS法处理蔬菜样品,处理过程中根据蔬菜色素含量不同QuEChERS的净化过程有所差异,用做标准曲线的基准物质通过不同的净化处理后对基质和标准物质的影响,计划在以后的研究中再进一步研究。另外有一些常见的大宗蔬菜品种本研究也没有涉及到,计划在今后的相关研究中再仔细加以考察。
