重症吉兰-巴雷综合征电生理特征以及预后不良相关因素分析
2023-08-10朱婷鸽陈芬英孙世辉薛文娟宿长军
朱婷鸽, 陈芬英, 孙世辉, 孙 超, 薛文娟, 宿长军
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是一种免疫介导的多根神经病变,由脊神经根和周围神经的急性脱髓鞘或轴索损伤引起。它的常见特征是感觉、运动和自主症状,通常伴有进行性延髓麻痹和深部肌腱反射减弱[1]。估计每年在全世界有10万例新病例,是小儿麻痹症时代之后导致四肢急性弛缓对称无力和反射性无力的最常见原因[2]。
近年来,根据临床和电生理特性对GBS进行了重新分类,病变范围从典型的急性炎性脱髓鞘多神经病变和轴索型不等;包括几种非典型临床类型的急性运动和感觉轴突神经病和急性运动轴突神经病[3]。GBS被认为是一种自身免疫性疾病,导致周围神经的抗原蛋白产生抗体,进而导致T细胞激活。巨细胞病毒、肺炎支原体和空肠弯曲杆菌等传染性病原体可刺激抗体的产生[4]。迄今为止,静脉免疫球蛋白和血浆交换是唯一公认的免疫治疗药物,可以加速GBS的恢复。然而,该综合征仍然是一种严重的疾病,即使采用标准免疫疗法治疗,约5%的人死亡,在发病1年后,高达20%的人不能独立行走[5]。基于此,本文主要分析重症GBS电生理特征以及影响预后不良相关因素,为重症患者的临床治疗和预后提供理论依据。
1 资料与方法
1.1 一般资料 选取2020年3月-2022年5月收治于我院的78例GBS患者的临床资料,根据病情严重程度分为轻症组和重症组,轻症组患者52例(男30例,女22例),年龄11~68岁,平均年龄(37.15±4.15)岁;重症组患者26例(男16例,女10例),年龄10~68岁,平均年龄(36.69±4.78)岁。另根据预后情况分为良好组和不良组,良好组患者45例(男27例,女18例),年龄10~66岁,平均年龄(36.79±3.79)岁;不良组患者33例(男19例,女14例),年龄12~68岁,平均年龄(37.36±4.96)岁。
1.2 纳入标准与排除标准 纳入标准:(1)涉及下肢和(或)上肢的急性或亚急性弛缓性无力;(2)肢体反射减退或反射消失;(3)以急性起病、快速进展、主要进行性四肢麻痹伴或不伴球麻痹;(4)被诊断为急性眼肌麻痹、腱反射减弱或消失和共济失调的三联征。排除标准:(1)急性神经病变导致慢性炎症性脱髓鞘多神经病变的患者;(2)有共病和基础疾病的患者,如自身免疫疾病、神经功能缺损或既往进行性疾病;(3)病程进行性进展> 8周,减肥手术后出现的症状。
1.3 治疗方法 根据适应证和给药可行性,给予静脉注射免疫球蛋白0.4 g/(kg·d),连续5 d。所有患者均得到适当的神经康复护理,并监测并发症的发展和病情的进展。对符合标准的患者给予呼吸机辅助呼吸,并进行适当的危重监护管理。
1.4 检测方法和诊断标准 所有患者入院时均采用丹麦公司生产的Keypoint多功能肌电图电位诱发电位仪进行相关电生理检查,通过刺激腓总神经、胫神经、正中神经和尺神经进行运动传导检测,检测指标包括潜伏时、波幅和传导速度。
GBS患者肌力的评定:采取英国医学研究会(Medical Research Council,MRC)制定的0~5级(分别对应0~5分)肌力测定法评价患者病情高峰期时肌力损伤情况:0级,肌肉完全麻痹,触诊肌肉完全无收缩力;1级,肌肉有主动收缩力,但不能带动关节活动;2级,可以带动关节水平活动,但不能对抗地心引力;3级,能对抗地心引力做主动关节活动,但不能对抗阻力;4级,能对抗较大的阻力,但比正常者弱;5级,正常肌力。MRC总分指双侧上、下肢6组肌群包括肩外展、肘屈、腕伸、髋屈、膝伸及足背屈肌力的总和,共0分(四肢完全性瘫痪)~60分(正常)。GBS患者病情等级的评定:以病情高峰期MRC总分作为GBS患者病情等级评估的标准。将GBS患者划分为3个等级:轻度型(40~60分);中度型(30~40分);重度型(≤30分)[6]。
Hughes评分标准[7]:0~6分依次为正常、症状较轻、无需帮助可步、需帮助可步行、卧床、需呼吸机辅助呼吸、死亡。根据发病高峰期的Hughes评分判定患者病情的严重程度,Hughes评分≤3分为轻症,>3分为重症;根据治疗前后(6个月后)的Hughes评分差值评定预后分组,治疗后与治疗前差值≤0,且Hughes评分<3分则为预后良好,反之记为预后不良。自主功能障碍:出现心律失常、心率和血压波动(包括体位性血压下降)、出汗异常、瞳孔异常、胃肠功能障碍和尿潴留的患者被认为有自主功能障碍。机械通气:使用呼吸机辅助呼吸的患者,临床表现为缺氧,动脉血气分析异常(PaO2<70 mmHg;PaCO2>45 mmHg)。
1.5 观察指标 收集患者入院时的临床数据,包括年龄、性别、发病年龄、发病季节、入院前病程、入院时MRC评分;不良症状发生率包括上呼吸道感染、面瘫、胸闷、腹泻、是否进行机械通气、自主神经功能障碍、胃肠道感染、肺部感染;合并疾病包括合并高血压病、合并2型糖尿病、合并慢性乙型肝炎以及合并其他自身免疫性疾病;详细的运动系统评估包括颅神经检查、动力和反射,如肌肉萎缩、颅神经受累等;电生理检测包括腓总神经传导速率、胫神经运动传导速率、F波异常率和远端复合肌肉动作电位波幅(Diaphragmatic Compound Muscle Action Potential,dCMAP)异常率;血IgG、脑脊液蛋白、脑脊液白蛋白、脑脊液IgG以及肌电图损伤类型。
1.6 随访 通过电话等线上联系方式或门诊复诊等方式对患者进行6个月的按月随访,以6个月后的MRC总和评分和Hughes评分评价临床改善情况。

2 结 果
2.1 两组病情严重程度不同患者临床资料的比较 比较病情严重程度不同的两组患者的临床资料发现,两组患者在年龄、性别、发病年龄、发病季节、胃肠道感染、肌肉萎缩、肺部感染、颅神经受累、合并高血压病、合并2型糖尿病、合并慢性乙型肝炎方面无显著性差异(P>0.05);而重症组患者面瘫、胸闷、腹泻、机械通气、自主神经功能障碍、合并其他自身免疫性疾病的发生率显著高于轻症组患者(P<0.05)(见表1)。
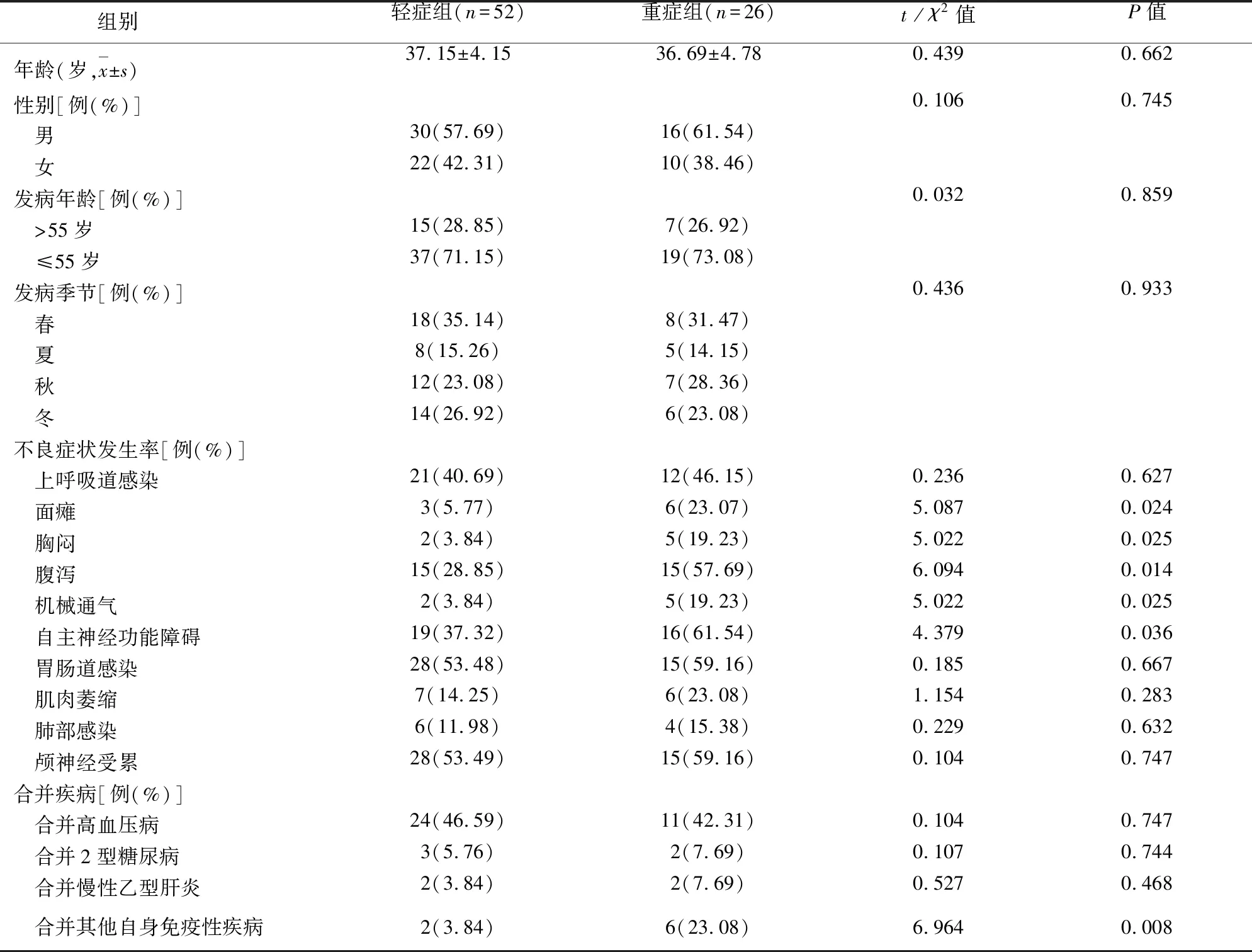
表1 病情严重程度不同患者临床资料的比较
2.2 病情严重程度不同患者电生理特征的比较 通过比较两组患者电生理特征发现,重症组的腓总神经传导速率和胫神经运动传导速率显著低于轻症组,而F波异常率和dCMAP波幅异常率则显著高于轻症组(P<0.05)(见表2)。

表2 病情严重程度不同患者电生理特征的比较
2.3 影响预后不良的相关因素分析 通过分析预后不同的两组患者各项指标发现,预后不良组患者入院前病程>2周、脑脊液蛋白升高、入院时MRC评分≤30、机械通气、合并其他自身免疫性疾病、腓总神经传导速率减慢、胫神经运动传导速率减慢、F波异常率、dCMAP 波幅异常率以及轴索型损伤的比例均显著高于预后良好组(P<0.05);而在血IgG升高、脑脊液白蛋白升高、脑脊液IgG升高、前驱症状发生率、合并高血压病、合并2型糖尿病、合并慢性乙型肝炎、脱髓鞘型方面则无明显差异(P>0.05)(见表3)。

表3 影响预后不良的相关因素分析
2.4 影响预后不良的多因素分析 将表3中差异显著的指标进行多因素Logistic回归分析,结果如图1所示。

图1 影响预后不良的危险因素森林图
入院前病程>2周、脑脊液蛋白升高、入院时MRC评分≤30、机械通气、合并其他自身免疫性疾病、腓总神经传导速率减慢、胫神经运动传导速率减慢、F波异常率增加、dCMAP 波幅异常率增加以及轴索型损伤均为影响预后不良的危险因素(OR值均大于1,P<0.05)。
2.5 ROC曲线分析神经电生理特征对GBS患者预后的预测价值 采用ROC曲线获得腓总神经传导速率、胫神经运动传导速率、F波异常率、dCMAP波幅异常率及四者联合预测GBS患者预后不良的效能,结果如表4所示,腓总神经传导速率、胫神经运动传导速率、F波异常率、dCMAP波幅异常率及四者联合后预测ROC曲线下面积,分别为0.816(95%CI0.720~0.899,P<0.001)、0.735(95%CI0.699~0.832,P<0.001)、0.724(95%CI0.687~0.803,P<0.001)、0.834(95%CI0.719~0.867,P<0.001)和0.859(95%CI0.787~0.913,P<0.001)(见图2),四者联合预测的ROC曲线下面积、阳/阴性预测值、灵敏度、特异度均明显高于单独预测,具有更优的预测效能。
图2 ROC曲线分析神经电生理特征对GBS患者预后的预测价值

表4 支原体抗体滴度、IFN-γ/IL-5及二者联合对MP肺炎患者的预测价值
2.6 列线图模型的构建 基于多因素分析结果构建列线图预测模型,结果如图3所示,入院前病程>2周为31分、脑脊液蛋白升高为75分、入院时MRC评分≤30为55分、机械通气为44分、合并其他自身免疫性疾病为72分、腓总神经传导速率减慢为20分、胫神经运动传导速率减慢为58分、F波异常率增加为83分、dCMAP 波幅异常率增加为98分以及轴索型损伤为95分,总分613分,对应预后不良概率为74.56%。
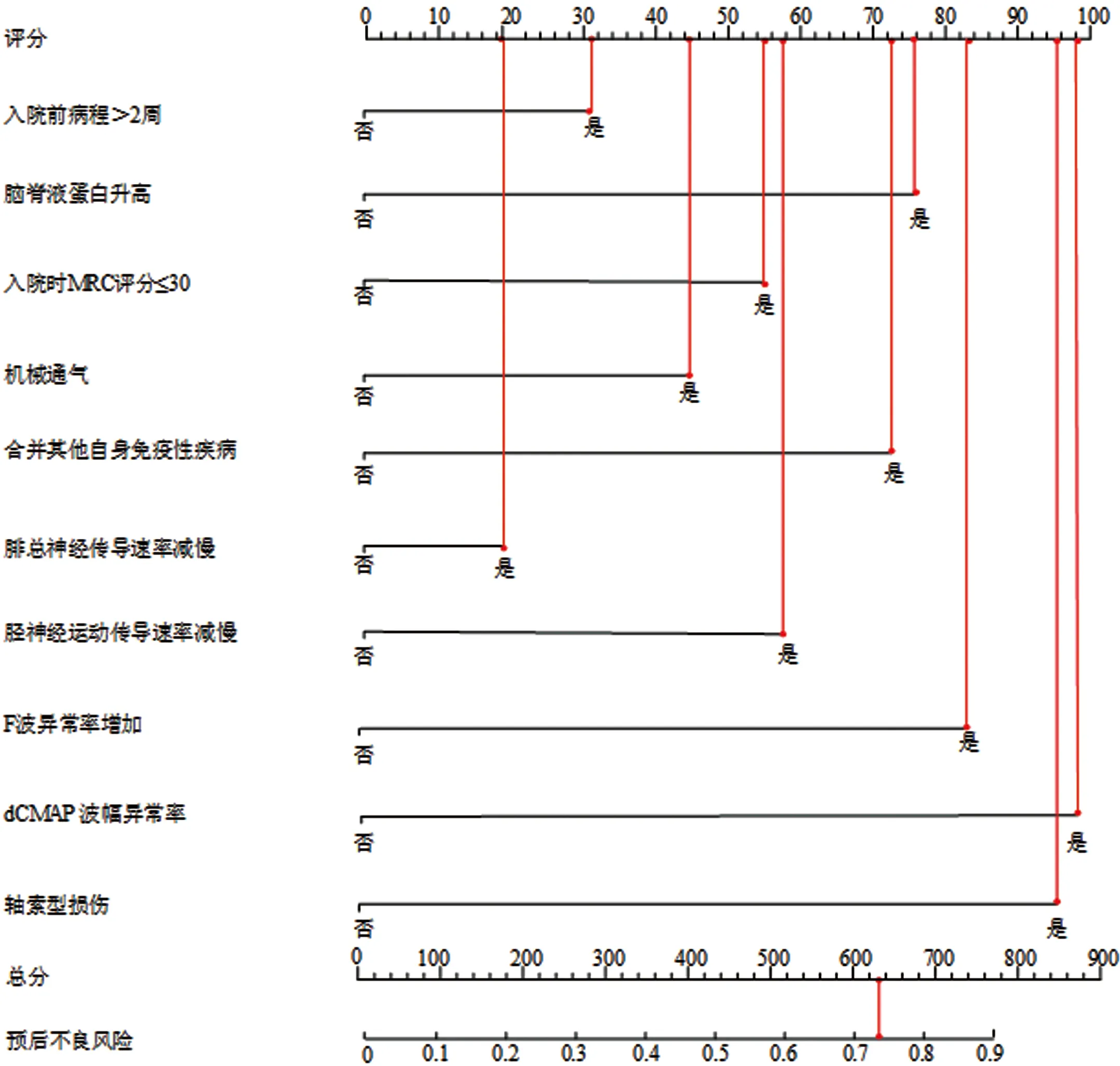
图3 列线图模型
2.7 模型验证
2.7.1 模型区分度评价 模型区分度的评价是通过ROC曲线进行的,结果如图4所示。训练集AUC为0.862(95%CI0.688~0.903,P<0.001);C-index为0.861。验证集AUC为0.871(95%CI0.655~0.893,P<0.001);C-index为0.825。在训练集和验证集中的模型区分度均较高。

图4 预测模型的ROC曲线(A:训练集;B:验证集)
2.7.2 校准度评价 Hosmer-Lemeshow拟合优度检验结果显示:在训练集中χ2=7.124,P=0.663(见图5A);在验证集中χ2=5.681,P=0.675(见图5B),无明显差异(P>0.05)。

图5 预测模型的校准度(A:训练集;B:验证集)
2.7.3 临床决策曲线 临床决策曲线结果显示,训练集中,当阈概率在13%~89%时使用列线图预测预后不良的净获益率高(见图6A),而在验证集中,阈概率在11%~84%范围内净获益高(见图6B),由此证明列线图模型安全性和实用性较强。

图6 预测模型的决策曲线分析(A:训练集;B:验证集)
3 讨 论
GBS是一种单相疾病,以急性起病、免疫介导的多神经根病变、轴索或脱髓鞘为特征,临床表现为急性起病反射性四肢麻痹伴或不伴球性麻痹,有时导致呼吸肌无力,因此需要机械通气支持[8]。与其他自身免疫或慢性炎症疾病不同,在以社区为基础的研究中,发现16岁以下儿童发病的频率为0.25~1.5/100 000人,虽然有研究报道GBS没有性别差异,但也有报道称GBS在男性中的发病率较高(男女比约为1.5∶1.0)[9]。本文与以往研究相似,GBS被认为是散发的,没有季节性活动,但也由研究发现,GBS更可能出现在春季(44.4%)和夏季(24.4%)[10]。
在大多数患者中,神经系统症状的急性发作之前是前驱感染病史,之后出现进行性肢体无力,通常在1个月内达到顶峰,大多数患者在出现症状前6周内出现呼吸道或胃肠道感染,这种临床症状通常表现为不同的严重程度和预后[11]。GBS与弯曲杆菌感染密切相关,空肠弯曲杆菌是最常见的和广泛报道的,但只有不到0.1%的感染导致该综合征[12]。由分子拟态和交叉反应抗体形成的感染诱导的异常免疫反应,由补体激活和某些宿主因子改变宿主的易感性贡献,已被涉及到GBS的免疫发病机制。约20%~30%的GBS患者需要机械通气[13],特别是在出现快速进展的肢体无力、自主神经功能障碍、球麻痹和双侧面肌无力的患者,机械通气与功能预后相关,与本文研究结果一致。
GBS诊断结果是没有明显的炎症表现,虽然在发病的第1周蛋白质水平可能是正常的,但如果在2或3周后测量,大多数患者的蛋白质水平会增加。先前的研究发现,GBS患者脑脊液蛋白异常升高可能是由于引起血-脑脊液屏障破裂或脉络膜丛炎症反应的疾病所致[14],这也是解释了本研究中脑脊液蛋白升高为何是预后不良的危险因素。
脱髓鞘型和轴索型代表了GBS最常见的临床亚表型,二者很难单独从临床角度进行区分,电生理在GBS的诊断、亚型的分类和预后的确定中起着决定性作用。传导阻滞和远端运动潜伏期延长似乎是脱髓鞘型的2个主要异常参数,发生在近50%的受累神经中,而F波延长和腓总神经传导速率减慢则不常见[15]。在轴突GBS中,减少的CMAP明显比缺失的F波更常见,但其频率与传导阻滞相当。考虑到单个运动神经,根据GBS亚型的不同,异常率似乎存在差异。在脱髓鞘型中,腓总神经和正中神经是最常受影响的神经,而在轴突GBS中,胫神经是最常受影响的神经,其次是腓总和尺神经。另一方面,正中神经较少受轴索型影响[16]。腓总神经传导速率减慢,虽然在脱髓鞘型中相对罕见,但在下肢更为常见。这表明对胫总神经进行单独的踝关节远端刺激会阻止腓总神经传导速率的测量。在脱髓鞘型中,远端运动潜伏期的评估似乎在上肢更重要,而在轴索GBS中,在下肢需要特别注意CMAP振幅[17]。
综上所述,腓总神经传导速率和胫神经运动传导速率减慢、F波和dCMAP 波幅异常率增加提示患者有预后不良的风险,故神经电生理检测对重症GBS患者病情及预后的预测具有重要价值。
