基于miRNA23/Nocth信号通路探讨极低频电磁场对缺血性脑卒中神经功能的修复作用
2023-08-10于德洋王先文
卢 灿, 于德洋, 王先文, 贾 萍
缺血性脑出血是最常见的脑出血类型,目前主要的治疗方法包括介入及溶栓,虽然再灌注效果确切、但仍不可避免会遗留神经功能损害,致残率较高[1]。因此,寻找有效策略促进缺血性脑卒中后神经功能恢复是相关研究的热点。近些年,电磁场对人体健康的影响受到越来越多关注,有研究报道极低频电磁场(extremely low frequency electromagnetic fields,ELF EMF)具有神经保护作用,能够改善创伤性颅脑损伤大鼠[2]、海马损伤大鼠[3]、学习记忆障碍大鼠[4]的神经功能,但ELF EMF在缺血性脑卒中发病过程中的神经保护作用及机制并不清楚。
微小RNA(microRNA,miRNA)是一类在转录后水平调节基因表达并发挥生物学作用的非编码小分子RNA,其中miR-23是一种具有神经保护作用的miR,过表达miR-23对脑缺血再灌注损伤具有抑制作用[5];另有研究证实,miR-23对Notch1信号通路的激活具有促进作用[6]。本课题组前期实验发现ELF EMF对miR-23的表达具有促进作用,提示ELF EMF可能通过miR-23发挥神经保护作用。基于此,本研究将在缺血性脑卒中大鼠中研究ELF EMF通过miR-23/Notch信号通路促进神经功能缺失恢复的作用及机制。
1 材料与方法
1.1 动物 SPF级雄性SD大鼠、8~10周龄、体质量160~200 g(上海菲诺克生物科技有限公司),生产许可:SCXK(沪)2018-0005。
1.2 试剂与仪器 2,3,5-氯化三苯基四氮唑(TTC,Sigma公司),细胞凋亡检测试剂盒(TUNEL法,上海碧云天公司),miR提取、反转录及荧光定量PCR试剂盒(北京天根生化公司),Notch1、Jagged1、Hes1、β-actin一抗(Abcam公司)。正置显微镜(Nikon公司),荧光定量PCR仪(ABI公司),凝胶电泳系统及成像系统(上海天能公司)。
1.3 方 法
1.3.1 动物分组及干预 动物实验分为两部分,第一部分验证ELF EMF改善缺血性脑卒中大鼠神经功能的作用;第二部分验证miR-23/Notch通路在ELF EMF改善缺血性脑卒中大鼠神经功能中的作用。
在第一部分实验中,实验动物随机分为假手术组、模型组、ELF EMF组,每组各16只。模型组、ELF EMF组参照Zea Longa[6]采用线栓法制备缺血性脑卒中模型,造模后24 h参照Zea Longa[7]评分进行神经功能评价,得分1~3分为造模成功;假手术组仅进行分离血管的假手术操作、但不阻塞血管。判断造模成功后,ELF EMF组进行ELF EMF干预,将鼠笼放入电磁发射器,设置参数为频率15 Hz、场强5G,每天一次、每次90 min。
在第二部分实验中,实验动物随机分为miR-NC+假手术组、miR-NC+模型组、miR-NC+ELF EMF组、miR-23+ELF EMF组,每组各16只。miR-NC+模型组、miR-NC+ELF EMF组、miR-23+ELF EMF组参照Zea Longa采用线栓法制备缺血性脑卒中模型,miR-NC+假手术组进行假手术操作,参照Zea Longa评分判断造模成功后,进行NC miR或miR-23抑制物的侧脑室注射,而后miR-NC+ELF EMF组、miR-23+ELF EMF组进行ELF EMF干预,方法参照ELF EMF组。
1.3.2 神经功能缺失程度的评估 每组大鼠在干预后7 d、14 d时采用Zea Longa[6]评分评估神经功能缺失程度。
1.3.3 脑梗死体积的检测 每组随机选择8只大鼠,处死后解剖完整脑组织,-20 ℃迅速冷冻15 min,而后进行冠状位连续切片、连续切取5片、厚度2 mm,将切片在TTC溶液中避光染色25 min,染色后的切片在4%多聚甲醛中4 ℃固定24 h。最后拍照并录入电脑,对每张切片的脑梗死面积进行测量,分别记为S1、S2、S3、S4、S5,按照公式:厚度×(S1+S2+S3+S4+S5)-厚度×(S1+S5)/2计算脑梗死体积。
1.3.4 细胞凋亡率的检测 每组剩余的8只大鼠取缺血侧皮质组织适量,4%多聚甲醛固定后制作病理切片,采用细胞凋亡检测试剂盒进行TUNEL染色及DAPI染色,在显微镜下观察染色情况并对阳性染色的细胞进行计数,TUNEL阳性细胞数/DAPI阳性细胞数即为细胞凋亡率。
1.3.5 miR-23表达水平的检测 取缺血侧皮质组织适量,采用miR提取试剂盒进行组织miR的提取,采用miR cDNA第一链合成试剂盒进行miR的反转录、得到cDNA,采用miR荧光定量PCR检测试剂盒进行PCR反应,体系为:cDNA 2 μl、反应预混液10 μl、上游引物及下游引物(5 μmol/L)各0.6 μl、去离子水6.8 μl,程序为:95 ℃预变性3 min,95 ℃ 15 s、60 ℃ 34 s的程序反应40个循环。完成PCR反应后得到循环曲线及阈值,以U6为内参、计算miR-23的表达量。
1.3.6 Notch1、Jagged1、Hes1表达水平的检测 取缺血侧皮质组织适量,采用组织裂解液进行匀浆、提取蛋白,采用BCA法检测蛋白含量后取30 μg蛋白进行蛋白电泳,分离不同分子量的蛋白后电转移至NC膜,用5%脱脂牛奶进行NC膜室温封闭、共1 h,用1∶1000稀释的Notch1、Jagged1、Hes1一抗或1∶5000稀释的β-actin一抗进行NC膜4 ℃孵育、过夜;次日,用1∶2000稀释的二抗进行NC膜室温孵育、共1 h,最后在凝胶成像系统中显影,根据显影得到蛋白条带的灰度值、以β-actin为内参计算Notch1、Jagged1、Hes1的蛋白表达水平。

2 结 果
2.1 ELF EMF对缺血性脑卒中大鼠神经功能及脑梗死体积的影响 假手术组未出现神经功能缺失及脑梗死灶,模型组及ELF EMF组均出现神经功能缺失及脑梗死灶。与假手术组比较,模型组的Zea Longa评分7 d(2.49±0.45)、14 d(2.36±0.35)及脑梗死体积均明显增加(P<0.05);与模型组比较,ELF EMF组的Zea Longa评分7 d(1.87±0.29)、14 d(1.12±0.1)及脑梗死体积均明显降低(P<0.05)(见图1)。

与假手术组比较*P<0.05;与模型组比较#P<0.05。
2.2 ELF EMF对缺血性脑卒中大鼠脑组织细胞凋亡的影响 与假手术组比较,模型组的脑组织细胞凋亡率明显增加(P<0.05);与模型组比较,ELF EMF组的脑组织细胞凋亡率明显降低(P<0.05)(见图2)。
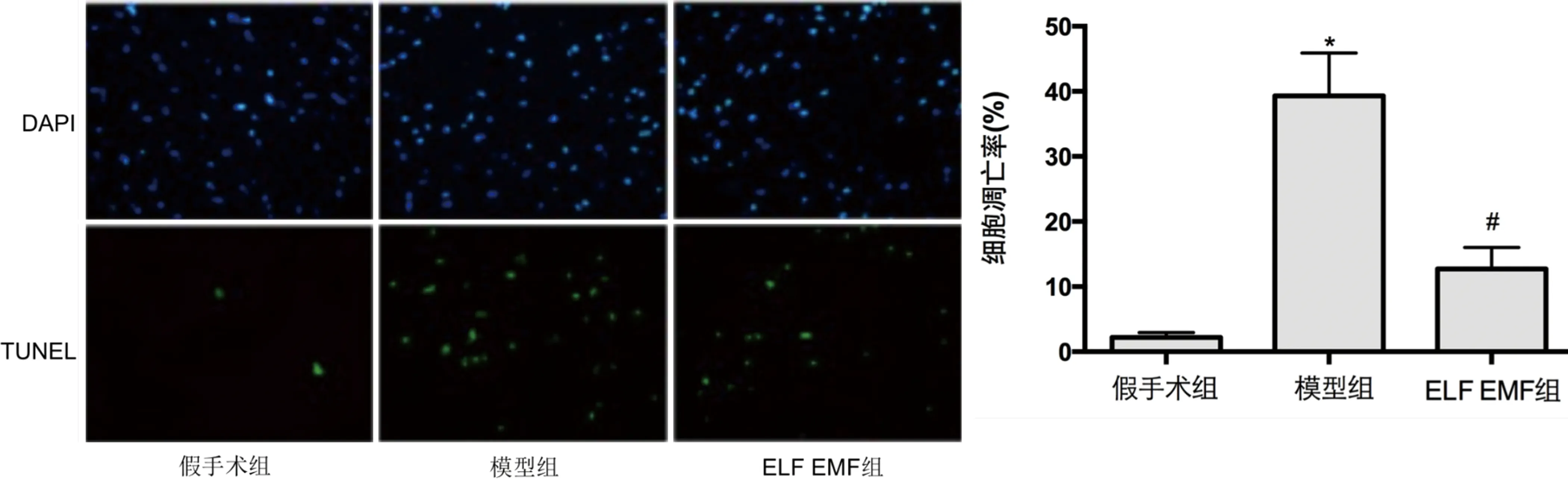
与假手术组比较*P<0.05;与模型组比较#P<0.05。
2.3 ELF EMF对缺血性脑卒中大鼠脑组织中miR-23表达的影响 与假手术组(1.00±0.19)比较,模型组脑组织中miR-23的表达水平为(0.39±0.08)明显降低(P<0.05);与模型组比较,ELF EMF组脑组织中miR-23的表达水平为(0.89±0.13)明显增加(P<0.05)。
2.4 ELF EMF对缺血性脑卒中大鼠脑组织中Notch通路的影响 与假手术组比较,模型组脑组织中Notch1、Jagged1、Hes1的表达水平明显降低(P<0.05);与模型组比较,ELF EMF组脑组织中Notch1、Jagged1、Hes1的表达水平明显增加(P<0.05)(见图3、表1)。

表1 3组大鼠脑组织中Notch1、Jagged1、Hes1表达水平的比较

图3 3组大鼠脑组织中Notch1、Jagged1、Hes1的电泳图
2.5 局部注射腺病毒敲低miR-23的效果 与miR-NC+假手术组(1.00±0.20)比较,miR-NC+模型组脑组织中miR-23的表达水平(0.41±0.09)明显降低(P<0.05);与miR-NC+模型组比较,miR-NC+ELF EMF组脑组织中miR-23的表达水平(0.92±0.14)明显增加(P<0.05);与miR-NC+ELF EMF组比较,miR-23+ELF EMF组脑组织中miR-23的表达水平(0.32±0.08)明显降低(P<0.05)(见表2)。

表2 3组大鼠脑组织中miR-23表达水平的比较
2.6 敲低miR-23对ELF EMF调控缺血性脑卒中大鼠神经功能及脑梗死体积的影响 与miR-NC+假手术组比较,miR-NC+模型组的Zea Longa评分及脑梗死体积均明显增加(P<0.05);与miR-NC+模型组比较,miR-NC+ELF EMF组的Zea Longa评分及脑梗死体积均明显降低(P<0.05);与miR-NC+ELF EMF组比较,miR-23+ELF EMF组的Zea Longa评分及脑梗死体积均明显增加(P<0.05)(见图4、表3)。

表3 4组大鼠Zea Longa评分的比较
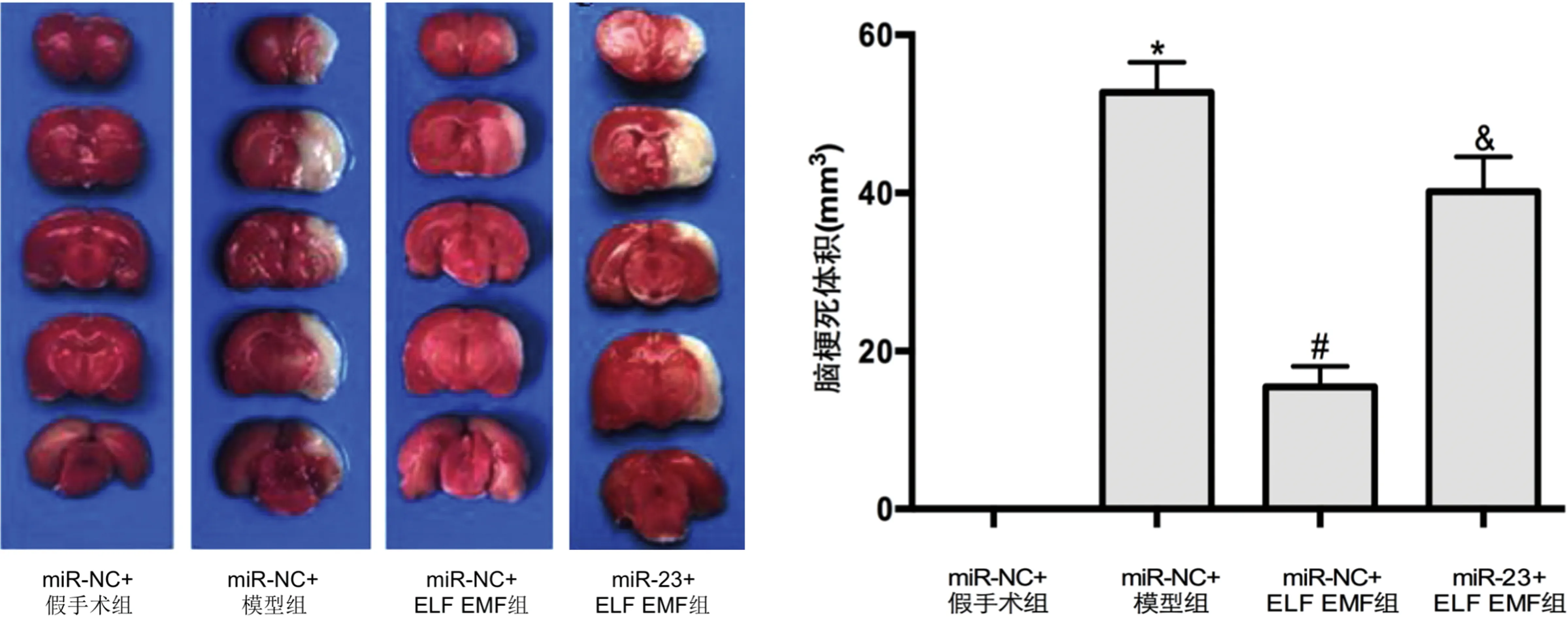
与miR-NC+假手术组比较*P<0.05;与miR-NC+模型组比较#P<0.05;与miR-NC+ELF EMF组比较&P<0.05。
2.7 敲低miR-23对ELF EMF调控缺血性脑卒中大鼠脑组织细胞凋亡的影响 与miR-NC+假手术组比较,miR-NC+模型组的脑组织细胞凋亡明显增加(P<0.05);与miR-NC+模型组比较,miR-NC+ELF EMF组的脑组织细胞凋亡明显降低(P<0.05);与miR-NC+ELF EMF组比较,miR-23+ELF EMF组的脑组织细胞凋亡明显增加(P<0.05)(见图5)。

与miR-NC+假手术组比较*P<0.05;与miR-NC+模型组比较#P<0.05;与miR-NC+ELF EMF组比较&P<0.05。
2.8 敲低miR-23对ELF EMF调控缺血性脑卒中大鼠脑组织中Notch通路的影响 与miR-NC+假手术组比较,miR-NC+模型组脑组织中Notch1、Jagged1、Hes1的表达水平明显降低(P<0.05);与miR-NC+模型组比较,miR-NC+ELF EMF组脑组织中Notch1、Jagged1、Hes1的表达水平明显增加(P<0.05);与miR-NC+ELF EMF组比较,miR-23+ELF EMF组脑组织中Notch1、Jagged1、Hes1的表达水平明显降低(P<0.05)(见图6、表4)。

表4 4组大鼠脑组织中Notch1、Jagged1、Hes1表达水平的比较

图6 4组大鼠脑组织中Notch1、Jagged1、Hes1的电泳图
3 讨 论
ELF EMF是近些年发现的具有神经保护作用的物理治疗手段,机体内环境的频率在15 Hz左右,通过ELF EMF给予一个频率与内环境相近的外加电磁场有利于机体内环境形成谐振作用,使血管及组织的自律运动振幅增加并改善血管通透性,最终改善病灶局部的缺血缺氧、促进病灶修复[8,9]。已有研究证实ELF EMF对创伤性颅脑损伤大鼠[2]、海马损伤大鼠[3]、学习记忆障碍大鼠[4]的神经功能具有改善作用,本研究在已有研究的基础上将ELF EMF用于缺血性脑卒中的治疗,通过线栓法建立缺血性脑卒中模型后进行ELF EMF干预,结果发现缺血性脑卒中大鼠的神经功能明显改善、脑梗死体积明显缩小,表明ELF EMF能够在缺血性脑卒中发生后起到神经保护作用。
在证明ELF EMF的神经保护作用后,本研究深入探究了与神经保护作用相关的分子机制。miR在中枢神经系统中的作用受到越来越多关注,多种miR在缺血性脑组织的发病过程中起到保护作用,相应的外周血miR表达也能作用缺血性脑卒中的病情评价标志物[10,11]。另有多项针刺、电刺激相关的研究证实,不同的物理治疗手段能够通过调控miR的表达起到神经保护作用[12,13]。MiR-23是目前受到广泛关注一种具有神经保护作用的miR,在缺血性脑卒中动物模型[5]、缺氧诱导神经元损伤模型[14]中表达降低。本研究也证实缺血性脑卒中模型大鼠脑组织中miR-23的表达水平降低,在给予ELF EMF干预后、脑组织中miR-23的表达水平增加,提示ELF EMF可能通过增加miR-23的表达起到神经保护作用。
本研究进一步通过侧脑室注射miR-23抑制物的方式验证miR-23在ELF EMF减轻缺血性脑卒中大鼠神经功能损害中的作用,在ELF EMF干预前侧脑室注射miR-23抑制物能够敲低miR-23,在敲低miR-23后ELF EMF减轻神经功能损害、缩小脑梗死体积、抑制脑组织细胞凋亡的作用发生逆转,表明ELF EMF在缺血性脑卒中发生后起到的神经保护作用与增加miR-23的表达有关。
近些年关于miR-23的研究表明Notch1信号通路受到miR-23的调控[6]。Notch1信号通路有Notch1、Jagged1、Hes1组成,该通路激活具有促进细胞存活、抑制细胞凋亡的作用。多项基础研究证实,缺血性脑卒中发病过程中Notch1信号通路受到抑制[15,16],Gao[17]的研究还发现ELF EMF在脑缺血过程中促进Notch1信号通路的激活。本研究的结果与既往文献的报道一致,缺血性脑卒中大鼠脑组织中Notch1、Jagged1、Hes1的表达降低,ELF EMF干预后Notch1、Jagged1、Hes1的表达增加。进一步观察miR-23对Notch1的调控作用可知:在ELF EMF干预前侧脑室注射miR-23抑制物能够使Notch1、Jagged1、Hes1的表达降低,表明miR-23可能在缺血性脑卒中发病及治疗中参与Notch1通路的调控,ELF EMF可能通过增加miR-23的表达促进Notch1信号通路激活,进而发挥神经保护作用。
综上所述,ELF EMF能够促进缺血性脑卒中大鼠神经功能缺失恢复,同时增加miR-23表达、促进Notch1通路激活,通过侧脑室注射抑制物敲低miR-23的表达后、ELF EMF的神经保护作用减弱,进而提示ELF EMF在缺血性脑卒中大鼠中的神经保护作用与增加miR-23表达、激活下游Notch1通路有关。
