模型认知:知识模型与认识模型
2023-08-10李发顺


摘要: 以NH3、 N2H4和NxHy等物质为载体,融入NH3的空间结构、物理性质、化学性质(弱碱性、氧化性、还原性)及制备方法等学科知识,建立氮氢化合物内容的知识模型。从NH3→N2H4→NxHy,以熟悉物质的结构和性质关系为原型,类比、预测、求证N2H4的知识,迁移NxHy的认识,建立“原型类比(模仿与创新)求证”的氮氢化合物认识模型,加深与巩固“结构决定性质”的学科思想。
关键词: 知识模型; 认识模型; 氮氢化合物; 单元教学; 迁移推理
文章编号: 10056629(2023)07008904
中图分类号: G633.8
文獻标识码: B
一般复习课具有三重层次:第一层次是知识的罗列与再现;第二层次是以情境设计主线,将复习内容有机整合;第三层次则是既对所学知识进行重整、联前启后,更是将学科内看似“独立”的内容从内在本质上进行联系与整合,是一次综合再提升的过程[1]。对于氮氢化合物的复习,往往是说到氨气就是其结构、性质、制备和用途的再现,谈到N2H4主要是关于键能与热化学方程式的书写。仅停留在此层次的复习是远远不够的,在此以“氮氢化合物”单元复习为例,从知识模型与认识模型阐释“模型认知”学科核心素养的培育。
1 对知识模型与认识模型的理解
《普通高中化学课程标准(2017年版2020年修订)》对模型认知的表述为:知道可以通过分析、推理等方法认识研究对象和本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律[2]。“模型认知”是化学学科核心素养,究竟什么是模型?高中化学的学习模型包括哪些内容?带着这样的思考研读了陈进前老师[3]的文章及专家学者们的说法。笔者认为,在教学过程中首先要认识和辨清化学知识模型(学科内容、学科本质)和认识模型(研究方法、认识方式)的区别和关联。
化学知识模型是指从化学视角认识和描述物质结构和性质、概念和原理。例如,对于原子,不仅要知道可以通过得失电子形成离子,或者通过化学键形成分子或物质,在化学变化中探讨原子的重新组合;还需要弄清楚科学规则下的概念、内涵和外延,同样是对原子的认识,原子包括原子核和电子,原子核带正电荷与电子带负电荷且正负电荷数相等,其质量主要集中在原子核,原子是一个空心体,电子在一定的轨道上绕着原子核飞速运动等。而认识模型是指研究方法、研究策略与研究设计。对于原子,一是研究其质量、构成、变化、计量(相对原子质量、物质的量);二是通过重走科学家的认识与研究路线体验“假设实证结论”的反复实践与修正过程,建立自己的认识;三是通过类比宏观运动理解原子结构,通过电性作用认识原子间组合的原因与定比关系。
知识模型是认知的对象,基于某核心知识的相关内容结构化,建立知识体系。认识模型是怎样获取知识、理解知识内涵与外延、构建知识体系的认知思维方式。知识模型是对象,认识模型则是工具。
2 从课程标准中厘清氮氢化合物的知识模型
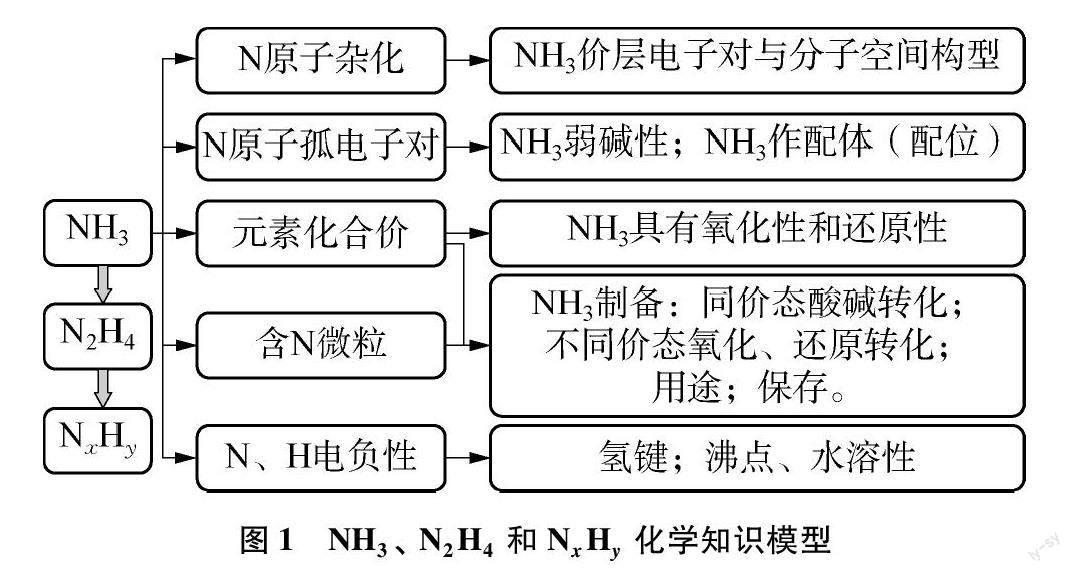
高中化学研究“氮氢化合物”的哪些内容?课堂教学需要学生学习的具体内容是什么?这些内容之间有怎样的内在联系?带着这些问题分析“氮氢化合物”的知识,构建其结构化的知识模型。氮是第2周期第ⅤA族元素,在化学反应中通常可以得到3个电子(或形成3个共用电子对)达到8电子稳定结构;氮原子之间通过σ键和π键结合,多个N原子有一定的位置关系(共价键的方向性);氮原子通过共用电子对与氢原子结合,基于氮氢原子电负性差异,知道氮具有较强的还原性,氢具有氧化性。下面以最简单的氮氢化合物NH3为例,列举与构建“氮氢化合物”的知识模型。NH3分子结构特征、微粒间的作用力、性质、用途、制备与保存等化学知识,还要认识上述知识间的内在关系,如结构与性质、性质与用途、性质与保存之间的关系等。
(1) 氨气分子是四面体结构(三角锥形),结合一个质子(氨气分子有孤电子对)形成的NH+4是正四面体结构;
(2) 氨气具有氧化性与还原性;
(3) 氨气易液化,极易溶于水;
(4) 氨气的工业制法和实验室制法;
(5) 氨气可以用作氮肥与制冷剂;
(6) N2H4也具有与NH3类似的性质;
(7) 多氮氢化物(NxHy)也具有与N2H4、 NH3相似的性质。
它们之间存在下述关系,见图1。
为什么NH3不是平面(正)三角形?这就与微粒间作用力有关,因为氨分子中存在3个共用电子对和1个孤电子对,4个电子对之间存在电性排斥致电子对相距尽可能远(不能脱离氮原子核),孤电子对与键合电子对排斥力大于键合电子对之间的排斥力,所以呈现三角锥形,再接受1个质子,通过4个键合电子对形成NH+4,此时各个电子对之间作用力相同,形成正四面体。而看似相似的BF3,硼原子与氟原子只形成3个共用电子对,没有孤电子对排斥,所以是平面(正)三角形。
为什么NH3分子可以形成配位键?因为NH3分子中的氮原子有孤电子对,能够吸引质子(H+,有一个空轨道),形成由氮原子提供1对电子的特殊共价键,称为配位键。由于NH3中有孤电子对,能够接受质子而呈碱性。
为什么NH3分子极易溶于水和易液化?由于NH3分子中氮氢之间共用电子对偏向氮原子(电负性强),导致H原子因电子对偏离而成为裸露的质子,有强正电性,遇到有孤电子对且非金属性强的原子(N、 O、 F)时会形成一种较强的电性作用——氢键。NH3分子之间因氢键缔合,易液化;NH3与H2O分子间形成氢键,则水溶性好。
为什么NH3有还原性和氧化性?NH3分子中氮元素显3价,可以发生氧化反应(外界氧化剂作用)生成含氮物质,如N2、 NO等。NH3分子中H显+1价,可以发生还原反应,如与活泼金属反应生成H2,并且由于NH3分子中H原子相同,所以均可以被还原,根据活泼金属与NH3的定量关系可生成NH-2、 NH2-、 N3-等微粒。
怎样可以得到氨气?可以由铵盐(含有NH+4)与能结合质子的微粒作用,使其失去质子产生NH3,也可以由N2和H2化合产生NH3,或者由浓氨水分解产生NH3。选用哪一种制备方法,与原料、设备、用量及成本有关。
依据NH3的知识模型,推测N2H4和NxHy的结构与性质,笔者在教学实践中与学生一起探讨N2H4和NxHy的结构与性质,评估学生知识的理解与迁移运用能力,构建NxHy结构与性质的认识模型。
3 构建氮氢化合物的认识模型
怎样构建“氮氢化合物”认识模型?元素化合物学习中统摄性大概念是“结构决定性质”,重要的方法是类比(模仿与创新),模仿是近迁移,创新是远迁移。通过NH3的复习,类推到对N2H4的知识理解,形成类推中“结构决定性质”观念的实践,进一步迁移认识NxHy化合物。构建结构到性质的认识模型,如图2所示。
3.1 構建配位键“空轨道孤电子对”认识模型
怎样认识氮氢化合物中氮原子与H+形成配位键与配合物?是不是所有的氮氢化合物都可以与H+形成特殊的共价键(配位键)呢?答案是肯定的,因为氮原子有孤电子对,而H+存在空轨道,也就是说NH3、 N2H4、 NxHy都可以与H+形成配位键,在知识学习过程中形成思维程序,获得研究方法。延伸有孤电子对的微粒与有空轨道的H+可以形成这类配位键,所以H2O、 H2O2、 H2S等也都可以形成配位键。如果能够根据学生学习能力适时地提一下NH3分子中的孤电子对不仅能与H+形成配位键,也可以与一些金属阳离子形成配位键(金属阳离子提供空轨道,配体提供孤电子对),由此联想到[Ag(NH3)2]+、 [Cu(NH3)4]2+等,再让学生解释[Cu(H2O)4]2+、 [CuCl4]2-、 [Al(OH)4]-、 [Fe(SCN)6]3-等。新课学习时这些络合离子都是独立无关联的(称为碎片化的知识),通过复习教学建立关联(结构化知识),这就是络合离子(有空轨道的金属阳离子与含有孤电子对的微粒通过配位键结合)的联系与结构化的认识,构建配位键形成的认识模型,如图3所示。
3.2 构建物质“结构微粒间作用价态”认识模型
第一,怎样认识氮氢化合物的空间结构与碱性?氮氢原子间通过共用电子对形成独立的NH3,再通过分子间作用力聚集在一起,由于3个键合电子对及孤电子对之间存在较强的作用力,电子对之间位置尽可能远,所以是四面体结构(三角锥形)。由于NH3分子中的N原子还具有孤电子对,所以可以接受一个H+形成NH+4后的4个键合电子完全相同,所以NH+4是正四面体结构。学生顺着这样的思路分析N2H4成键情况和孤对电子,发现两个N原子上均存在孤电子对,所以都可以接受质子,也具有碱性,写出其在水中的电离方程式,自然而然地关注N2H4的一级电离和二级电离,提供电离平衡常数,比较判断N2H4的碱性与氨的强弱?有了NH3、 N2H4的认识,模仿烷烃学生写出了N3H5、 N4H6…NxHx+2,课堂教学中有学生写出HNNH、 HNN—NH2、 NN(就是单质N2)等,从类比烷、烯到炔,这就是教学的生成。同时笔者又提出P、 Si等元素是否也存在这样类似的氢化物,这是人类继打开无机物到有机物这扇窗之后,又可能打开的另一扇“类有机物”的大门。
第二,怎样认识含氮氢化合物之间是否存在氢键?因为氮的电负性比较强,所以氮氢键中共用电子对偏向氮原子明显,导致氢原子如同裸露的质子(H+,有很强的正电性),又会与电负性很强且有孤对电子的原子(N、 O、 F)之间形成氢键,这就是氢键的学科本质。由于氢键的作用,NH3、 N2H4、 NxHy等与H2O缔合,可能导致溶解性增强,也可能形成水合物等。NH3与H2O分子间形成氢键,不仅水溶性增大,还会增加了H2O的电离,使得溶液呈碱性,NH3+H2ONH3·H2ONH+4+OH-,推测NH3分子之间的氢键是否也会导致NH3分子电离,如NH3+NH3NH+4+NH-2,通过电离常数比较,得出NH3自耦电离和NH3在H2O中电离能力强弱,了解NH3的自耦电离(不需要讲这些概念与理论),同理N2H4、 NxHy也会有自耦电离,教师提供电离平衡常数,学生通过比较分析,得出结论,获得成就感,结构化认识物质结构与性质,留有延伸性的思考,这就是复习教学的价值。
第三,怎样认识NH3和NxHy的氧化性与还原性?从化合价(电性)角度来分析氮氢元素的化合价,氮是-3价,氢是+1价,NH3既有还原性又有氧化性,帮助学生学会从元素化合价视角认识物质可能的氧化性或还原性,再通过实验进行实证,与自己的预测进行一致性分析,建立从化合价分析物质氧化性与还原性的认识模型,如图4所示。
引导学生预测NH3与活泼金属Na、金属氧化物CuO等反应可能的产物并写出相应的化学方程式,以此类推N2H4、 NxHy与上述物质反应可能的产物分析,实践并巩固“结构决定性质”的学科思想。通过物质的微观结构、微粒间作用、价态等视角预测可能的性质,并进行分析论证,拓展延伸未知物结构与性质预测,构建基于“结构微粒间作用价态”物质性质的认识模型。
3.3 构建“价态(类别)升降(酸碱)”物质制备认识模型
怎样认识NH3的制取方法?如果仅是让学生说出和书写实验室用“铵盐与熟石灰”反应制取氨气,工业上用“N2+H2”反应制取氨气,这就没有复习教学的意义,纯粹是知识的再现过程。复习教学更重要的是帮助学生建立NH3制取方法的认识模型,如图5所示。
复习教学实践中,第一步让学生写出自己熟悉的含氮物质;第二步标出氮元素化合价,并与目标产物(NH3)中氮元素化合价比较;第三步高价态的怎样降低;第四步同价态的怎样转化;第五步分析为什么工业制取与实验室少量制取的差异,学生分析可能的原因。从而实现物质制备方案设计与优化的认识模型构建。
4 启示
4.1 知识结构化过程中的认知思维构建
复习课的教学起点是已有的知识与能力,目标是可能的知识增长点和思维发展空间。NH3的复习内容,从N原子结构、化合价的角度解释其性质及发生变化的原因,这是原有知识结构化的过程,由此类比预测N2H4可能具有的性质,并用事实证据、实验证据和理论证据进行求证,建立起从原子结构与主要化合价视角认识物质的思维模型,迁移学习与认识其他NxHy化合物,打开思维的天窗[4],提出“类有机物”的含氮化合物认识的创新性思考,从而实现用认识模型迁移推理未知的世界(物质与原理),促进知识与认识的发展。
4.2 多元视角任务设计中的认知进阶
NH3的结构与性质学习中基于孤电子对、电负性和元素化合价与熟悉的性质进行联系与反刍,建立结构与性质的对应关系。从NH3→N2H4→NxHy, N原子都存在孤电子对,所以都能与金属阳离子(含有空轨道)形成相应的络合离子,而且还可以进一步推理到金属阳离子(含有空轨道)与其他有孤电子对的微粒(分子、离子)通过配位键进行络合,开启络合(配位)认识的认知进阶。从NH3→N2H4→NxHy, NH3分子中N显-3价(最低价),H显+1价(最高价),则分别体现了还原性(可以将氧化性物质如Cl2、 CuO等还原)和氧化性(将活泼金属Na、 Li等氧化)。据此分析N2H4、 NxHy中N、 H元素化合价,推理同样具有的化学性质,实现基于元素价态分析氧化性与还原性的认知进阶。
参考文献:
[1]李发顺. 从氨气出发——以氨气的高三复习为例[J]. 化学教与学, 2016, (5): 31~33, 23.
[2]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 5.
[3]陈进前. “模型认知”是重要思维方式[J]. 化学教学, 2020, (5): 9~14.
[4]李发顺. 教学的目的是打开思维的天窗——谈“弱电解质电离平衡”教学设计思考[J]. 化学教学, 2019, (7): 47~50.
