胰腺癌组织中MIB1、MAL2表达与患者临床病理特征及预后的关系*
2023-08-09朱加娣陈玲玲
朱加娣,吴 宏,陈玲玲,张 晶
如皋市人民医院普外科,江苏如皋 226599
胰腺癌是侵袭性较高的恶性肿瘤,是癌症相关死亡的第七大原因[1]。由于解剖位置隐匿,临床早期症状不典型,发现时多已为晚期,生存预后较差,5年生存率仅10%[2]。深入研究胰腺癌的生物标志物,有利于胰腺癌早期诊治及预后判断。Mindbomb同源物1(MIB1)基因编码蛋白含多个锚蛋白重复序列和 RING 指结构域,具有E3泛素连接酶的活性,参与Notch信号传导的调节。近年来发现,MIB1在多形性腺瘤,颅脑恶性肿瘤等肿瘤中表达上调,其能通过影响肿瘤的增殖及转移,参与肿瘤的发生发展过程[3-4]。T细胞分化蛋白2(MAL2)基因编码蛋白是一种多跨膜蛋白,是参与构成脂筏的一种成分,能够将膜结合蛋白和外源性物质从细胞基底外侧传递到顶端表面。近年来发现,MAL2在乳腺癌、甲状腺癌等恶性肿瘤中表达升高,通过内吞降解细胞表面肿瘤抗原,导致免疫细胞不能识别肿瘤细胞,介导肿瘤免疫逃逸[5-6]。本研究通过检测MIB1、MAL2在胰腺癌中的表达,探讨两者的临床意义。现报道如下。
1 资料与方法
1.1一般资料 选取2018年1月至2020年1月本院诊治的82例胰腺癌患者作为研究对象。研究对象中男44例、女38例,平均(56.47±3.47)岁,肿瘤最大径为1.8~7.2 cm,平均(3.56±1.18)cm。研究对象按照肿瘤部位分为胰头部57例,胰体尾部25例;按照分化程度分为高中分化52例,低分化30例;按照临床分期分为Ⅰ~ⅡA 期42例,ⅡB~Ⅲ 期40例;按照有无淋巴结转移分为淋巴结转移51例,无淋巴结转移31例。纳入标准:(1)经病理学检查明确诊断为胰腺癌,由两位病理医师共同阅片诊断;(2)既往无放化疗等肿瘤治疗史;(3)患者能够配合相关检查及治疗,临床和随访资料完整。排除标准:(1)合并其他恶性肿瘤;(2)伴有严重心肺功能衰竭;(3)患者存在精神障碍性疾病,不能配合相关治疗及随访。本研究经本院伦理委员会审核批准通过。
1.2MIB1、MAL2蛋白表达检测 采用免疫组织化学染色法检测癌及癌旁组织中MIB1、MAL2蛋白表达。实验步骤按照免疫组化两步法试剂盒说明书进行操作(北京中杉金桥,货号PV6000)。兔抗人MIB1、MAL2单克隆抗体购自英国abcam公司(货号ab124929、 ab1217919),一抗稀释工作浓度均为1∶100。根据镜下免疫组化染色强度评分与染色面积评分的乘积进行半定量免疫组化染色评分。免疫组化染色强度评分:无染色0分,浅黄色1分,棕黄色2分,棕褐色3分;染色面积评分:阳性面积<25%计1分,25%~<50%计2分,50%~<75%计3分,≥75%计4分。染色深度评分与染色面积评分的乘积≥2分为阳性,染色深度评分与染色面积评分的乘积<2分为阴性。
1.3实时荧光定量PCR检测组织MIB1、MAL2 mRNA表达 用Trizol法提取组织中总RNA,将总RNA反转录合成cDNA,进行荧光定量PCR反应。引物序列由上海华大公司设计合成。引物序列为MIB1正向:5′-ATGAGTAACTCCCGGAATAACCG-3′,反向:5′- GCCGTTGTCCCACACTACC-3′;MAL2正向:5′-ATCATTGGCATTCGATGGAAG T-3′,反向:5′-CCCGGTGTAGTAATTCGGTAAA A-3′;甘油醛-3-磷酸脱氢酶(GAPDH)正向:5′-CAGCCAGAGGAATCTTTGCAG-3′,反向:5′-CCTTTCCCCTACGTCCATTTC-3′。反应条件为95 ℃预变性5 min,95 ℃ 变性30 s,62 ℃退火30 s,70 ℃ 延伸30 s,共35个循环。反应体系:SYBR Green premix 10 μL,上下游引物各1 μL,cDNA 模板2 μL和ddH2O 6 mL。以GAPDH为内参,采用2-ΔΔCt法表示MIB1、MAL2 mRNA的相对表达量。分别以MIB1、MAL2 mRNA相对表达量的平均值3.02、6.65作为阈值,分为MIB1 mRNA高表达(MIB1 mRNA≥3.02)患者40例(MIB1 mRNA高表达组)和MIB1 mRNA低表达(MIB1 mRNA<3.02)患者42例(MIB1 mRNA低表达组),MAL2 mRNA高表达(MAL2 mRNA≥6.65)患者43例(MAL2 mRNA高表达组)和MAL2 mRNA低表达(MAL2 mRNA<6.65)患者39例(MAL2 mRNA低表达组)。
1.4随访 所有患者出院后开始进行定期随访,以门诊复查随访或电话随访,每个月随访一次,随访内容为患者生存状态。所有患者随访两年,随访截至2022年2月。
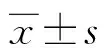
2 结 果
2.1胰腺癌组织及癌旁组织MIB1、MAL2蛋白表达 胰腺癌组织中MIB1及MAL2蛋白黄褐色阳性表达主要位于细胞膜和细胞浆。胰腺癌组织中MIB1阳性表达率为95.12%(78/82),显著高于癌旁组织7.32%(6/82),差异有统计学意义(χ2=126.514,P<0.05)。胰腺癌组织中MAL2阳性表达率97.56%(80/82),显著高于癌旁组织9.76%(8/82),差异有统计学意义(χ2=127.120,P<0.05)。见图1。

图1 胰腺癌组织及癌旁组织中MIB1、MAL2蛋白表达(×200)
2.2胰腺癌及癌旁组织MIB1、MAL2 mRNA表达及相关性 胰腺癌组织中MIB1、MAL2 mRNA的相对表达量分别为(3.02±0.66)、(6.65±1.19),明显高于癌旁组织(1.83±0.40)、(3.56±0.68),差异有统计学意义(t=13.963、20.415,P<0.05)。见图2。Pearson相关性分析结果显示,胰腺癌组织中MIB1与MAL2 mRNA表达呈显著正相关(r=0.427,P<0.05)。
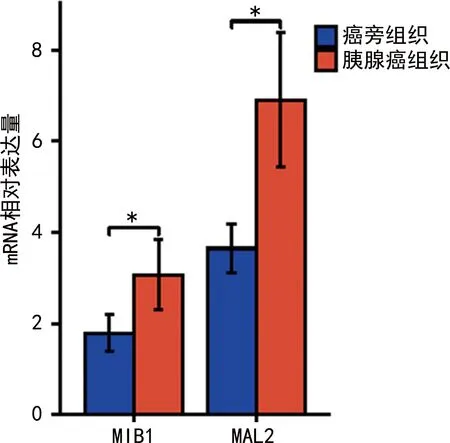
注:与癌旁组织比较,*P<0.05。
2.3胰腺癌组织中MIB1、MAL2 mRNA表达水平与胰腺癌临床病理特征的关系 不同肿瘤分期及淋巴结转移胰腺癌组织中MIB1、MAL2 mRNA表达比较差异有统计学意义(均P<0.05),不同年龄、性别、分化程度、肿瘤最大径及肿瘤部位癌组织中MIB1、MAL2 mRNA表达比较差异无统计学意义(均P>0.05)。见表1。
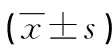
表1 MIB1、MAL2 mRNA表达与临床病理特征的关系
2.4MIB1、MAL2 mRNA表达与胰腺癌患者预后的关系 MIB1 mRNA高表达组和低表达组中位生存时间分别为8.62(7.40,9.84)个月、17.86(15.73,19.99)个月。Kaplan-Meier生存曲线结果,MIB1 mRNA高表达组患者累积生存率显著低于低表达组患者(χ2=39.338,P<0.001)。MAL2 mRNA低表达组和高表达组中位生存时间分别为7.14(6.94,8.53)个月、18.63(15.34,20.50)个月。MAL2 mRNA高表达组患者累积生存率显著低于低表达组患者(χ2=50.306,P<0.001)。见图3。

图3 Kaplan-Meier生存曲线分析MIB1、MAL2 mRNA表达与胰腺癌患者预后的关系
2.5单因素及多因素COX回归分析影响胰腺癌患者预后的因素 以胰腺癌患者的生存状态为因变量(赋值:1=死亡,0=存活),纳入年龄(赋值:1=≥60岁,0=<60岁)、性别(赋值:1=男,0=女)、肿瘤最大径(赋值:1=≥4 cm,0=<4 cm)、肿瘤位置(赋值:1=胰头部,0=胰体尾部)、淋巴结转移(赋值:1=有,0=无)、肿瘤分期(赋值:1=ⅡB~Ⅲ期,0=Ⅰ~ⅡA期)、分化程度(赋值:1=低分化,0=高中分化)、MIB1 mRNA(赋值:1=高表达,0=低表达)、MAL2 mRNA(赋值:1=高表达,0=低表达)为自变量,进行单因素COX回归分析。结果肿瘤分期、淋巴结转移、MIB1 mRNA、MAL2 mRNA与胰腺癌患者预后有关。多因素COX回归分析,结果肿瘤分期ⅡB~Ⅲ期、伴淋巴结转移、MIB1 mRNA高表达、MAL2 mRNA高表达是影响胰腺癌患者不良生存预后的独立危险因素。见表2、3。
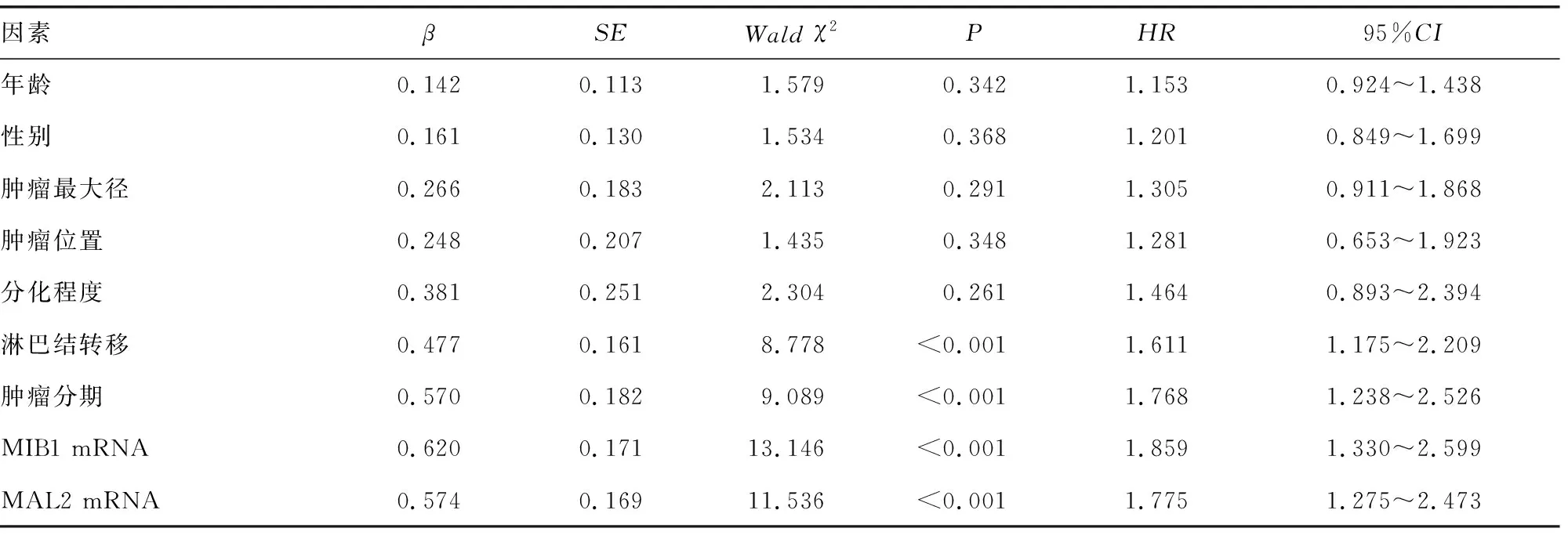
表2 影响胰腺癌患者预后的单因素Cox回归分析

表3 影响胰腺癌患者预后的多因素Cox回归分析
3 讨 论
胰腺癌肿瘤异质性高,具有生长速度快、转移潜能高、容易产生化疗耐药等特点[7]。尽管最近在癌症治疗方面取得了进展,但胰腺癌患者的预后仍然极差。近年来,临床上采用肿瘤分期,分化程度等对胰腺癌临床预后进行评估,但仍然难以预测不同胰腺癌患者个体的临床预后结果[8]。因此,揭示胰腺癌的发病机制,寻找新的有效的肿瘤分子标志物,有助于胰腺癌患者的临床诊治及改善患者的临床预后。
MIB1是一种E3泛素连接酶,可以泛素化Notch配体Delta蛋白,调节Notch信号通路,进而调控细胞增殖、迁移或细胞衰老等生物学过程[9]。本研究通过免疫组化发现,MIB1阳性染色主要位于细胞质和细胞膜,其原因与MIB1的E3泛素连接酶功能有关,MIB1能够泛素化细胞膜表面的Notch受体,并促进其内吞,发挥激活Notch下游通路的效应[10]。本研究中,胰腺癌组织中MIB1 mRNA及蛋白表达均显著升高,这与FU等[11]利用人类肿瘤基因组图谱数据库中分析的研究结果报道一致,提示MIB1可能参与胰腺癌的疾病发生。胰腺癌中MIB1表达上调的机制可能与非编码RNA表达调控有关。研究表明,微小RNA-198能够靶向调节MIB1 mRNA的稳定性,肿瘤细胞中微小RNA-198的表达下调引起MIB1 mRNA的稳定性增加,促进MIB1的蛋白表达,促进肿瘤的增殖[12]。本研究中,MIB1表达与胰腺癌肿瘤分期及淋巴结转移有关,提示MIB1促进胰腺癌的肿瘤进展。ZHANG等[13]在体外实验中发现,胰腺癌肿瘤细胞中MIB1的表达上调能够促进抑癌因子致瘤蛋白7的泛素化降解,激活含IQ结构域的GTP激酶活化蛋白1的表达,导致胰腺癌肿瘤细胞的过度增殖。尚有学者发现,MIB1能够通过激活β连环蛋白的表达,增强胰腺癌细胞的过度增殖及淋巴转移能力,导致肿瘤进展[11]。因此,胰腺癌中MIB1是一种致癌因子,其表达升高参与促进胰腺癌的肿瘤进展。研究表明,胰腺癌中Wnt/β-连环蛋白通路的过度激活能够促进细胞自噬,促进肿瘤细胞对吉西他滨的耐药性形成[14]。因此,推测MIB1的表达可能与胰腺癌的临床预后有关。本研究中证实,MIB1 mRNA高表达是胰腺癌患者生存预后较差,是患者不良预后的独立危险因素。临床上,医师可以利用胰腺癌癌组织中MIB1的表达对患者的临床预后进行评估,对高危患者进行个体化的治疗,以改善患者的生存预后。
MAL2编码基因位于8q24.12,属于蛋白脂质家族的成员[15]。MAL2是一种多跨膜蛋白,是脂筏构成成分,参与MAL2蛋白的胞吞及胞内转运膜结合蛋白的生物学功能,这与本研究中MAL2蛋白黄褐色阳性染色定位于细胞膜和细胞质结果一致。近年来发现,MAL2在乳腺癌及肺癌等恶性肿瘤中表达上调,通过激活胰岛素生长因子1受体等癌基因的表达,促进肿瘤的恶性进展[16-17]。WANG等[18]对胰腺癌中影响患者预后的RNA网络进行大数据进行分析发现,MAL2mRNA表达明显升高,这与本研究报道结果一致,但本研究进一步在蛋白水平证实胰腺癌中MAL2表达升高,提示MAL2表达可能参与胰腺癌的发生发展。BHANDARI等[19]研究发现,MAL2能够促进肿瘤细胞发生上皮间质转化,促进肿瘤细胞的侵袭和转移能力,导致肿瘤进展。本研究中,MAL2表达与肿瘤分期及淋巴结转移有关,提示MAL2表达升高参与促进胰腺癌肿瘤进展。FANG等[5]报道,MAL2的表达增加能够通过促进如MHC-Ⅰ复合物和肿瘤相关抗原等细胞表面蛋白抗原的内吞降解,抑制肿瘤浸润性CD8+T细胞的细胞毒性,导致肿瘤细胞发生免疫逃逸,促进肿瘤细胞的增殖。本研究中,MAL2 mRNA高表达的胰腺癌患者临床预后较差,是患者不良预后的危险因素,表明MAL2可能是新的胰腺癌预后的肿瘤标志物。本研究进一步分析MIB1与MAL2表达的相关性,结果两者表达呈显著正相关,提示两者在胰腺癌中可能存在相互作用。研究发现,胰腺癌肿瘤细胞中MAL2能够与IQGAP1结合后促进细胞外信号调节激酶ERK1/2的磷酸化,促进肿瘤进展[20],而胰腺癌中MIB1能促进IQGAP1的表达[12]。因此,胰腺癌中MIB1与MAL2可能是通过调控IQGAP1的表达,共同促进胰腺癌的肿瘤进展。但具体作用机制有待深入研究。
综上所述,胰腺癌中MIB1、MAL2 mRNA和蛋白表达均升高,两者表达与临床分期及淋巴结转移有关,是影响胰腺癌患者不良预后的独立危险因素。临床上可根据胰腺癌组织中MIB1、MAL2的表达情况,对患者的临床预后进行评估,并采取相应的治疗及随访方案,以改善患者的临床预后。但本研究由于样本量有限,并且未对两者的分子生物学机制进行深入探讨,有待今后扩大样本含量,尚需大样本及纳入更多因素的研究予以进一步验证。
