低分子量肝素对糖尿病肾病足细胞损伤的影响及机制
2023-08-09王淮淮赵学慧王会芳魏晓岩贾军利
王淮淮,赵学慧,王会芳,魏晓岩,贾军利
河北北方学院附属第二医院肾内科,河北张家口 075000
糖尿病肾病(DN)是1型糖尿病(T1DM)和2型糖尿病(T2DM)的常见并发症[1]。糖尿病由多种因素造成,包括高血糖水平、晚期糖基化终产物和肾素-血管紧张素-醛固酮系统(RAAS)的激活[2]。糖尿病早期会出现肾小球肥大、肾小球基底膜增厚、足细胞数量减少、系膜基质扩张和肾小管损伤,在晚期,肾脏会出现肾小球硬化和肾小管间质纤维化,严重时肾功能丧失[3]。目前糖尿病患者依然采用严格的血糖控制和降压降脂治疗,但不能完全阻止患者的肾病进展[4]。肝素类药物是应用广泛的一类抗凝类药物,包括未分级肝素及低分子量肝素(LMH)。LMH是由未分级肝素解聚而得[5],肝素具有多种药理活性,包括抗凝血抗血栓、抗炎、抗肿瘤、抗病毒、促进伤口愈合、预防和治疗贫血等[6]。目前LMH治疗DN的相关实验研究较少。2021年12月—2022年11月,本实验采用高浓度葡萄糖(HG)诱导人肾小球足细胞(HGPC)建立DN损伤模型,通过核转录因子-κB(NF-κB)信号通路变化探讨LMH对DN足细胞损伤的保护作用,以期了解DN中足细胞损伤机制。
1 材料与方法
1.1 材料 细胞株HGPC购自河南省工业微生物菌种工程技术研究中心。低分子量肝素钠(纯度≥99%)、D-葡萄糖、NF-κB通路抑制剂BAY11-7082(纯度≥98%)购自上海源叶生物科技有限公司;NF-κB通路激活剂Prostratin购自美国Sigma公司;胎牛血清(FBS)购自美国Gibco公司;无糖DMEM培养基购自武汉普诺赛生命科技有限公司;Hoechst 33258染色试剂盒购自江苏凯基生物技术股份有限公司;TNF-α、IL-6酶联免疫吸附(ELISA)试剂盒购自上海生工生物工程股份有限公司;细胞计数(CCK-8)试剂盒购自南京诺唯赞生物科技股份有限公司;RI‐PA裂解液、0.1 %结晶紫水溶液购自北京索莱宝科技有限公司;BCA蛋白试剂盒购自英国Abcam公司;鼠抗人肌动蛋白(β-actin)、NF-κBp65、磷酸化(p)-NF-κBp65、波形蛋白(Vimentin)、纤连蛋白(FN)、神经型钙黏蛋白(N-cadherin)、上皮型钙黏蛋白(E-cad‐herin)一抗、辣根过氧化物酶标记的山羊抗鼠二抗购自美国CST公司。NIKON Ti-s型倒置荧光显微镜购自东莞市昱和仪器设备有限公司,酶标仪购自美国Thermo公司,OI 1000型凝胶成像系统购自上海山科学仪器有限公司。
1.2 HGPC培养 HGPC细胞接种于含10 % FBS、5 mmol/L葡萄糖的DMEM完全培养基中,并置于37 ℃、5 % CO2培养箱中培养,待细胞贴壁达80 %以上时进行细胞传代,选取对数期细胞用于后续实验。在实验开始之前,用无血清、无糖DMEM培养液在培养箱中培养细胞24 h,使细胞完成同化。
1.3 细胞分组与给药 HGPC细胞同化后调整密度为2×105/mL,接种到合适细胞培养板中。将HGPC细胞分为对照(NC)组、HG组、1、5、10、15、20 μmol/L LMH组,NC组细胞以含5 mmol/L葡萄糖的培养基培养;HG组细胞以含30 mmol/L的葡萄糖培养基培养[7];1、5、10、15、20 μmol/L LMH组细胞以含30 mmol/L葡萄糖+不同浓度(1、5、10、15、20 μmol/L)LMH的培养基共同培养,筛选出最佳浓度LMH后,又将细胞分为NC组、HG组、LMH组、BAY11-7082组、LMH+BAY11-7082组、LMH+Pros‐tratin组。LMH组细胞以含30 mmol/L葡萄糖+15 μmol/L LMH的培养基共同培养;BAY11-7082组细胞以含30 mmol/L的葡萄糖+1 μmol/L BAY11-7082的培养基培养[8];LMH+BAY11-7082组细胞以含30 mmol/L葡萄糖+15 μmol/L LMH+1 μmol/L BAY11-7082的培养基培养;LMH+Prostratin组细胞以含30 mmol/L葡萄糖+15 μmol/L LMH+20 μmol/L Prostratin的培养基培养[9],实验重复3次并设3个复孔。
1.4 HG诱导的DN模型HGPC细胞活力检测 采用CCK-8法。将细胞以7×103细胞/孔的密度接种于96孔微孔板中。经HG诱导建立模型24 h后,给予不同浓度(1、5、10、15、20 μmol/L)的LMH处理24 h或48 h。显微镜下评估细胞的生长状态,之后使用CCK-8法检测细胞活力,每个孔中加入10 μL CCK-8溶液,在37 °C孵育1 h后,在450 nm波长下使用酶标仪测量光密度(OD)。
1.5 HG诱导的DN模型HGPC细胞凋亡率检测 采用Hoechst 33258染色法。给药LMH处理24 h后,用10 μL Hoechst 33258染色液在避光条件下染色10 min,固定后在荧光显微镜下(×20)观察并采集Hoechst 33258染色的细胞。细胞凋亡率(%)=(凋亡细胞数/总的细胞数)×100%。
1.6 HG诱导的DN模型HGPC细胞的侵袭能力检测 取各组处理24 h的细胞,用无血清培养基将细胞制成细胞悬液。Transwell小室预先用基质胶包被,将Transwell小室放入24孔板中,将200 μL(含5×104个细胞)细胞悬液加入Transwell上室,下室加入含有10% FBS的完全培养基,将整个Transwell-细胞体系转至细胞培养箱中继续培养24 h。之后,下室细胞用4%的甲醇固定30 min。之后0.1 %结晶紫染色10 min,将小室放在显微镜下(20×)观察拍照,并分析计算侵袭细胞数(个)。
1.7 HG诱导的DN模型HGPC细胞裂解液中肿瘤坏死因子(TNF)-α、IL-6检测 采用ELISA法。评估HG诱导下的HGPC细胞因子分泌水平,按照ELISA试剂盒说明书步骤检测HGPC细胞裂解液中TNF-α、IL-6。
1.8 HG诱导的DN模型HGPC细胞中NF-κBp65、p-NF-κBp65、Vimentin、FN、N-cadherin、E-cadherin表达检测 采用蛋白免疫印迹法。取各组干预24 h后的细胞,与RIPA裂解液共同孵育,并置冰上裂解,12 000 r/min离心20 min(离心半径8 cm),取上清液,其中蛋白质浓度通过BCA蛋白试剂盒来定量分析。按照20 μg/孔的蛋白量上样,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳电泳分离蛋白,一抗(稀释比例:NF-κBp65 1∶2 000、p-NF-κBp65 1∶1 000、Vimentin 1∶20 000、FN 1∶5 000、N-cadherin 1∶5 000、E-cadherin 1∶5 000、β-actin 1∶10 000)4 ℃孵育过夜、二抗(稀释比例为1∶2 000)室温孵育2 h,置于凝胶成像系统下显色拍照记录,之后使用Image J(Version 1.53c)软件分析蛋白条带的灰度值,以β-actin作为内参,目的蛋白的相对表达以目的蛋白与β-actin灰度值的比值表示,磷酸化蛋白的相对表达以磷酸化蛋白与非磷酸化蛋白的比值表示。
1.9 统计学方法 采用SPSS21.0统计软件。符合正态分布的计量资料以表示,多组间比较采用方差分析,两组间比较采用Dunnett′st检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度LMH对HG诱导DN模型HGPC细胞活力的影响 HG组相比NC组细胞活力下降(P<0.05),在LMH处理24 h或48后,与HG组相比,LMH在1~20 μmol/L时的细胞活力均高于HG组(P均<0.05),且在1~15 μmol/L范围内,HGPC细胞活力随LMH浓度的升高而升高,在浓度为20 μmol/L时相比15 μmol/L稍有下降,后续实验选用15 μmol/L作为LMH的最适剂量。见表1。
表1 各组细胞活力比较()
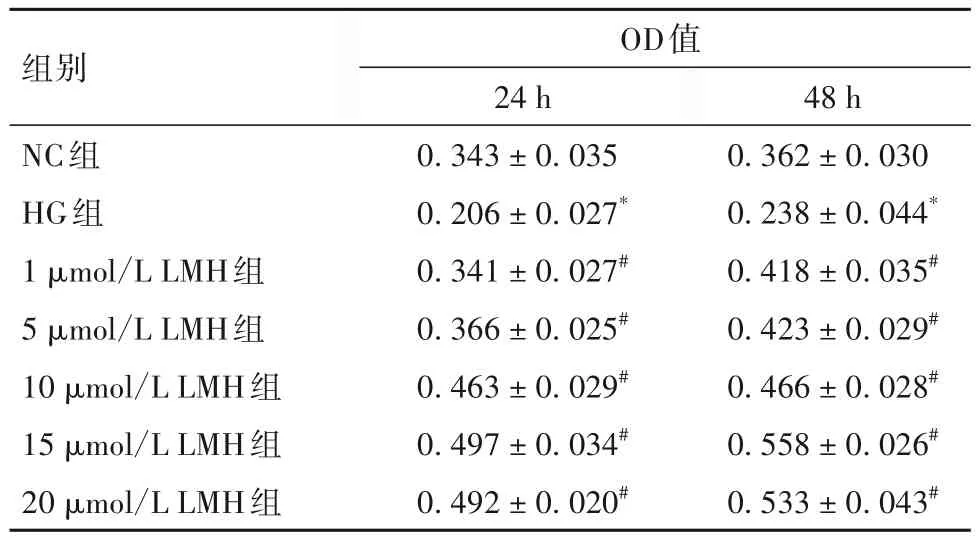
表1 各组细胞活力比较()
注:与NC组比较,*P<0.05;与HG组比较,#P<0.05。
组别NC组HG组1 μmol/L LMH组5 μmol/L LMH组10 μmol/L LMH组15 μmol/L LMH组20 μmol/L LMH组48 h 0.362 ± 0.030 0.238 ± 0.044*0.418 ± 0.035#0.423 ± 0.029#0.466 ± 0.028#0.558 ± 0.026#0.533 ± 0.043#OD值24 h 0.343 ± 0.035 0.206 ± 0.027*0.341 ± 0.027#0.366 ± 0.025#0.463 ± 0.029#0.497 ± 0.034#0.492 ± 0.020#
2.2 LMH和BAY11-7082、Prostratin对HG诱导的DN模型HGPC细胞凋亡的影响 药物处理24 h后,NC组、HG组、LMH组、BAY11-7082组、LMH+BAY11-7082组、LMH+Prostratin组细胞凋亡率分别为(6.380 ±0.840)%、(40.351 ± 2.090)%、(23.285 ± 2.635)%、(20.654 ± 2.299)%、(8.373 ± 2.664)%、(31.738 ±1.442)%,与NC组相比,HG组细胞凋亡率升高(P<0.05);与HG组相比,LMH组和BAY11-7082组细胞凋亡率下降(P均<0.05);与LMH组相比,LMH+BAY11-7082组细胞凋亡率下降(P<0.05),LMH+Prostratin组细胞凋亡率升高(P<0.05)。
2.3 LMH和BAY11-7082、Prostratin对HG诱导的DN模型HGPC细胞侵袭能力的影响 处理细胞24 h后,NC组、HG组、LMH组、BAY11-7082组、LMH+BAY11-7082组、LMH+Prostratin组侵袭细胞数分别为(73.333 ± 12.423)、(392.333 ± 37.099)、(178.333 ± 20.817)、(141.667 ± 17.098)、(99.333 ±5.132)、(310.667 ± 35.233)个/HP,HG组和NC组相比侵袭细胞数上升(P<0.05);与HG组相比,LMH组和BAY11-7082组侵袭细胞数少(P均<0.05);与LMH组相比,LMH+BAY11-7082组侵袭细胞数少(P<0.05),LMH+Prostratin组侵袭细胞数多(P<0.05)。
2.4 各组HGPC细胞裂解液中TNF-α、IL-6分泌水平比较 与NC组相比,HG组TNF-α、IL-6水平升高(P均<0.05);与HG组相比,LMH组和BAY11-7082组TNF-α、IL-6水平下降(P均<0.05);与LMH组相比,LMH+BAY11-7082组TNF-α、IL-6水平下降(P均<0.05),LMH+Prostratin组TNF-α、IL-6水平升高(P均<0.05)。见表2。
表2 各组HGPC细胞裂解液中TNF-α、IL-6水平比较(pg/mL,)
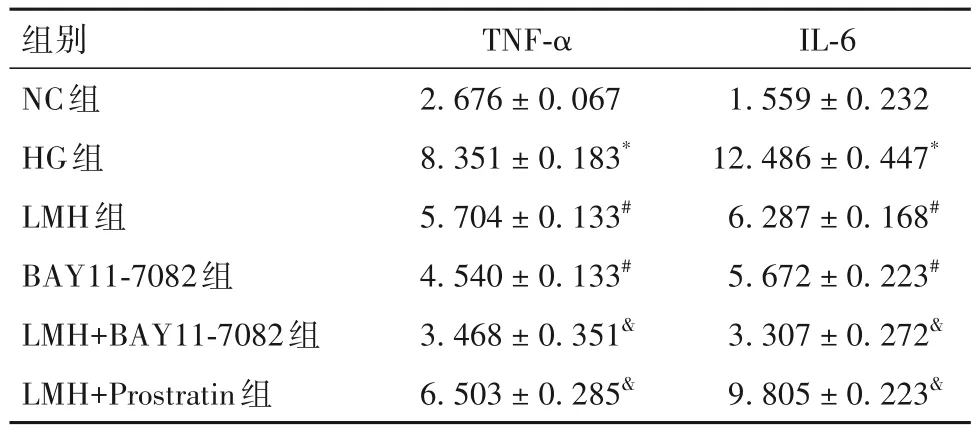
表2 各组HGPC细胞裂解液中TNF-α、IL-6水平比较(pg/mL,)
注:与NC组相比,*P<0.05;与HG组相比,#P<0.05;与LMH组相比,&P<0.05。
IL-6 1.559 ± 0.232 12.486 ± 0.447*6.287 ± 0.168#5.672 ± 0.223#3.307 ± 0.272&9.805 ± 0.223&组别NC组HG组LMH组BAY11-7082组LMH+BAY11-7082组LMH+Prostratin组TNF-α 2.676 ± 0.067 8.351 ± 0.183*5.704 ± 0.133#4.540 ± 0.133#3.468 ± 0.351&6.503 ± 0.285&
2.5 各组HGPC细胞中NF-κB通路相关蛋白p-NF-κBp65表达比较 NC组、HG组、LMH组、BAY11-7082组、LMH+BAY11-7082组、LMH+Prostratin组p-NF-κBp65相对表达量分别为1.295 ± 0.120、1.922 ± 0.034、1.229 ± 0.080、1.099 ± 0.062、0.449 ± 0.006、1.839 ± 0.028。与NC组相比,HG组细胞中p-NF-κBp65表达升高(P<0.05);与HG组相比,LMH组和BAY11-7082组细胞中p-NF-κBp65表达下降(P均<0.05);与LMH组相比,LMH+BAY11-7082组细胞中p-NF-κBp65表达下降(P<0.05),LMH+Prostratin组细胞中p-NF-κBp65表达升高(P<0.05)。
2.6 各组HGPC细胞中Vimentin、FN、N-cadherin、E-cadherin蛋白表达比较 见表3。
表3 各组HGPC细胞中Vimentin、FN、N-cadherin、E-cadherin蛋白表达比较()

表3 各组HGPC细胞中Vimentin、FN、N-cadherin、E-cadherin蛋白表达比较()
注:与NC组相比,*P<0.05;与HG组相比,#P<0.05;与LMH组相比,&P<0.05。
组别NC组HG组LMH组BAY11-7082组LMH+BAY11-7082组LMH+Prostratin组E-cadherin蛋白1.065 ± 0.017 0.553 ± 0.008*0.871 ± 0.009#0.841 ± 0.019#1.166 ± 0.003&0.531 ± 0.008&Vimentin蛋白0.428 ± 0.024 0.870 ± 0.075*0.578 ± 0.028#0.506 ± 0.028#0.192 ± 0.004&0.812 ± 0.019&FN蛋白0.515 ± 0.021 0.777 ± 0.006*0.544 ± 0.025#0.524 ± 0.012#0.302 ± 0.005&0.741 ± 0.021&N-cadherin蛋白0.621 ± 0.021 0.935 ± 0.037*0.580 ± 0.041#0.479 ± 0.040#0.266 ± 0.020&0.881 ± 0.015&
3 讨论
DN是糖尿病患者死亡的主要危险因素,是终末期肾病肾衰竭的主要原因[10]。随着DN发展,肾小球受损数量增加,肾小球滤过能力降低。研究表明,DN发生、发展与足细胞损伤相关[11]。足细胞是一种独特的、高度分化的肾小球上皮细胞,与内皮细胞和基底膜一起形成肾小球滤过屏障,维持肾脏正常功能。DN足细胞损伤后其形态学发生较大改变,包括足细胞肥大、足细胞上皮间质转化(EMT)和足细胞凋亡[12]。
高血糖、氧化应激和RAAS系统激活是造成DN损伤的主要致病因素,但现有大量证据表明,炎症在糖尿病发生、进展中起关键作用[13],且调节炎症反应已成为治疗DN的一种潜在方案[14]。研究发现,TNF-α主要由活化的单核/巨噬细胞产生,促进细胞增殖和分化,是重要的炎症因子[15],且与糖尿病患者的蛋白尿发生密切相关,表明TNF-α是糖尿病神经病变的潜在预后生物标志物[16]。IL-6是一种细胞因子,在炎症病理学中起关键作用。研究发现,DN患者尿液中IL-6水平升高[17],而阻断IL-6受体后,通过减少炎症和氧化应激,减弱了糖尿病大鼠的组织病理学改变[18]。NF-κB参与细胞对外界刺激的响应,在细胞的炎症反应、免疫应答等过程中发挥关键作用。研究表明,抑制NF-κB活性可改善小鼠白蛋白尿、肾小球损伤和血糖水平[19],并降低肾脏促炎细胞因子水平和氧化应激[20]。本研究发现,LMH可抑制HG诱导的DN模型HGPC细胞凋亡,抑制炎症因子TNF-α和IL-6分泌,抑制NF-κBp65的活化,但并不影响NF-κBp65表达。
EMT是一个可逆过程,其中上皮细胞失去其特性并成为间充质细胞,细胞黏附分子和细胞骨架的表达发生改变。结果,细胞发展运动侵入性,允许它们以高度动态和可塑的方式在上皮和间充质状态之间过渡[21]。EMT是促进细胞迁移和侵袭的因素。足细胞EMT被认为在DN发展中起重要作用,足细胞EMT的靶向抑制可能为DN提供了一种新的治疗方法。本研究发现,LMH可上调HG诱导的DN模型HGPC细胞E-cadherin蛋白表达,抑制Vimentin、FN、N-cadherin蛋白表达,抑制HGPC细胞的侵袭能力。
综上所述,LMH可对HG诱导的DN模型HGPC细胞损伤产生一定保护作用,其机制可能是抑制NF-κB通路的活性和EMT进程。
