骨髓间充质干细胞移植对蛛网膜下腔出血大鼠早期脑损伤的治疗作用及机制
2023-08-09丁盈月刘俊杰谷晨昕王一超张秋华刘少鹏王亮李建民
丁盈月,刘俊杰,2,谷晨昕,王一超,张秋华,刘少鹏,王亮,李建民,2
1 华北理工大学临床医学院,河北唐山 063000;2 华北理工大学附属医院神经外科;3 华北理工大学公共卫生学院;4 唐山南湖医院重症医学科
蛛网膜下腔出血(SAH)是指各种原因的颅内出血,血液流入蛛网膜下腔,进而引起剧烈头疼等症状的临床急症。SAH可分为自发性和创伤性两类[1]。早期脑损伤(EBI)是指SAH后72 h内出现的脑部损伤,其主要表现为氧化应激、血脑屏障破坏、神经元死亡以及脑水肿等[2]。铁死亡为非凋亡形式的调节性细胞死亡,谷胱甘肽过氧化物酶(GPX)活性减弱、铁蓄积、脂质过氧化、谷胱甘肽(GSH)耗竭是其主要特征[3-4]。NADPH氧化酶2(NOX2)/活性氧(ROS)信号通路在铁死亡中占重要地位。NOX2是ROS生成的重要来源,ROS水平升高,炎症小体被激活,进而导致神经炎症和神经损伤。脂质类ROS积累在铁死亡中起重要作用[5]。SAH中NOX2/ROS信号通路的激活,是其发生神经炎症、氧化应激、神经凋亡以及铁死亡等的一个重要机制。骨髓间充质干细胞(BMSC)具有干细胞特性,在神经损伤中有修复作用,缓解SAH后EBI的神经行为障碍和炎症反应[6];来自BMSC的外泌体(Exo)可通过miRNA129-5p-HMGB1途径缓解SAH后EBI[7];BMSC可保护SAH的血脑屏障[8]。2022年6月—2023年1月,本研究探讨BMSC移植是否通过调节NOX2/ROS通路来调控铁死亡,进而对SAH大鼠EBI发挥治疗作用。
1 材料与方法
1.1 动物、试剂及仪器 健康雄性SD大鼠48只,8周龄,体质量280~320 g,购自北京维通利华实验动物技术有限公司。许可证号:SYXK(京)2017-0002。普通饲料饲养,环境温度22~25 ℃,环境湿度45%~60%,每天光照12 h、黑暗12 h,自由摄食和饮水。在华北理工大学动物实验中心适应性喂养7 d。本研究获得华北理工大学动物保护与福利委员会的批准。SDS-PAGE(北京博奥森生物技术有限公司),BCA蛋白测定试剂盒(上海碧云天生物技术有限公司),ECL显色试剂盒(北京博奥森生物技术有限公司),普鲁士蓝染色试剂盒、组织铁检测试剂盒、丙二醛(MDA)检测试剂盒、谷胱甘肽含量检测试剂盒(北京索莱宝科技有限公司),ROS检测DCFH-DA探针(上海碧云天生物技术有限公司),鼠抗β-actin单克隆抗体(美国SANTA CRUZ公司),兔抗NOX2抗体(美国Proteintech公司)。BX53型显微镜(日本Olympus公司),LeicaRM2245型切片机(德国Leica公司)。ZMN-7803冷冻台(常州华利电子公司),5417R冷冻离心机(德国Eppendorf公司),凝胶成像分析系统(美国Bio-Rad公司)多功能酶标仪(BioTek Synergy 2,Gene Company Limited)。
1.2 动物分组及模型制备 将大鼠随机分为假手术组、蛛网膜下腔出血(SAH)组、BMSC组、VitE组,每组10只,当组内大鼠意外死亡时及时补足。参考SUZUKI等[9]造模方法,采用血管内穿刺法,构建SAH模型。经腹腔注射戊巴比妥(50 mg/kg)麻醉,颈部切口,结扎颈外动脉远端后切断,于颈外动脉处做“V”形切口,将锐化3-0单丝尼龙线导入,有阻力感时继续进线,当颈内动脉分叉处被刺穿时感受到落空感,认为穿刺成功,导致SAH。假手术组大鼠仅进行血管穿刺,但不刺破血管。SAH造模成功后可见蛛网膜下腔、脑基底、Willis环周围有出血及血凝块,HE染色可见蛛网膜下腔有大量红细胞沉积。
1.3 BMSC分离、培养和鉴定 参考刘文超[10]方法,分离、培养和鉴定BMSC。
1.4 BMSC移植 参考刘文超[10]方法,从第三、四代的原代BMSC中取样,除去培养基,用PBS冲洗3次,离心,去上清液,通过细胞计数板测量细胞浓度。造模后24 h,将第4代BMSC 3×106个重悬于0.6 mL PBS中,经股静脉注入BMSC组;假手术组、SAH组、VitE组经股静脉注入等量PBS。VitE组给予维生素E(100 mg/kg)灌胃,其他组给予等量橄榄油灌胃。
1.5 神经功能评估 造模后48 h,参照改良Garcia评分评估大鼠的神经功能,内容包括体态均匀性、自主运动性能、前肢伸直活动、抓持和攀登铁笼性能、两侧胡须碰触反应速度以及肢体触觉反应。3~18分,分值越高说明神经功能受损程度越轻[11]。
1.6 脑组织含水量测定 造模后48 h,测定大鼠脑水肿程度。用10%水合氯醛经腹腔注射麻醉,切开大脑,测量脑组织湿重;将脑组织置于75 ℃环境下连续烘烤24 h,冷却,测量脑组织干重。脑组织含水量=(湿重-干重)/湿重×100%。
1.7 脑组织病理变化观察 造模后48 h,据HE染色试剂盒操作步骤,配制4% POM溶剂、梯度乙醇溶剂、二甲苯和乙醇混合液、1%盐酸乙醇分离液;通过固化4% POM、脱水用梯度乙醇溶剂、透化用二甲苯、浸蜡包埋脑组织制作切片;脱蜡、透明、复水,用苏木精和伊红对切片染色。最后,脱水、密封和透明。在正置光学显微镜(400倍)下观察脑组织病理变化。运用Image-Pro Plus 6.0图像软件统计高倍视野下病理损伤的细胞作为坏死神经细胞数,每只大鼠随机选取5个视野拍照,取均值。坏死标准:细胞排列紊乱、大小与形态不一,部分细胞萎缩、核固缩。
1.8 铁死亡相关指标检测
1.8.1 脑组织铁沉积情况检测 用普鲁士蓝染色(铁染色)法。造模后48 h,用石蜡包埋法,用切片机对脑组织进行切割,常规脱蜡,放入Perls stain中浸泡30 min;染色后,用蒸馏水冲洗染色剂;继续浸入装有新鲜核固红染色液的容器中。使用Image-Pro Plus 6.0图像软件计算铁沉积的数量,即铁沉积像素的面积与观察区域的面积之比。
1.8.2 脑组织铁含量测定 用吸光光度法。造模后48 h,取约100 mg大鼠脑组织,加入生理盐水和组织的比例为1∶9。冰上手动匀浆,4 ℃下12 000 r/min离心10 min(离心半径6 cm)。将混合物均匀混合,沸水浴,在自来水中加入200 μL氯仿,搅拌平衡,室温下10 000 r/min离心10 min(离心半径6 cm),提取上清液800 μL,用酶标仪测量波长520 nm处的光密度,按说明书计算铁含量。
1.8.3 脑组织MDA、GSH检测 用吸光光度法。造模后48 h,按1.8.2所述将脑组织样品打成匀浆。加入样品并混匀,盖子紧闭;沸水浴60 min,冷却,离心10 min,分别滴上清液至干净的比色皿,按试剂盒操作用酶标仪测量不同波长(450、532、600 nm)的吸光度值,计算MDA含量。称取约100 mg脑组织,按试剂盒操作说明,冰上匀浆;4 ℃下8 000 r/min离心10 min(离心半径6 cm),收集上清液,计算GSH含量。
1.9 NOX2/ROS信号通路指标检测
1.9.1 脑组织NOX2蛋白检测 采用Western blot‐ting法。造模后48 h,将脑组织制成匀浆,加入蛋白分解液,离心后吸收上清液,提取总蛋白,测定蛋白浓度。样品SDS-PAGE,电泳结束后转膜,封闭,加入兔抗NOX2多克隆抗体稀释(1∶1 000),4 ℃洗膜3次,用辣根过氧化物酶标记的二抗稀释(1∶2 000),室温下孵育,TBST洗膜。Supersignal发光试剂盒检测蛋白条带灰度值,Quantity One软件分析实验结果。β-actin为内参照,目的蛋白相对表达量=目标蛋白灰度值/β-actin灰度值。
1.9.2 脑组织ROS检测 用ROS探针法。造模后48 h,取大脑组织匀浆后制备的细胞悬液,取上清液用作ROS的分析,按照说明书装载DCFH-DA探针,采用细胞ROS探针进行检测。
1.10 统计学方法 采用SPSS23.0统计软件。符合正态分布且方差齐的计量资料用表示,多组间比较用方差分析,组间两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能比较 假手术组、SAH组、BMSC组、VitE组改良Garcia评分分别为(16.1 ± 1.8)、(8.1 ± 0.9)、(13.7 ± 1.2)、(12.8 ± 1.2)分。与假手术组比较,SAH组改良Garcia评分低(P<0.05);与SAH组比较,BMSC组、VitE组改良Garcia评分高(P均<0.05);BMSC组、VitE组改良Garcia评分比较差异无统计学意义(P>0.05)。
2.2 各组脑组织含水量比较 假手术组、SAH组、BMSC组、VitE组脑组织含水量分别为0.776 ±0.011、0.816 ± 0.007、0.792 ± 0.007、0.812 ±0.006。与假手术组比较,SAH组脑组织含水量高(P<0.05);与SAH组、VitE组比较,BMSC组脑组织含水量低(P均<0.05)。
2.3 各组脑组织病理变化比较 细胞损伤情况:假手术组神经细胞形态规则,均匀;SAH组神经细胞排列紊乱,细胞核破碎;与SAH组比较,BMSC组神经细胞损伤情况明显改善;VitE组神经细胞损伤修复情况比BMSC组弱。细胞坏死:假手术组、SAH组、BMSC组、VitE组脑组织神经细胞坏死数分别为(1.62 ± 0.22)、(45.26 ± 3.79)、(29.47 ± 1.53)、(39.38 ± 1.71)个。与假手术组比较,SAH组神经细胞坏死数量多(P<0.05);与SAH组、VitE组比较,BMSC组神经细胞坏死数量少(P均<0.05)。
2.4 各组脑组织细胞铁死亡相关指标比较 与假手术组比较,SAH组脑组织中铁沉积量、铁含量、MDA含量高(P均<0.05),GSH含量低(P<0.05);与SAH组、VitE组比较,BMSC组脑组织中铁沉积量、铁含量、MDA含量低(P均<0.05),GSH含量高(P均<0.05)。见表1。
表1 各组脑组织中铁沉积量、铁含量、MDA含量、GSH含量比较()

表1 各组脑组织中铁沉积量、铁含量、MDA含量、GSH含量比较()
注:与假手术组比较,*P<0.05;与SAH组比较,#P<0.05;与BMSC组比较,&P<0.05。
组别假手术组SAH组BMSC组VitE组GSH含量(mg/g)45.95 ± 0.45 22.99 ± 3.59*32.66 ± 1.44#21.86 ± 1.62&n 10 10 10 10铁沉积量(%)0.012 ± 0.009 0.319 ± 0.028*0.164 ± 0.019#0.209 ± 0.019&铁含量(μg/g)38.010 ± 0.266 107.050 ± 0.539*64.720 ± 0.498#79.470 ± 0.347&MDA含量(nmol/mg)5.85 ± 0.191 9.35 ± 0.238*7.32 ± 0.140#8.12 ± 0.154&
2.5 各组脑组织中NOX2蛋白、ROS水平比较 与假手术组比较,SAH组脑组织中NOX2蛋白表达、ROS水平高(P均<0.05);与SAH组、VitE组比较,BMSC组脑组织中NOX2蛋白表达、ROS水平低(P均<0.05)。见表2。
表2 各组脑组织中NOX2蛋白、ROS水平比较()
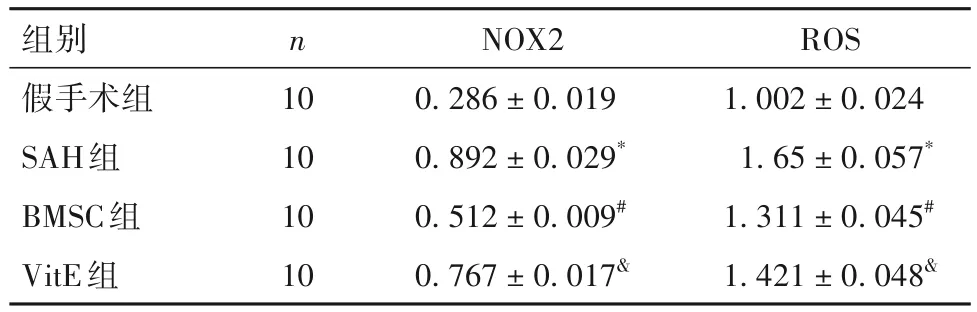
表2 各组脑组织中NOX2蛋白、ROS水平比较()
注:与假手术组比较,*P<0.05;与SAH组比较,#P<0.05;与BM‐SC组比较,&P<0.05。
ROS 1.002 ± 0.024 1.65 ± 0.057*1.311 ± 0.045#1.421 ± 0.048&组别假手术组SAH组BMSC组VitE组n 10 10 10 10 NOX2 0.286 ± 0.019 0.892 ± 0.029*0.512 ± 0.009#0.767 ± 0.017&
3 讨论
SAH是一种威胁生命的脑血管疾病[12]。EBI是一种脑损伤,通常在SAH后72 h内出现,表现为脑血流量减少及颅内压升高,导致局部脑缺血[13]。EBI被认为是迟发性脑血管痉挛和微循环障碍的先兆[14]。血脑屏障受损、血氧反应、脑水肿、神经系统炎症和退行性变等均与EBI有关,对EBI进行及早干预可增强治疗效果,改善预后[15-16]。因此,明确该阶段病理分子机制,减轻SAH后EBI的神经功能障碍尤为重要。
BMSC是一组具有生物学特性、多向分化潜能和自我复制的成体干细胞[17]。在动物实验中,静脉内移植BMSC可改善SAH动物的神经功能,相关机制可能与减少神经元凋亡、减轻炎症和改善脑组织微观结构有关[7]。本研究发现,在SAH后72 h,大鼠神经功能损害,BMSC移植可减轻其神经功能障碍,进而起到神经修复作用。然而,BMSC的具体靶点及其所涉及的机制有待进一步研究。SAH后24 h,大鼠出现明显的神经功能损害,脑水肿程度明显升高说明急性脑损伤程度明显加重,与假手术组比较,差异有统计学意义。观察脑组织病理切片,形态学显示神经元细胞排列杂乱,形态不规则,胞核收缩、破裂、溶解,坏死严重,与假手术组比较,差异有统计学意义。
本研究中,SAH后72 h,SAH组脑组织中铁含量显著升高。这是因为细胞膜上的不饱和脂肪酸被过量的铁和脂氧合酶激活,从而促进其生成和分解。后者发生脂质过氧化,生成大量ROS分子(羟自由基等),进而破坏生物大分子结构,最终导致细胞死亡。铁死亡为程序性细胞死亡,与其他死亡形式的发生机制大相径庭。铁死亡广泛参与病理过程,如心肌变性、神经退行性变等[18]。近期研究表明,SAH后EBI中神经细胞铁代谢紊乱[19]、线粒体衰竭[20]、活性氧蓄积[21]等重要环节与铁死亡联系密切。研究发现,当细胞内抗氧化剂GSH消耗和GPX4表达下降时,就会发生铁死亡。GPX4在清除ROS方面起重要作用,但由于铁的过量沉积,ROS会出现异常聚集[22]。过多的ROS会造成氧化损伤和加速衰老等。对铁死亡过程实施干预可以减缓病情发展,并且相应地改善临床症状。本研究检测了铁死亡相关指标,发现SAH后72 h大鼠脑组织中铁沉积量、MDA含量增加及GSH含量明显下降。上述结果表明,SAH后72 h,大鼠脑组织细胞发生了铁死亡,即提示SAH后EBI病理过程中有铁死亡的发生。研究表明,SAH大鼠大脑皮质在24 h后出现铁死亡[23]。基于BMSC移植对大鼠SAH后EBI期间神经功能障碍的减轻和修复作用以及SAH后EBI与铁死亡的密切关系,我们猜测BMSC移植可能对SAH后EBI中发生的铁死亡有改善作用。本研究结果表明,BMSC移植可显著改善大鼠SAH后EBI期间脑组织中的铁沉积,减少神经元受损、脑组织中的铁含量、MDA含量,增加脑组织中GSH含量、减轻大鼠SAH后EBI期间铁死亡的发生。
NOX2/ROS信号通路是铁死亡的关键调控通路,目前认为EBI的重要机制之一即为ROS诱导的神经元凋亡[24]。本研究中,SAH组NOX2蛋白表达与ROS水平较假手术组显著升高,而BMSC组大鼠NOX2蛋白表达与ROS水平较SAH组显著降低;结合铁沉积情况,铁含量、MDA含量和GSH含量的结果,进一步提示EBI过程中发生了细胞铁死亡。且提示BMSC移植能在SAH后抑制NOX2/ROS信号通路激活。造模后使用已知阳性药物VitE,对比发现BMSC移植的神经保护作用强于VitE。
综上所述,BMSC移植可能通过调控NOX2/ROS信号通路抑制铁死亡的发生,从而发挥其对SAH大鼠EBI的治疗作用。但BMSC移植能否通过其他机制发挥作用,有待进一步探索。
