金属的腐蚀与防护系列实验改进
2023-08-09李梦倩谢美珊王怀文郭炜杰李林燊
李梦倩 谢美珊 王怀文 郭炜杰 李林燊
摘要:2019年版人教版选择性必修1“金属的腐蚀与防护”章节新增了牺牲阳极法实验,为提升该实验的教学功能,将其改进为“金属的腐蚀与防护”系列微型实验,探究不同条件下铁的电化学腐蚀速率大小关系。改进后的实验不仅保留了教材实验趣味性强的优点,还补充了外加电流法的实验,操作简单,装置微型化,现象明显,大大缩短了实验所需的时间,便于设计为学生分组实验。
关键词:金属的防护与腐蚀;实验改进;牺牲阳极法;外加电流法
文章编号:1008-0546(2023)12-0091-04 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2023.12.0020
一、问题的提出
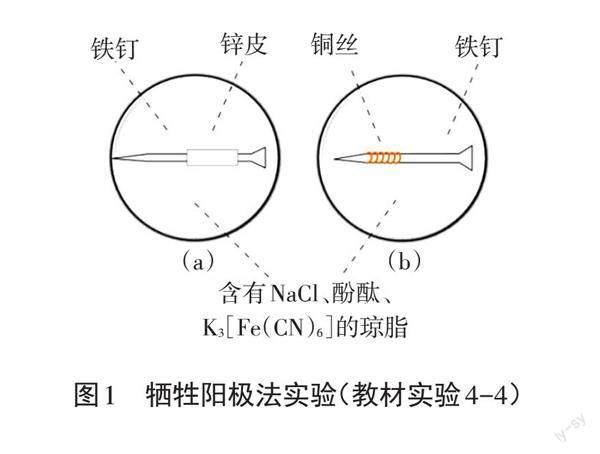
《普通高中化学课程标准(2017年版2020年修订)》明确提出,“能利用电化学原理解释金属腐蚀现象,选择并设计防腐措施”的学业要求,[1]因此在2019年版人教版选择性必修1的教材中,在“金属的腐蚀与防护”章节中新增了一个牺牲阳极法的趣味实验,使得金属的腐蚀过程更加可视化,即在培养皿中倒入食盐琼脂溶液,滴入5~6滴酚酞溶液和 K3[Fe(CN)6]溶液,将裹有锌皮和缠有铜丝的铁钉分别放入培养皿中,如图1所示,一段时间后,(a)中的铁钉附近琼脂出现红色,锌皮附近无明显现象,(b)中的铁钉附近琼脂出现蓝色,铜丝附近琼脂出现红色。
按照教材指引完成实验后,发现以下两点有待改进:
1.产生实验现象较慢
教材中未对K3[Fe(CN)6]的浓度进行说明,若选择饱和的K3[Fe(CN)6]溶液,按照教材指引完成实验时,发现出现教材实验拍摄图的现象大概需要4 h,不适合在课堂上开展学生分组实验,且实验使用的是直径10 cm 的培养皿,若开展分组学生实验,实验药品消耗量较大。
2. Fe2+可能会与K3[Fe(CN)6]反应
若按照教材的指引配制食盐琼脂,即使是使用6滴饱和的 K3[Fe(CN)6]溶液,也需要较长的时间才能明显看到琼脂呈蓝色。但是若选择滴加更多的 K3[Fe(CN)6]溶液,又会加速 K3[Fe(CN)6]与铁的反应,K3[Fe(CN)6]会将铁氧化成 Fe2+,[2]而 Fe2+会与 K3[Fe(CN)6]继续反应生成蓝色的沉淀,對负极产物Fe2+的检验造成干扰。
二、文献追踪
对比新旧教材的实验,可以发现新教材新增的“牺牲阳极法实验”进步之处可概括为以下三点:第一,补充了铁与较不活泼金属构成原电池时,铁充当负极被腐蚀的实验;第二,采用铁钉、锌皮、铜丝,装置简单,现象美观,有一定的趣味性;第三,将 NaCl、酚酞、K3[Fe(CN)6]与琼脂混合,减小了Fe2+的扩散程度,缩短了蓝色沉淀产生的时间。
以“金属的防护与腐蚀”“实验改进”“牺牲阳极法”等为关键词,在知网上搜索到相关文献有22篇。由于该实验是新教材新增的实验,而大部分文献研究的是旧教材中已有的吸氧腐蚀(铁与碳粉混合)实验,以及锌片与铁片构成原电池的实验,只有少数文献有一定的参考价值。
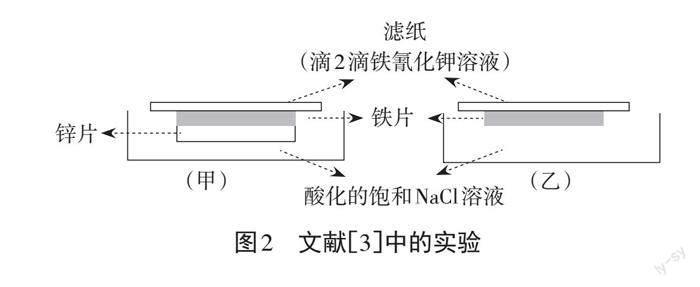
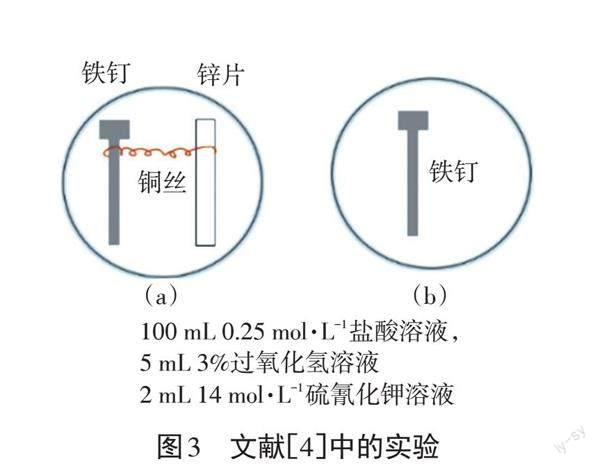
比如,郑晓红的实验中,[3]设置了空白铁钉组作为锌铁原电池组的对照,如图2所示,在酸化的饱和NaCl溶液中,1 min 内铁片腐蚀便会使滴有K3[Fe(CN)6]溶液的滤纸呈现蓝色,而在锌片的保护下,铁片上的滤纸无蓝色出现。该实验中滤纸的使用能使 Fe2+更为集中,现象更明显。由于在溶液中进行实验,Fe2+的扩散会使得蓝色不明显或出现得较慢,于是,也有较多的文献采用了U型管、小套管等措施来减慢Fe2+的扩散,但都出现了K3[Fe(CN)6]与铁电极直接接触的问题。清华附中的朱式玉的实验中除了使用铁与锌两种金属作电极,[4]还增设了铁与铜两种金属的对比实验组,如图3所示,将铁钉与锌片用铜线相连放入有盐酸、H2O2、 KSCN 的混合溶液中,通过铜丝的剪断与否,体现铁钉作阴极被保护,作阳极被腐蚀的效果。但上述文献中的实验都是在酸化的溶液中进行,铁的化学腐蚀不容忽略,而实验的目的是研究不同条件下的铁的电化学腐蚀速率。史文杰为了使现象出现的时间更短,[5]在新教材的基础上,将铜丝缠绕铁钉改为铁钉镀铜,然后浸泡在 NaCl、酚酞、K3[Fe(CN)6]的热琼脂溶液,可较快观察到明显现象。相比于缠绕铜丝,电镀法可使得铜覆盖得更为致密,但是“热溶液”的形式不便在课堂开展小组实验。
三、实验设计
1.实验用品
琼脂粉、饱和NaCl溶液、酚酞、K3[Fe(CN)6]溶液、蒸馏水、6孔井穴板、6根铁丝、铜丝、铜片、锡丝、锌皮、9 V 电池。
2.实验装置图(见图4)
3.实验步骤
(1)实验准备
称取1g 琼脂粉,与150 mL 蒸馏水和50 mL 饱和 NaCl溶液煮沸,然后加入10滴酚酞溶液(酚酞溶液浓度可适当大一点,便于现象明显),注入6孔井穴板中,待其凝固。
准备1根铁丝,将一端缠绕在铜丝上,另一端螺旋旋转10圈左右,可增大电极与电解质溶液的接触面积,如图4中组①所示。其他5根铁丝(其中一端也缠绕10圈,保证反应时铁丝与琼脂的接触面积相同)分别做以下处理:缠绕在锡丝上、缠绕在锌皮上、连接电源正极、连接电源负极、不做处理。
(2)发生反应,检验电极产物
将铁丝与铜丝缠绕组、铁丝与锡丝缠绕组、铁丝(空白组)、铁丝与锌皮缠绕组、铁丝与铜片外加电源(铁作阴极)组、铁丝与铜片外加电源(铁作阳极)组依次插入到6组琼脂中,如图4中组①~⑥所示,电池选用9 V 电池。1~2 min后,取出金属,在铁附近的琼脂处滴1滴0.25 mol ·L-1的K3[Fe(CN)6]溶液,观察现象。
4.实验结果
6组实验的现象及分析如表1所示。原电池组(①、②、③、④)1~2 min 即可观察到现象,外加电源的⑤和⑥组10 s 即可观察到明显现象。从图5可以观察到,①、②、③、⑥组中铁电极附近均出现蓝色,且由深至浅为:⑥>①>②>③ , 铁电极附近红色由深至浅为⑤>④>③ , 可以证明腐蚀速率的大小为:电解池的阳极>原电池的负极>吸氧腐蚀>原电池的正极>电解池的阴极,且构成原电池的正负极活泼性之差越大,负极腐蚀速率越快。
5.其他现象说明
学生发现,空白铁丝组(组③)会同时出现红色和蓝色,若将铁丝插入较深,还可观察到红色主要集中于琼脂表面处,蓝色集中于琼脂深处。此现象可解释为铁在该情况中发生了吸氧腐蚀,在琼脂表面处氧气浓度大,发生反应:O2+4e-+2H2O=4OH-,琼脂深处氧气含量相对较少,铁丝发生反应:Fe=Fe2++2e-,因此蓝色沉淀主要在琼脂深处,而这其实也就是金属构件在海水中会发生的氧浓差腐蚀。海水表面氧浓度高于深处,所以金属上部的腐蚀电位要高于下部,产生了电位差,从而引起电子的传输,导致金属产生腐蚀。[6]
四、改进后实验的创新
1.实验更微型
使用孔径为2 cm 或3 cm 的井穴板代替10 cm 直径的生物培养皿,大大减少了琼脂的用量和实验准备的工作量,也可同时进行多组对比实验,也便于学生开展小组实验。
2.实验现象明显且快速
改进后的实验可以在2 min 内就看到较为明显的现象,借助特征试剂的显色深浅及范圍,学生可以亲眼见证金属的腐蚀过程并比较速率快慢。
3. Fe2+的检验方式更科学
由于铁钉可能与K3[Fe(CN)6]溶液发生反应,因此在配制琼脂溶液时,不加入 K3[Fe(CN)6]溶液,当铁钉放入琼脂反应一段时间后,取出铁钉再局部滴加 K3[Fe(CN)6]溶液,这样可以避免了铁与K3[Fe(CN)6]直接接触,使得 Fe2+的检验方式更严谨。
4.开发成系列实验
改进后的实验是在教材“牺牲阳极法”实验的基础上,加入了“外加电流法”实验,与牺牲阳极法、化学腐蚀(以及吸氧腐蚀)构成电化学系列实验。另外,在开展课堂教学时,教师也可以根据课堂的需要,利用改进后的装置继续探究外加电流时电压的大小、阴阳极材料的选择等因素对金属腐蚀速率的影响,实验的可开发空间大。
五、结语
在课堂的最后,通过电化学腐蚀速率比较的典型例题(如图6)进行即时巩固,学生答题效果非常理想,说明通过实验探究,学生已经成功构建了金属腐蚀与防护的思维模型。在课后的访谈中,学生表示“现象非常好看”“原来外加电源腐蚀速率快这么多”,说明学生们通过亲手实验,体会到了化学之精髓。
本实验在教材的基础上,进一步实现了实验微型化,做到了现象快且对比明显,不仅便于教师的演示,也有助于课堂分组实验的开展,培养学生宏观辨识与微观探析等化学核心素养。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020.
[2]房寿高.铁氰化钾溶液与铁反应的实验探究[J].化学教学,2014(10):59-61.
[3]郑晓红.金属的腐蚀与防护实验设计[J].化学教育(中英文),2015,36(3):69-72.
[4]朱式玉.金属防腐蚀的实验——牺牲阳极的阴极保护法[J].教学仪器与实验,1986(1):21-24.
[5]史文杰,李冉,郭玉林,田巧云.提升化学学科核心素养的高中化学教学——以“金属的防护”为例[J].化学教育(中英文),2022,43(5):34-39.
[6]刘英伟,张洋.海水管路氧浓差腐蚀数值分析[J].天津大学学报(自然科学与工程技术版),2020,53(10):1019-1027.
