牛支原体灭活疫苗免疫小鼠最小免疫剂量及抗体消长规律研究
2023-08-08王超丽任静静杨铭伟
王超丽,吴 洁,任静静,万 姣,杨铭伟
1 石河子兽医协会,新疆石河子 832000
2 第八师畜牧兽医工作站,新疆石河子 832000
3 石河子大学动物科技学院,新疆石河子 832000
0 引言
牛支原体(Mycoplasma Bovis)是引起犊牛肺炎、关节炎和成年牛乳房炎的主要病原体之一。1961年,牛支原体被鉴定为致乳腺炎的病原体,1976年首次被描述为引起呼吸道疾病的病因[1],此后在不同国家与地区相继暴发与流行,给世界养牛业带来巨大经济损失。目前已证实,牛支原体除导致牛肺炎、乳腺炎外,还可导致关节炎、角膜结膜炎、耳炎、生殖道炎、流产与不孕等多种疾病[2,3]。牛支原体多数由于存在与其他病原体的混合感染,对多种抗生素表现耐药性,导致抗生素的治疗效果产生偏差[4],因此应用疫苗进行免疫预防便成为控制牛支原体病的主要措施。但目前除美国外,几乎无商品化疫苗应用于牛支原体病的预防,还没有文献报道牛支原体病可以使用疫苗进行预防控制[5]。
1 试验材料
1.1 试验菌株及试验动物
牛支原体新疆分离株,2010年分离自新疆石河子某牛场因肺炎死亡犊牛肺脏组织,参照文献[6]的方法对其进行特异性PCR鉴定和oppF基因测序分析,鉴定为牛支原体;试验用小鼠,石河子大学实验动物中心。
1.2 主要仪器设备及试剂
ISA206双相佐剂,法国赛比克公司;光学显微镜CX21,日本奥林巴斯公司;高速冷冻离心机CR22E,美国西格玛奥德里奇公;生物安全柜BHC-Ⅱ-A/B3型,拓赫机电科技(上海)有限公司;连续波长酶标仪,美国伯乐公司;HRP标记的山羊抗小鼠IgG,史瑞克生物(上海)有限公司。
1.3 ELISA检测相关试剂
鼠抗牛支原体阳性高免血清由免疫学实验室制备;鼠抗牛支原体阴性血清为未免疫牛支原体疫苗,抗体检测为阴性的健康小鼠血清。
2.5%戊二醛溶液:0.1 mol/L碳酸氢钠(NaHCO3)溶液90 mL,25%戊二醛10 mL。
抗原包被液(0.05 mol/L Na2CO3和NaHCO3缓冲液,pH值=9.6):Na2CO31.5 g,KCl 0.2 g,NaHCO32.9 g,ddH2O定容至1 L,调整 pH值=9.6。
PBST洗涤液(pH值=7.4):NaCl 8.0 g,Na2HPO4·12H2O 2.9 g,KCl 0.2 g,K2HPO40.2 g,吐温-20 0.5 mL,加ddH2O定容至1 L,现用现配。
封闭液(样品稀释液):PBS为介质的2%BSA溶液,振荡混匀,4 ℃保存。
终止液(2 mol/L硫酸):浓硫酸22.2 mL,ddH2O177.8 mL。
PBS缓冲液(pH值=7.4):NaCl 8.0 g,KCl 0.2 g,Na2HPO4·12H2O 2.9 g,K2HPO40.2g,加ddH2O定容至1 L,调整pH值=7.4。
底物溶液:0.1 mol/L柠檬酸缓冲液5.6 mL,0.2 mol/L 磷酸氢二钠缓冲液4.4 mL,10 mg/mL四甲基联苯胺(用DMSO二甲基亚砜配制)100 μL,0.75%H2O242 μL,临用前配制。
2 方法
2.1 抗原制备
将-80 ℃冻存的牛支原体菌株移入5 mL的牛支原体专用液体扩大培养基中,37 ℃、5%CO2箱中培养3 d,后按照体积比1∶10的比例传代3 次,待生长稳定后作为种子菌液。按照体积比1∶10接种新鲜培养基,置于37 ℃、5%CO2箱中扩大培养4 d,作为牛支原体抗原菌悬液。
2.2 牛支原体灭活疫苗的制备
2.2.1 疫苗配制
ISA206双相佐剂∶抗原菌悬液= 54∶46(V/V)。佐剂使用前需经121 ℃高压灭菌30 min。配苗前将佐剂和抗原菌悬液预热至(31±1)℃;在150 r/min搅拌状态下将抗原菌悬液缓慢滴入佐剂中,滴加完毕后,置恒温震荡培养箱30 ℃ 200 r/min,循环乳化 30 min,取出后置-20 ℃10 min迅速降温,冷却后4 ℃保存。
2.2.2 检测指标
无菌检测:在无菌状态下将乳化后的疫苗分别接种于普通营养琼脂培养基和鲜血琼脂培养基,在37 ℃、5%CO2箱中培养4~5 d,观察有无杂菌生长。
黏度检测:用出口内径为1.2 mm的1 mL刻度吸管吸取室温下双相疫苗,然后垂直悬空吸管使疫苗乳剂自然流出,记录流出0.4 mL乳剂所用时间。
离心检测:用10 mL刻度离心管吸取双相疫苗10 mL,以3 000 r/min 离心15 min,观察其分层情况。
剂型检测:显微镜400 倍下观察双相疫苗的均匀度,第1滴下部成拖尾云雾状或部分散为水/油/水(W/O/W)。
稳定性试验:疫苗分别存放于4 ℃、37 ℃、-20 ℃环境中,在第3 d、7 d、30 d、90 d、180 d、365 d观察疫苗稳定性。
安全性试验:小白鼠每只腹腔注射0.2 mL,家兔每只皮下注射1 mL,观察其精神状态及采食状况。
2.3 最小免疫剂量试验
取60 只健康小鼠,按15 只/组随机分为A、B、C、D 组,进行免疫。A、B、C、D 组通过腿部肌肉接种牛支原体灭活疫苗,注射剂量分别为:0.1 mL/只、0.2 mL/只、0.3 mL/只、0.4 mL/只。E 组为空白对照组,为5 只健康小鼠。试验组共免疫2 次,首免10 d后以同样剂量补充免疫1 次,二免后第14 d、21 d分别采血,分离收集血清,-20 ℃保存待检。
2.4 免疫持续期试验
20 只健康小鼠通过腿部肌肉接种牛支原体灭活疫苗,0.2 mL/只,共免疫2 次。另设5 只健康小鼠为空白对照组。试验组:首免10 d后以同样剂量补充免疫1 次,二免后第7 d、14 d、21 d、28 d、35 d、42 d分别采血,分离收集血清,-20 ℃保存待检。
2.5 ELISA检测血清抗体滴度
2.5.1 酶标板预处理
酶标板中加入2.5%戊二醛溶液150 μL/孔,37 ℃2~3 h,去离子水洗涤3 次,每次5 min。
2.5.2 抗原包被及封闭
用抗原包被液将上述2.1制备的抗原菌悬液稀释至270 μg/mL后包被酶标板,100 μL孔,4 ℃包被过夜;次日弃去孔中液体,用PBST洗涤液洗板4 次,每次5 min,拍干,加入封闭液200 μL/孔,37 ℃封闭3 h。
2.5.3 加入待检血清
弃去孔中液体,以同样方法洗板,将待检血清稀释100 倍,加入封闭好的酶标板中,100 μL/孔,同时设立阴性和阳性对照孔,置于37 ℃孵育1 h。
2.5.4 加入酶标二抗
弃去孔中液体,以同样方法洗板,加入1∶1 000倍稀释的HRP标记的山羊抗小鼠免疫球蛋白,100 μL/孔,置于37 ℃孵育1 h。
2.5.5 显色
弃去孔中液体,用PBST洗涤液洗板4 次,每孔加入100 μL新鲜配制的底物溶液,37 ℃避光显色15 min,取出后立即加入终止液50 μL/孔终止反应,并迅速于450 nm波长测OD值。
3 结果
3.1 疫苗最小免疫剂量
小鼠免疫牛支原体灭活疫苗后,血清中抗体滴度明显高于未免疫组,但0.2 mL组抗体滴度最高,因此选取0.2 mL小鼠免疫牛支原体灭活疫苗的最小免疫剂量。不同免疫剂量免疫小鼠后平均抗体滴度详见表1。
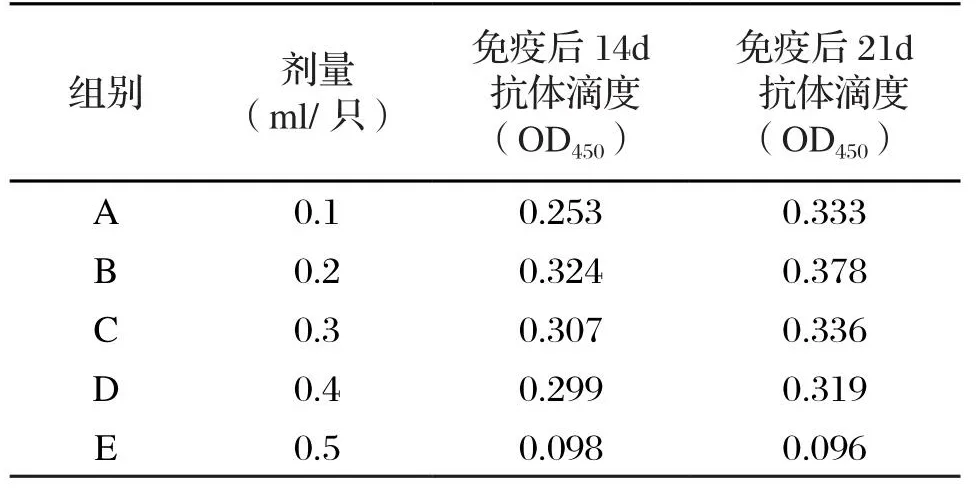
表1 疫苗免疫后第14 d、21 d平均抗体滴度
3.2 疫苗免疫后抗体消长规律测定
牛支原体灭活疫苗免疫小鼠3 周后,抗体滴度达最高峰,随后抗体滴度开始下降,但仍保持相对稳定,5 周后抗体滴度呈下降趋势。牛支原体灭活疫苗免疫小鼠后平均抗体消长规律详见表2。

表2 牛支原体灭活疫苗免疫小鼠后平均抗体滴度(OD450)消长规律表
4 讨论
研究发现,药物对支原体类疾病治疗仅可使临床症状减轻或消失,停药后病情会反复,很难彻底治愈和根除,所以控制支原体病的最有效措施是免疫接种[7]。但目前尚无商品化牛支原体疫苗,牛支原体病的防控形势较严峻。本研究就课题组制备的牛支原体灭活疫苗对小鼠进行免疫试验,发现接种后小鼠未见异常反应,且接种部位均正常,未见化脓及红肿现象,表明疫苗安全可靠。
影响疫苗免疫效果的因素众多,在保证疫苗免疫原性的前提下,免疫剂量及次数是影响机体免疫应答反应的主要因素之一,尤以灭活疫苗最明显。免疫剂量不足、有效抗原量过小均不能有效诱导机体产生免疫应答,抗体滴度不高且持续时间短暂;免疫剂量过大可诱使机体产生免疫麻痹现象或变态反应,不但起不到预期免疫效果,相反还可能会给动物机体造成损伤。本研究设4 个剂量组对小鼠进行免疫试验,结果表明0.2 mL组产生的免疫反应优于其他3 个剂量组,抗体滴度最高,免疫后14 d平均抗体滴度为0.324,免疫后21 d平均抗体滴度为0.378,可能0.1 mL组抗原量不足,不能诱导机体产生较好免疫应答反应,而0.3 mL与0.4 mL组可能免疫剂量过大,导致机体出现麻痹现象;选取0.2 mL作为最佳免疫剂量免疫小鼠,免疫后进行抗体水平检测,结果表明试验组与对照组差异显著,试验组在免疫后抗体水平明显上升,且高抗体水平可持续30 d左右。试验结果为牛支原体灭活疫苗应用提供一定的科学依据。
