牛病毒性腹泻的流行病学调查与防控
2023-08-08张红梅袁溶英薛海龙
张红梅,袁溶英,王 峰,薛海龙,姬 阳
榆林市畜牧兽医服务中心,陕西榆林 719000
0 引言
牛病毒性腹泻(Bovine Viral Diarrhea Disease,BVD)又称为牛病毒性腹泻/黏膜病,是由牛病毒性腹泻病毒 (Bovine Viral Diarrhea Virus,BVDV)感染牛、山羊、绵羊、鹿等多种动物而引起的直接或者间接接触性传染病,可造成呼吸系统、消化系统、生殖系统等多系统机能发病,且引起感染动物免疫抑制,诱发其他病原微生物混合或继发感染[1]。奶牛感染BVDV后可以潜伏带毒和持续性排毒,通过污染粪便、料草等多种途径传播病毒,是主要的病毒传染源。妊娠母牛可通过胎盘垂直传播胎儿,尤其在妊娠初期的120 d内病毒可穿透胎盘而感染胎儿,此外病毒也可通过精液传播[2,3]。每个生产阶段奶牛均可感染,特别是犊牛最易感染,不同生产阶段表现出多样化的临床症状,常以严重腹泻为主,发病急,潜伏期在24 h内,发病率通常不高,约为5%,但病死率为90%~100%[4]。妊娠奶牛感染后呼吸困难,体温升高,间歇性腹泻,体况消瘦,有时发生流产、死胎等繁殖障碍。
BVD于1946年由Olafsan首次在美国纽约州奶牛中检测到,分布世界各地[5]。我国最早在1980年发现BVDV,由于奶牛规模养殖发展,管理水平参差不齐,BVD在我国多地均有不同程度流行,并有不断扩大的趋势[6],严重危害奶牛养殖业的健康发展,已成为当前我国奶牛疫病防控中主要的传染病之一。目前,榆林市奶牛场BVD流行情况还未见报道。本研究选取5 家奶牛场,采用双抗体夹心ELISA方法检测BVDV血清抗体,以期掌握该病在榆林市奶牛养殖业流行特点,为制定有效技术防控方案提供参考。
1 材料与方法
1.1 样品来源
2022年4—12月在榆林市选择5 家未免疫BVDV疫苗的奶牛场,采集全血156 份,其中犊牛(0~6月龄)45 份,育成牛(7~18 月龄)58 份,成母牛53 份。室温静置自然凝固10~20 min,常规方法离心收集血清,编号,-20 ℃保存备检。
1.2 主要试剂和仪器
BVDV抗原ELISA检测试剂盒(特异性和敏感性均为99.9%),温州科淼生物科技有限公司;SPR-960酶标仪(450 nm波长滤光片),美国Bio-Rad公司;微量振荡器、恒温箱,上海普林斯顿公司。
1.3 检测方法
按照BVDV抗原ELISA检测试剂盒说明书操作,具体检测步骤为:(1)标准品稀释:在酶标包被板设置10 个标准孔,各取100 μL标准品分别加入第1、2孔,然后分别加入50 μL标准品稀释液,混匀,再从第1、2孔各取100 μL稀释后的标准品依次加入第3、4孔,并分别加入50 μL标准品稀释液,按照此方法依次类推,直到第9、10孔(最后第9、10孔各取50 μL弃掉)。(2)加样:在待测样品孔中先加40 μL样品稀释液,然后加入10 μL待测样品,混匀。同时设阴性对照孔、阳性对照孔各2 个,空白孔1 个。在阴性对照孔、阳性对照孔分别加入阴性对照、阳性对照50 μL。(3)温育:用封板膜封板后置37 ℃恒温箱温育30 min。(4)洗涤:揭掉封板膜,弃去液体,甩干,每孔加满配制后的洗涤液(20 倍浓缩洗涤液用蒸馏水20 倍稀释),静置后弃去液体,重复5 次,拍干。(5)加酶:除空白孔外,每孔加入酶标试剂50 μL。(6)温育、洗涤:分别同上述(3)(4)步骤。(7)显色:每孔加入显色剂A、B各50 μL,混匀,37 ℃避光显色10~30 min。(8)终止:每孔加终止液50 μL。(9)测定:以空白孔调零,加终止液后15 min内在波长450 nm处测量各孔的吸光度值(OD450)。(10)结果判定:当阳性对照孔OD450平均值≥1.00,阴性对照孔OD450平均值≤0.10时试验成立。临界值(CUT OFF)=阴性对照孔OD450平均值+0.15。待测样品OD450值<CUT OFF者判为阴性;待测样品OD450值≥CUT OFF者判为阳性。
1.4 数据统计
采用Excel软件对试验数据统计分析。
2 结果
2.1 不同奶牛场的BVDV抗原检测
对5 家奶牛场156 份血清样品采用双抗夹心ELISA方法检测BVDV血清抗原,结果显示,BVDV抗原平均阳性率为4.49%(7/156)。5 家奶牛场BVDV抗原阳性率介于0~6.38%,其中,E奶牛场BVDV抗原阳性率最高,为6.38%,D奶牛场有效率最低,为0(表1)。
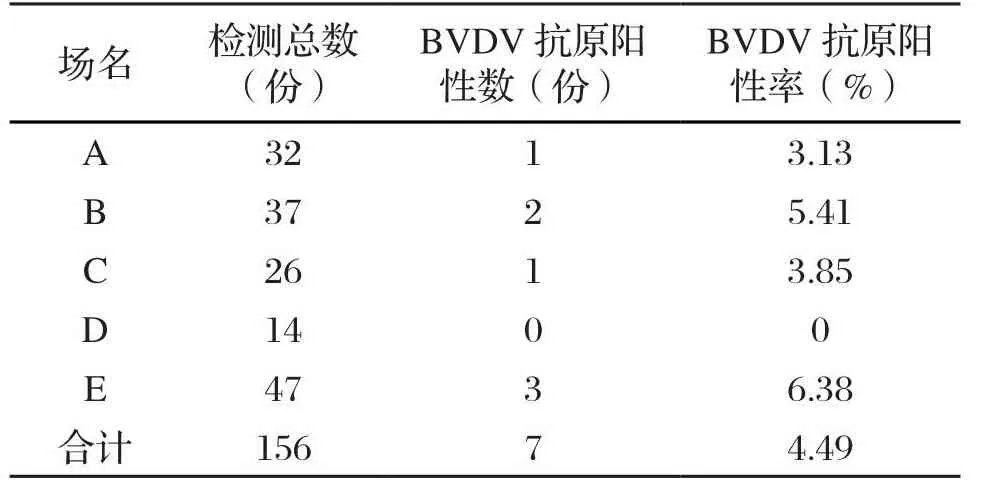
表1 不同奶牛场的BVDV抗原检测结果
2.2 不同年龄阶段奶牛的BVDV抗原检测
采用双抗夹心ELISA方法对不同年龄阶段奶牛血清样品进行BVDV抗原检测,结果显示,成母牛、犊牛、育成牛BVDV抗原阳性率分别为5.66%、4.44%、3.45%(表2)。
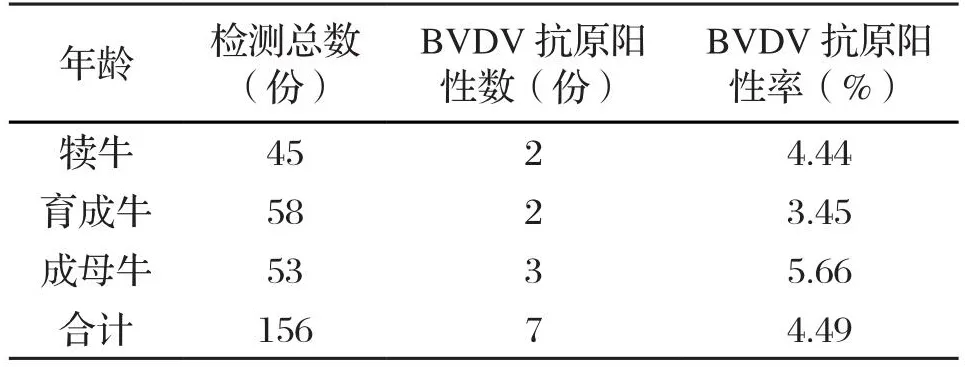
表2 不同年龄奶牛的BVDV抗原检测
3 讨论
ELISA检测原理是以体外抗原抗体特异性反应为基础,将酶的高效催化作用与抗原抗体特异性反应相结合的一种检测方法,主要有双抗夹心法、间接法、直接法和竞争法,被广泛应用于医学试验、生物制药、疫病流行病学调查等方面。本试验采用双抗体夹心法,具有灵敏度高、操作简单、检测速度快等特点,可用于大批量样本检测。
据报道,中国奶牛中合并BVDV流行率约为53.0%[7]。目前,我国奶牛场以规模化养殖为主,尽管精细化管理能够降低BVDV感染率,但由于地区间气候环境差异,饲养密度较大,饲养管理和疫病防控能力不强,部分地区奶牛场依然存在BVDV感染高风险。王丽屏等[6]对云南省4 个州部分奶牛场456 份血清样品进行BVDV抗原检测,抗原阳性率为0.53%。魏其等[8]调查发现,新疆部分地区牛养殖场BVDV阳性检出率为22.5%~62.5%,平均总阳性率为40.0%。何小丽等[9]报道,宁夏奶牛场BVDV抗原阳性率最高为5.0%,平均阳性率为1.48%。杨德新等[10]对河南省奶牛场BVD流行病学调查,5 486 份血清BVDV抗原阳性率为1.77%。结合本次调查成母牛、犊牛、育成牛BVDV抗原阳性情况分析,成母牛阳性率最高(5.66%),其次为犊牛(4.44%)、育成牛(3.45%),犊牛和育成牛差异不大,除与本次调查抽样数量少有关外,也与成母牛生长周期长,感染BVDV风险高,其抗原阳性率高于犊牛和育成牛,或者成母牛是在怀孕期间感染BVDV,导致该病毒在幼牛体内建立免疫耐受或者持续性感染有关[11]。
4 防控方法
BVD流行广泛,致病机理复杂,目前还缺乏有效的治疗药物。牛病毒性腹泻是一种以水平传播为主的疾病,由于病毒特性,一旦奶牛场发生BVD流行,很难彻底根除,淘汰携带病毒的动物成为防控该病的重要方法[12,13]。净化根除BVD,需要对奶牛场采取加强引种检疫、生物安全措施、免疫接种、定期检测等综合防控措施。
4.1 引种检疫
禁止从疫区引种。奶牛场在引种前需要对引进奶牛进行BVDV血清抗原和核酸检测,重点对持续性感染牛检疫,发现染疫奶牛采取隔离、扑杀等方法,防止BVD传播。
4.2 生物安全措施
严格落实环境消毒、卫生防疫制度,及时彻底清理分泌物和排泄物,保持圈舍通风、干燥、清洁。
4.3 定期检测
持续感染奶牛的淘汰是规模化奶牛场防控BVD最好的方式,也是规模化奶牛场最经济的做法。每年定期开展BVD血清学调查,全面检测BVDV血清抗体和抗原,了解流行情况。怀孕早期病毒穿过胎盘,可导致持续感染犊牛的出生。持续感染的奶牛通常比短暂或急性感染的奶牛能更有效地传播BVDV,因为能够在其一生中排出大量的病毒,并且被认为是BVDV的主要储存库[14],因此要重点关注、及时筛查和清除持续感染BVDV奶牛。对检测的阳性奶牛隔离,30 d后再采血检测,淘汰仍为阳性者,并跟踪检测其母代奶牛。
4.4 免疫接种
疫苗有弱毒苗和灭活苗,育成牛在配种前再接种弱毒疫苗1 次,免疫期为1 年。若应用灭活疫苗,母牛配种前可免疫接种2 次,可有效预防该病。妊娠母牛在产前注射猪瘟兔化弱毒疫苗,15 份/头,也可以有效预防本病感染[15]。对BVDV抗原阴性奶牛及时进行BVDV疫苗免疫接种。
5 结论
本次流行病学调查初步摸清了榆林市奶牛场BVD流行特点。结果显示,在5 家奶牛场采集的156 份血清中检测到7 份BVDV抗原阳性,阳性率为4.49%,成年母牛阳性率较高,表明榆林市奶牛场BVD流行比较广泛。建议采取检疫检测、淘汰阳性牛和持续性感染牛,生物安全措施与免疫接种等多种防控方法。
