冲刺备考创新题专练
2023-08-08王书红毕继明王道灵张银玉
王书红 毕继明 王道灵 张银玉
1.碳纳米点是种新型碳纳米材料,我国化学家研究的一种新型复微合光催化剂[碳纳米点/氮化碳(纳米复合物)]可以利用太阳光实现高效分解水,其原理如图所示。下列说法错误的是
( )
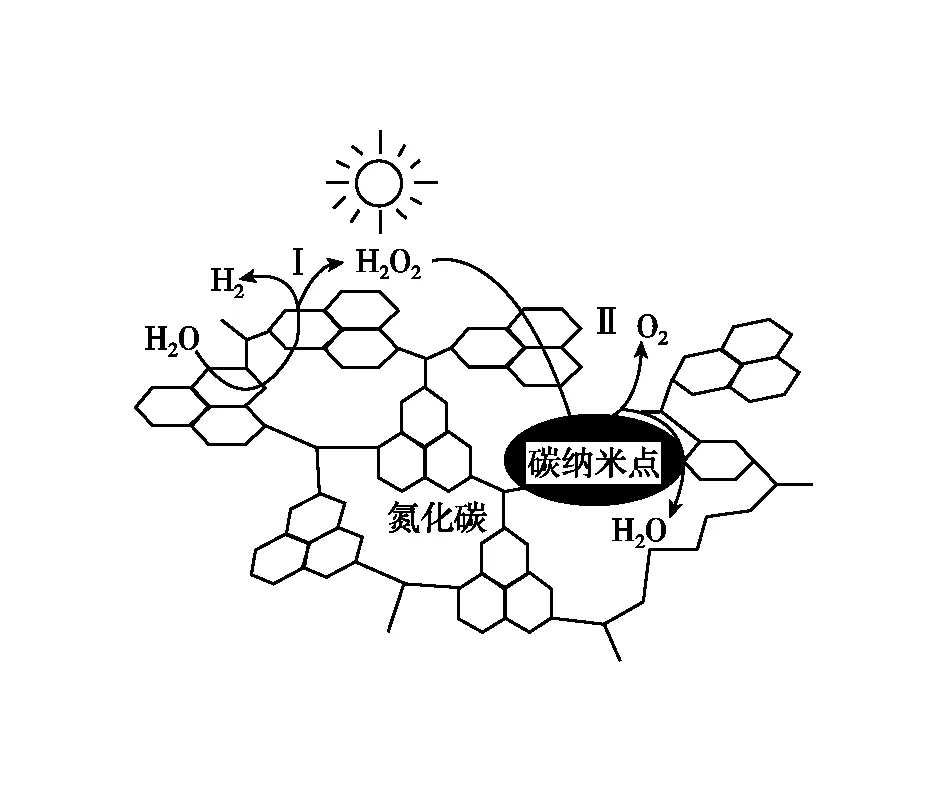

B.复合光催化分解水的反应中,H2O2是中间产物
C.复合催化剂中两种纳米材料均含有共价键,且步骤Ⅱ过程有非极性共价键的断裂与生成
D.新型复微合光催化剂降低了H2O分解时的ΔH,实现了光能到化学能的转化
【参考答案】D
【命题意图】本题以太阳光分解水的反应机理为载体,考查反应机理分析、化学键及能量转化,考查学生获取信息能力、灵活运用知识分析解决问题的能力。

福建省宁德市第一中学 王书红

( )

C.过程Ⅲ既有非极性键断裂又有非极性键生成
D.总反应中氧化剂与还原剂物质的量之比为1∶1
【参考答案】B
【命题意图】本题为反应机理分析题,以新颖的反应过程图为呈现形式,考查内容涵盖“氧化还原反应、反应过程分析、化学键、反应方程式判断”等。

福建省武平县教师进修学校 王道灵
福建省永定区第一中学 张银玉
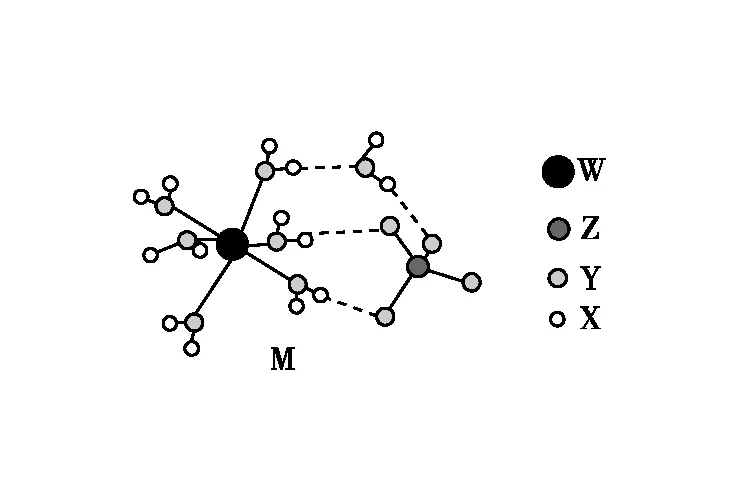
3.某种化合物W的结构如图所示,其中X、Y、Z、Q为原子序数依次增大的四种短周期元素,X是元素周期表中原子半径最小的元素, Y的核外电子总数与Q的核外最外层电子数相同。下列叙述正确的是
( )

A.四种元素中原子半径最大的是Q
B.Y、Z和Q三种元素的非金属性逐渐增强
C.X和Z形成的化合物中仅存在极性键
D.该化合物中只有一个Q满足8电子稳定结构
【参考答案】B
【命题意图】本题考查元素周期律与元素周期表,考查学生对元素及其化合物的辨析能力。
【解题思路】由W的结构分析可知,X只能形成一个共价键,又知X的原子半径是元素周期表中最小的,故X为H;Y可形成四个共价键, Y的核外电子总数与Q的核外最外层电子数相同,则Y为C、Q为O,Y、Z、Q原子序数依次增大,则Z为N。四种元素原子半径由大到小的顺序为C(Y)>N(Z)>O(Q)>H(X),A错误;同周期主族元素从左到右,非金属性依次增强,则元素的非金属性强弱顺序为C 黑龙江省黑河市第九中学 毕继明 4.矿物药M具有补血功效,结构如图所示,X、Y、Z和W为原子序数依次增大的元素,原子序数之和为51,Y和Z同主族,四种元素中只有W为金属,W3+的价层电子为半充满结构。下列说法错误的是 ( ) A.简单氢化物的稳定性:Y>Z B.该物质易被氧化,需密封保存 咨询单位与设计单位之间协作程度高,将是一种价值共创,其过程中并未加重对方的负担,而双方的满意度都会提高。 C.W与Y之间可以形成多种化合物 【参考答案】D 【命题意图】本题以新颖的物质结构为载体,考查元素推断和元素周期律,具体考查微粒性质、微粒间作用力等,意在考查学生对原子结构和元素性质周期性变化规律的理解及综合应用。 福建省武平县教师进修学校 王道灵 福建省永定区第一中学 张银玉 5.如图为某实验测得0.1 mol·L-1NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是( ) 已知:25℃时,Ka1(H2CO3)=4.4×10-7mol·L-1,Ka2(H2CO3)=5.6×10-11mol·L-1 【参考答案】A 【命题意图】本题以温度对NaHCO3溶液pH的影响为背景,考查水溶液中的离子平衡问题,具体考查水解常数的计算、温度对水解平衡的影响、盐溶液中的物料守恒、盐溶液中水电离程度的大小判断、盐溶液中微粒浓度大小比较等,意在考查学生信息获取与加工能力、分析与推理能力。 福建省宁德市第一中学 王书红 ( ) A.有机电解质可以选择CH3COOLi溶液 C.充电时,Li+主要从负极区通过隔膜进入正极区 D.废旧锂离子蓄电池(LiMO2)进行“放电处理”有利于Li+回收 【参考答案】D 【命题意图】本题考查电化学基础,考查学生对可充电电池原理分析的能力,培养学生宏观辨识与微观探析的学科核心素养。 黑龙江省黑河市第九中学 毕继明 7.苯甲醛制备苯甲酸和苯甲醇的反应原理如下: 名称相对分子质量密度/(g·mL-1)溶解性苯甲醛1061.04微溶于水苯甲酸122微溶于冷水,易溶于热水苯甲醇1081.04微溶于水 Ⅰ.在研钵中加入3.2 g颗粒状的氢氧化钠,研磨成粉末,然后加入5.0 mL 苯甲醛,继续研磨10 min。 然后转入烧杯,加入15.0 mL 水,加热搅拌至溶解。 Ⅱ.上述水溶液冷却后,加入浓盐酸调节 pH至8,用 20.0 mL乙酸乙酯萃取、分液得到有机相和水相。 Ⅲ.将有机相用5 mL饱和亚硫酸氢钠溶液洗涤,过滤,得到的有机相再用5.0 mL 10.0%的碳酸钠洗涤一次,分液,再向有机相中加入无水硫酸镁,过滤,蒸馏除去乙酸乙酯,得到1.9 g苯甲醇。 Ⅳ.搅拌下,在步骤Ⅱ收集的水相中滴加浓盐酸至 pH=2,然后放入冰水浴中冷却,过滤,得到苯甲酸粗产物。 (1)步骤Ⅱ中萃取、分液所需的玻璃仪器为________(填序号)。 (2)步骤Ⅱ加入盐酸过少或过多都不行的原因 是:____________________________________。 (3)步骤Ⅲ中用饱和亚硫酸氢钠溶液洗涤有机相的目的是除去苯甲醛,用碳酸钠溶液洗涤有机相的目的是。 (4)步骤Ⅳ中滴加浓盐酸至 pH=2的目的是,所发生反应的离子方程式为:____________________________________。 (5)步骤Ⅳ中若要将苯甲酸粗产物进一步提纯,可采用的方法为。 (6)理论上得到苯甲酸和苯甲醇的物质的量之比为1∶1,则苯甲醇的产率为___________________(结果保留 3位有效数字)。 【参考答案】(1)ace (2)加入的盐酸过少,溶液碱性太强,会导致乙酸乙酯水解;加入的盐酸过多,会析出苯甲酸晶体,降低产率 (3)除去苯甲醇中的苯甲酸 (5)重结晶 (6)71.7% 【命题意图】本题以有机物的制备为载体,考查实验仪器的选择、分离提纯和产率的计算等。 2×106 108 5×1.04 gm 黑龙江省黑河市第九中学 毕继明 8.全球CO2、NOx等气体排放量逐年增加,引发一系列环境问题,因此CO2、NOx等气体的综合治理成为当下的热点问题。回答下列问题: (1)ΔH2=kJ·mol-1。 ①加入催化剂后活化能最大的是反应(填“Ⅰ”“Ⅱ”或“Ⅲ”); ②a、b、c三点中达到平衡状态的点为; ③该反应由a点到达c点的过程中v(逆)逐渐(填“增大”“减小”或“不变”); ④若反应Ⅰ在c点的体系总压强为1.0 MPa,则c点反应的Kp=(MPa)-2(Kp为以分压表示的平衡常数)。 Ⅱ.NO的处理: (3)T1(填“>”“=”或“<”)T2,判断理由:。 (4)该反应为(填“吸热”或“放热”)反应。 【参考答案】(1)-90.4 (2)①Ⅲ ②a、c③增大 ④9.5 (3)> 初始时,恒容密闭条件下,充入等物质的量的气体,温度越高,压强越大,所以T1>T2 (4)放热 【命题意图】本题考查盖斯定律、化学反应平衡相关知识。考查学生的分析、推理和论证能力。渗透了变化观念与平衡思想、证据推理与模型认知等学科核心素养。 起始/mol 1 3 0 0