“数形结合”完成真实问题情境下的方程式书写
——高三复习后期的“小切口”提分策略
2023-08-08吕艳
吕 艳
(新疆乌苏市第一中学)
化学方程式作为化学用语,可以替代文字简洁、客观地描述化学反应,离子方程式是在化学方程式的基础上,以离子的形式描述溶液中发生的一个具体反应或一类反应,更加接近反应的实质。《普通高中化学课程标准》(2017年版2020年修订)在学业质量中对“化学反应方程式的书写”提出两个明确要求:一是能结合实例书写离子方程式和氧化还原反应方程式,二是能根据化学反应原理预测物质转化的产物。
“结合实例”和“预测产物”,就是期望学生在题干预设的真实问题情境中灵活应用已有知识完成陌生化学方程式的书写。笔者将情境方程式书写作为高三后期复习专项提升的一个小切口,力图通过“数形结合”破解真实问题情境下的方程式书写,希望能由一及多,引发教师和学生的深入思考。
一、“数形结合”实现已有知识在真实问题情境中的灵活应用
(一)利用数轴,破解“配比类”方程式的书写
配比类化学方程式一般由两个或多个基础方程式叠加形成,反应多数存在竞争关系。
1.存在竞争关系的氧化还原反应方程式书写
在氧化还原反应中,氧化能力强的物质与还原能力强的物质优先发生反应。当存在多种还原性物质时,按照还原能力的强弱,依次与氧化剂发生反应。所以氧化剂投入量不同,被氧化的物质种类和量也不同。破解这一类方程式的书写,需要把握三个关键点:
第一:明确反应体系中发生氧化还原反应的先后顺序,完成“少量”和“过量”两种情况下氧化还原反应方程式的书写;
第二:构建数轴,确定氧化剂和还原剂配比的起止点;
第三:在起止点之间,变换比例关系式,进行思维拓展,完成真实问题情境下的方程式书写。
【例1】向溴化亚铁溶液中通入氯气,已知还原性Fe2+>Br->Cl-,书写可能发生的离子方程式。
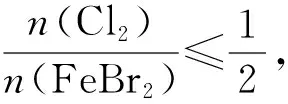
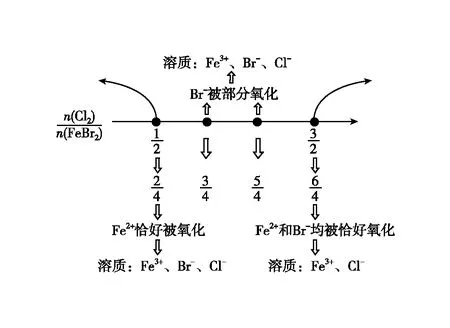
图1 向FeBr2溶液中通入Cl2·数轴构建
【实战演练】向碘化亚铁溶液中通入氯气。已知还原性I->Fe2+>Cl-,书写可能发生的离子方程式。
【分析过程】思路如上,先从氯气少、氯气过量入手,完成基础方程式书写且确定数轴的起止点,再对起止点的比例关系式进行变形,实现多种比例关系下的情境方程式书写。数轴构建如图2:
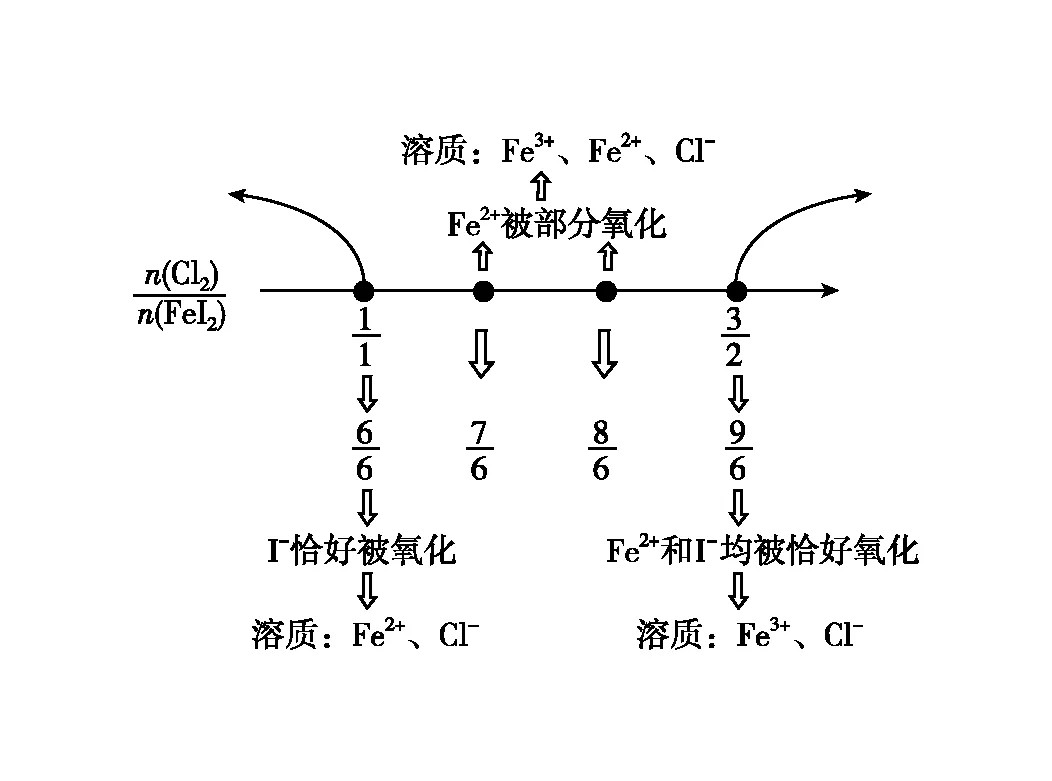
图2 向FeI2溶液中通入Cl2·数轴构建
利用数轴还可以破解“多种金属阳离子的混合体系中加入金属单质”类型的问题。
【例2】向均含有amol的Ag+、Fe3+、Cu2+混合溶液中加入Fe粉。讨论:烧杯中溶液和固体的可能组成。
【分析过程】三种阳离子的氧化能力:Ag+>Fe3+>Cu2+,加入的铁粉依次与三者反应。
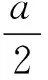
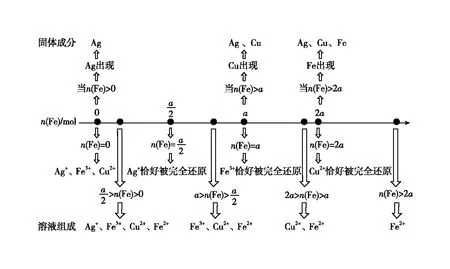
图3 向均含有a mol溶质的Ag+、Fe3+、Cu2+混合溶液中加入Fe粉·数轴构建
【小结】存在竞争关系的氧化还原反应方程式书写,关键是厘清氧化性或还原性的相对强弱;在此基础上明确反应的先后顺序,确定“少量”的起点和“过量”的止点并构建数轴。在数轴的起止点之间对比例式进行变形,可以实现不同配比的真实问题情境下的方程式书写。其优点是可以拓展学生对配比类氧化还原反应方程式书写的能力、拓宽理解的视角,同时加深理解氧化剂还原剂不同配比情况下生成物体系的组成。
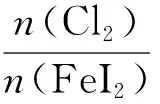
【答案】FeCl3、I2
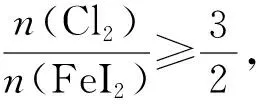
2.存在竞争关系的复分解反应方程式的书写
复分解类型的方程式书写,存在竞争关系时也可以利用数轴进行分析。
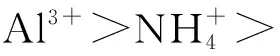
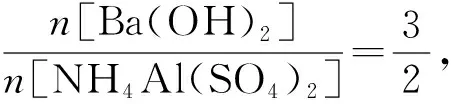
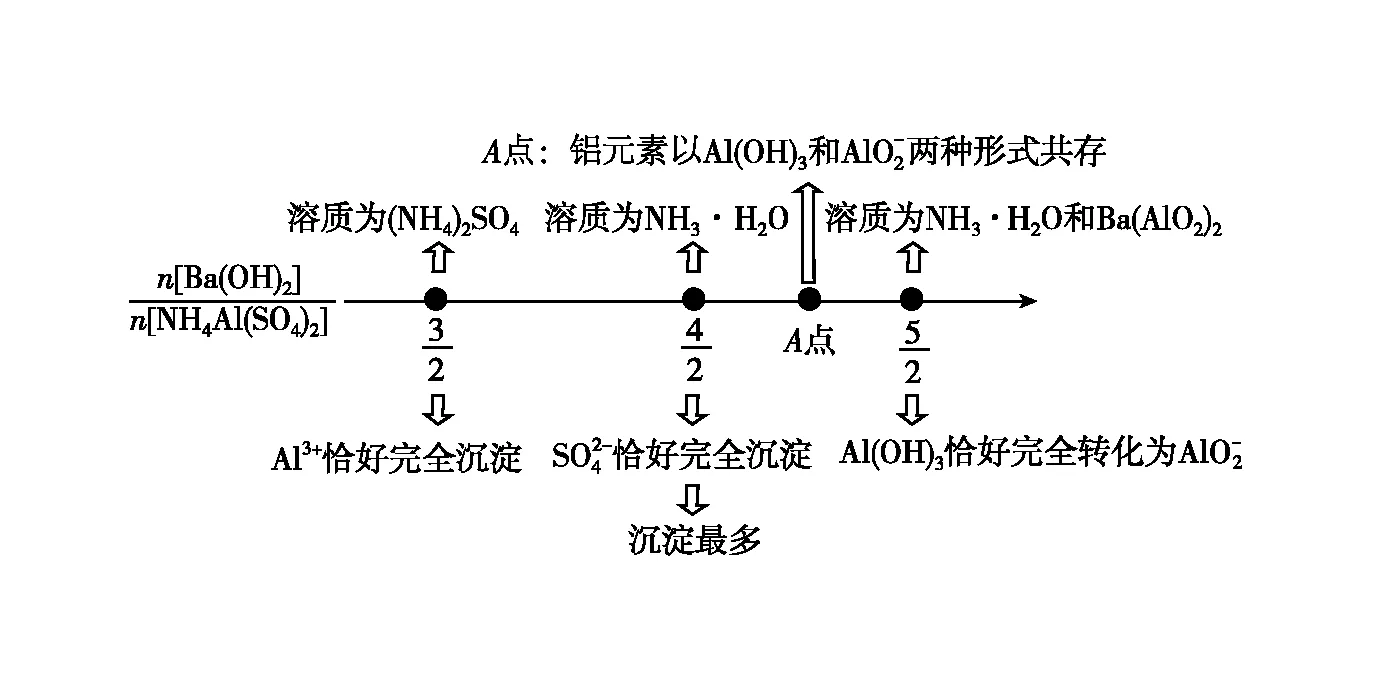
图4 向NH4Al(SO4)2溶液中加Ba(OH)2溶液·数轴构建
【真题应用2】(2022年全国甲卷,9题)能正确表示下列反应的离子方程式为
( )

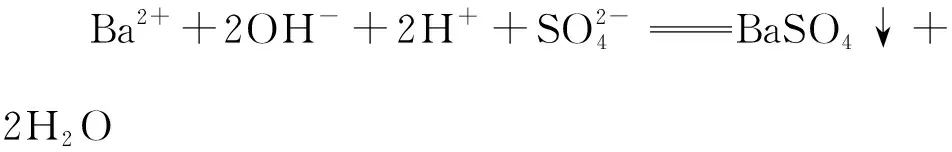
【答案】D
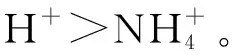
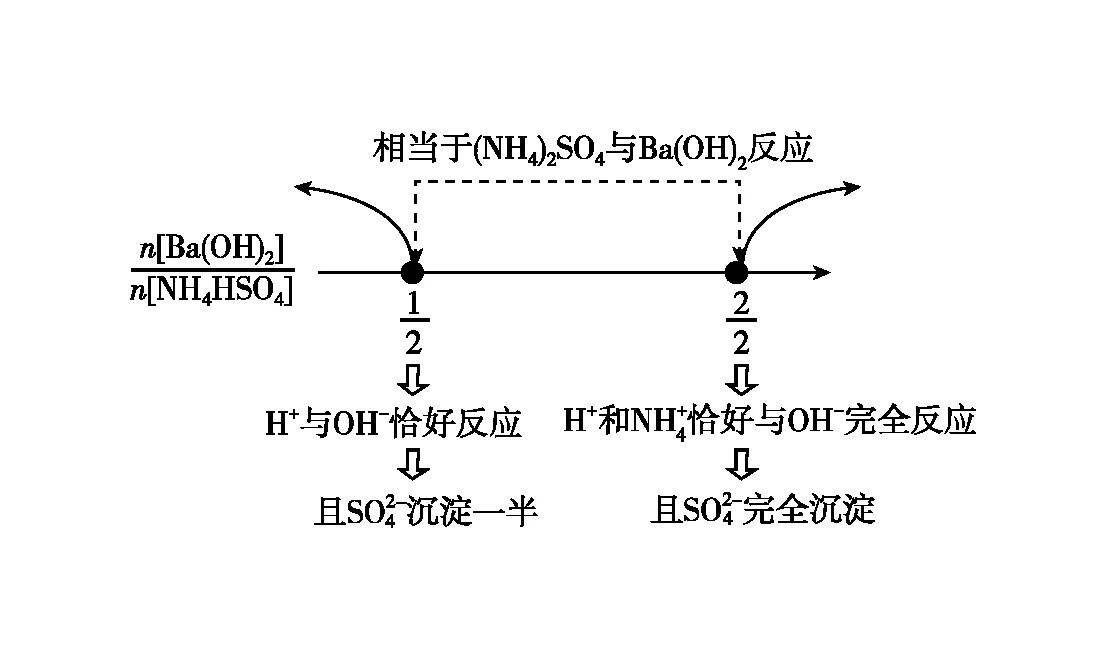
图5 Ba(OH)2和NH4HSO4溶液反应·数轴构建
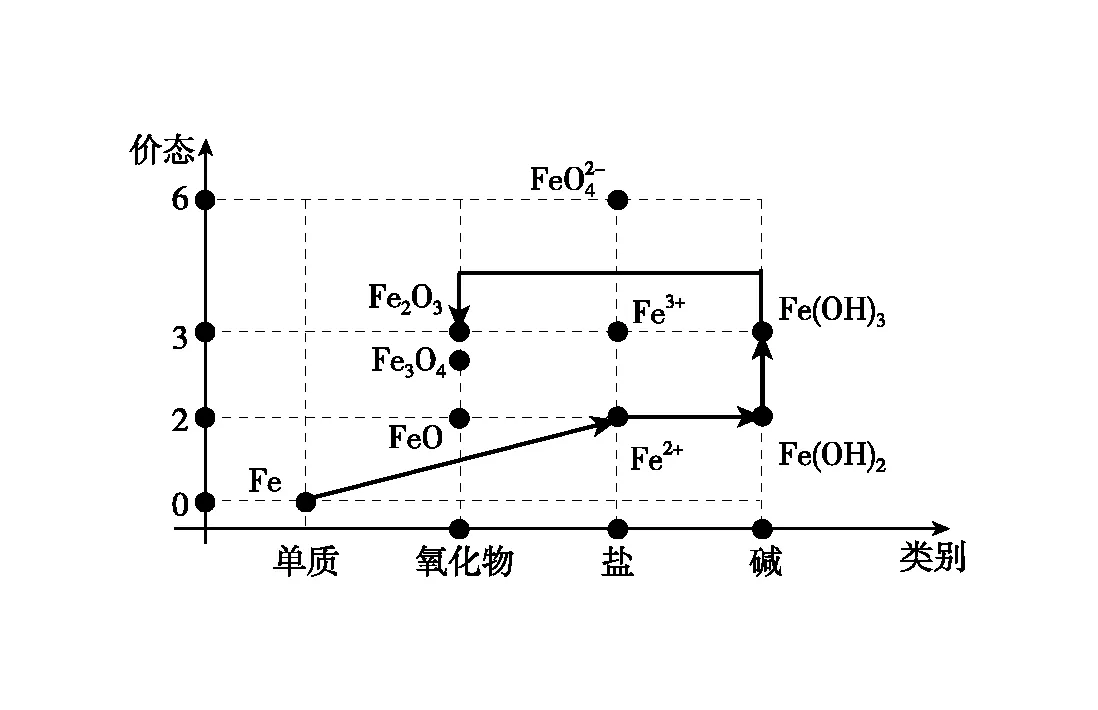
图6 铁的价类二维图·氧化铁合成路线一
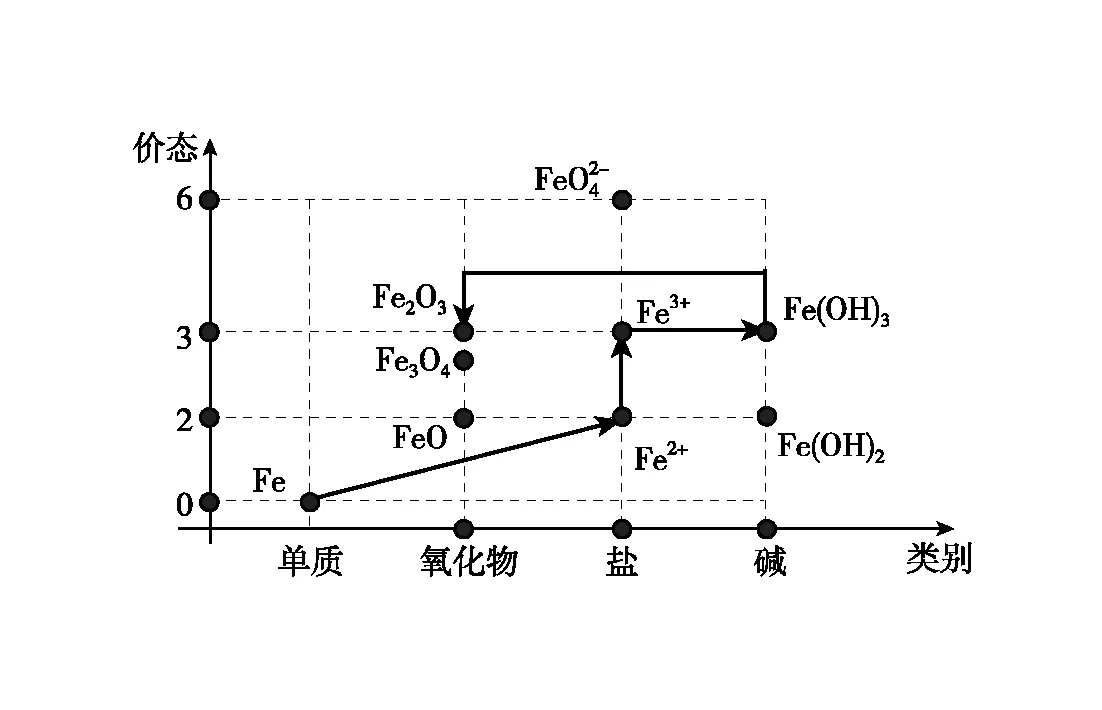
图7 铁的价类二维图·氧化铁合成路线二
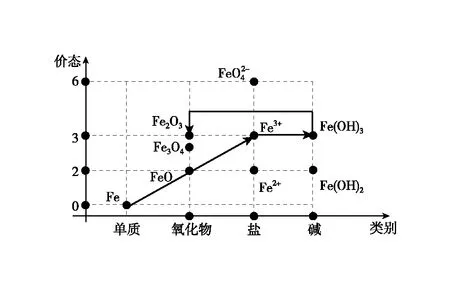
图8 铁的价类二维图·氧化铁合成路线三
(二)通过价类二维图的视角,理解物质转化和价态变价
价类二维图,将物质的价态和物质的类别构建在同一坐标系中,从物质类别和价态两个维度来关注物质的性质、转化和制备。
(1)比如以单质铁为原料制备氧化铁,可以按照下列三种路径实现:
通过价类二维图可以看出,由于氧化铁不溶于水,制备氧化铁的路径中,氢氧化铁是必须的中间产物,所有的路径都需要围绕氢氧化铁展开。
【真题应用3】(2022年北京卷,19题节选)某小组同学探究不同条件下氯气与二价锰化合物的反应。
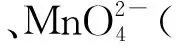
ⅲ. Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图9(夹持装置略)。
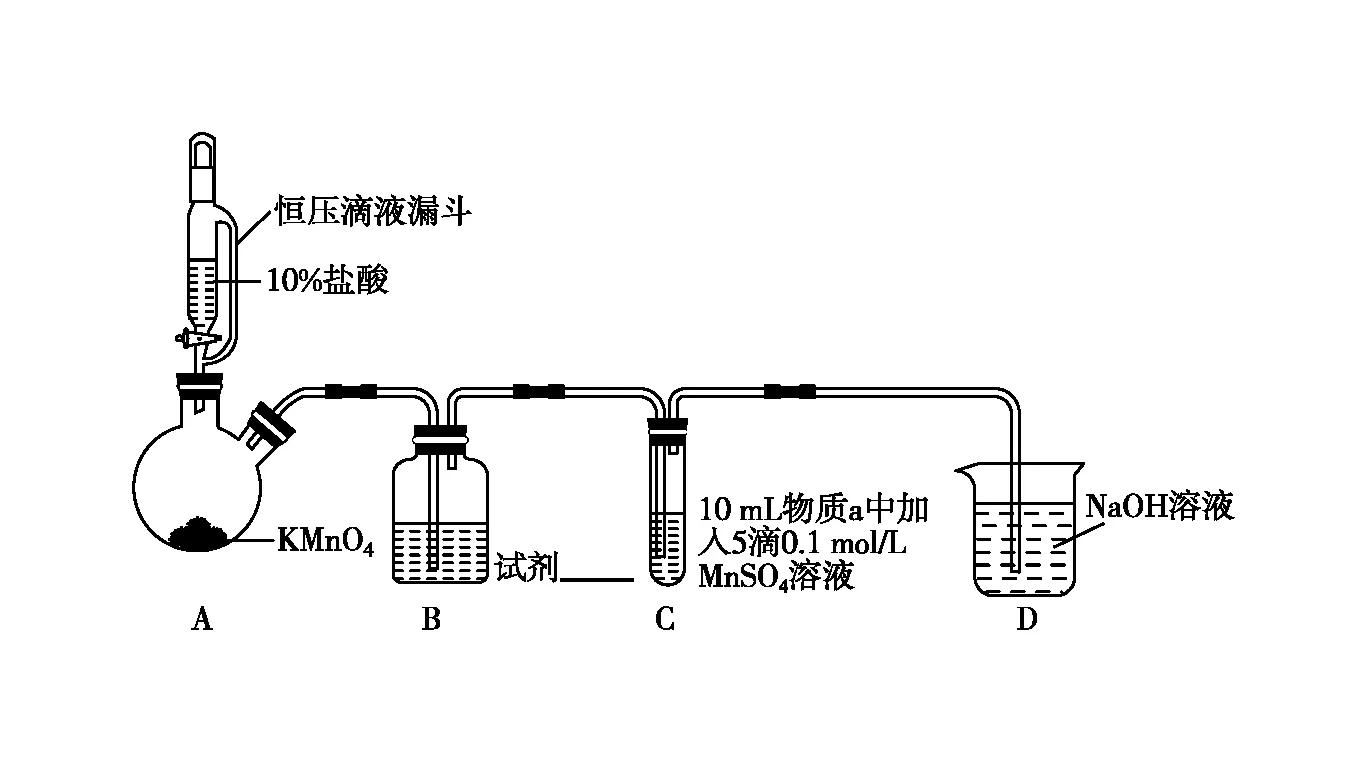
图9
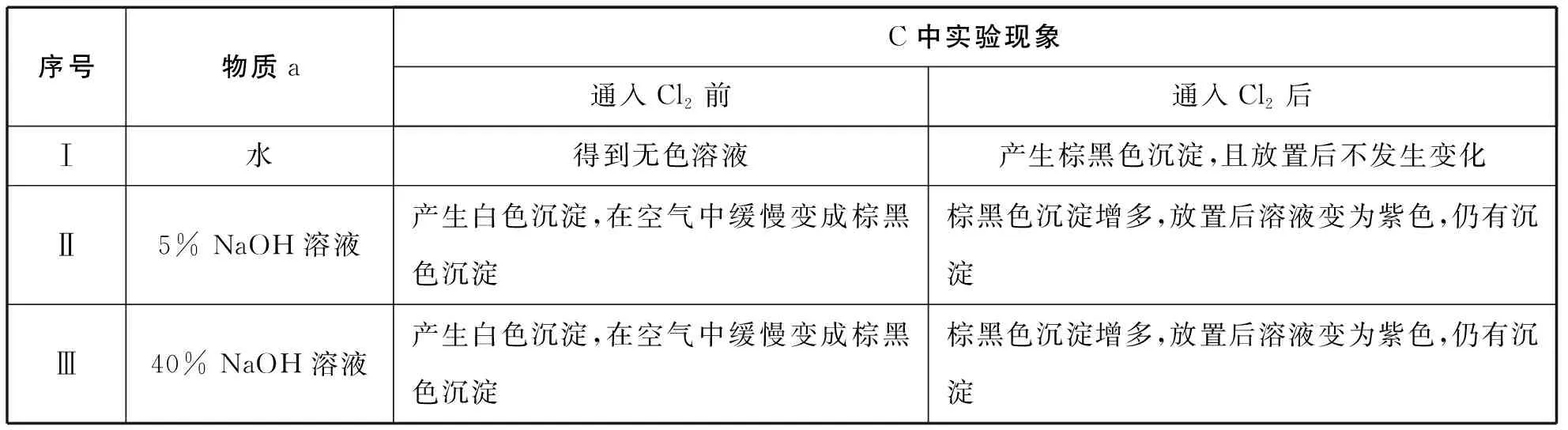
序号物质aC中实验现象通入Cl2前通入Cl2后Ⅰ水得到无色溶液产生棕黑色沉淀,且放置后不发生变化Ⅱ5% NaOH溶液产生白色沉淀,在空气中缓慢变成棕黑色沉淀棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀Ⅲ40% NaOH溶液产生白色沉淀,在空气中缓慢变成棕黑色沉淀棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色迅速变为绿色的离子方程式为____________________;
③取Ⅲ中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是____________________________________。

【解析】分析题干已知信息,结合问题和价态转化,进行3组对比实验分析:
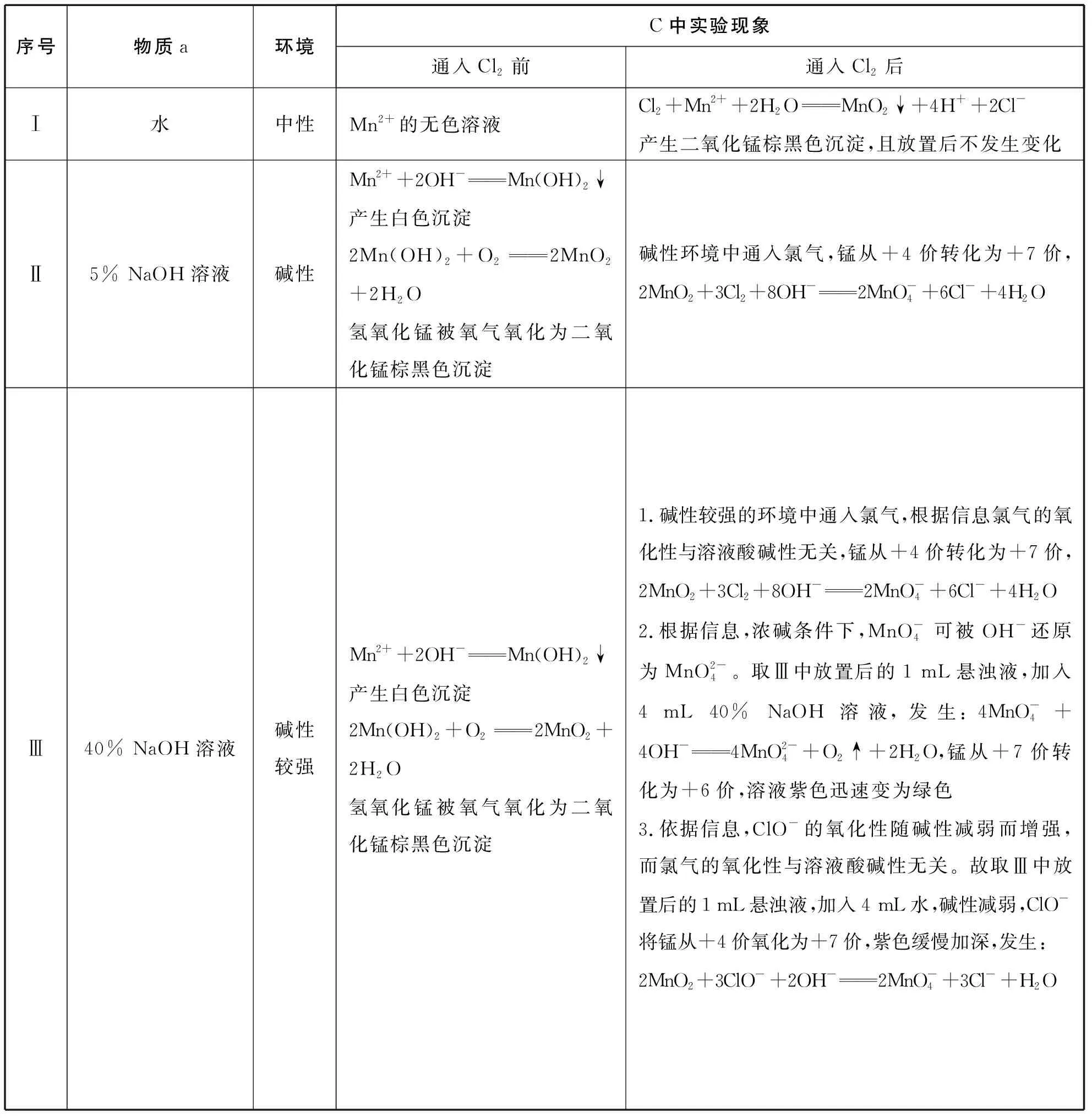
序号物质a环境C中实验现象通入Cl2前通入Cl2后Ⅰ水中性Mn2+的无色溶液Cl2+Mn2++2H2OMnO2↓+4H++2Cl-产生二氧化锰棕黑色沉淀,且放置后不发生变化Ⅱ5% NaOH溶液碱性Mn2++2OH-Mn(OH)2↓产生白色沉淀2Mn(OH)2+O22MnO2+2H2O 氢氧化锰被氧气氧化为二氧化锰棕黑色沉淀碱性环境中通入氯气,锰从+4价转化为+7价,2MnO2+3Cl2+8OH-2MnO-4+6Cl-+4H2OⅢ40% NaOH溶液碱性较强Mn2++2OH-Mn(OH)2↓产生白色沉淀2Mn(OH)2+O22MnO2+2H2O 氢氧化锰被氧气氧化为二氧化锰棕黑色沉淀1.碱性较强的环境中通入氯气,根据信息氯气的氧化性与溶液酸碱性无关,锰从+4价转化为+7价,2MnO2+3Cl2+8OH-2MnO-4+6Cl-+4H2O2.根据信息,浓碱条件下,MnO-4可被OH-还原为MnO2-4。取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,发生:4MnO-4+4OH-4MnO2-4+O2↑+2H2O,锰从+7价转化为+6价,溶液紫色迅速变为绿色3.依据信息,ClO-的氧化性随碱性减弱而增强,而氯气的氧化性与溶液酸碱性无关。故取Ⅲ中放置后的1 mL悬浊液,加入4 mL水,碱性减弱,ClO-将锰从+4价氧化为+7价,紫色缓慢加深,发生:2MnO2+3ClO-+2OH-2MnO-4+3Cl-+H2O
结合题目分析,在锰的价类二维图中构建三组实验的结果,结合已有知识,可以丰富我们对锰的认知:
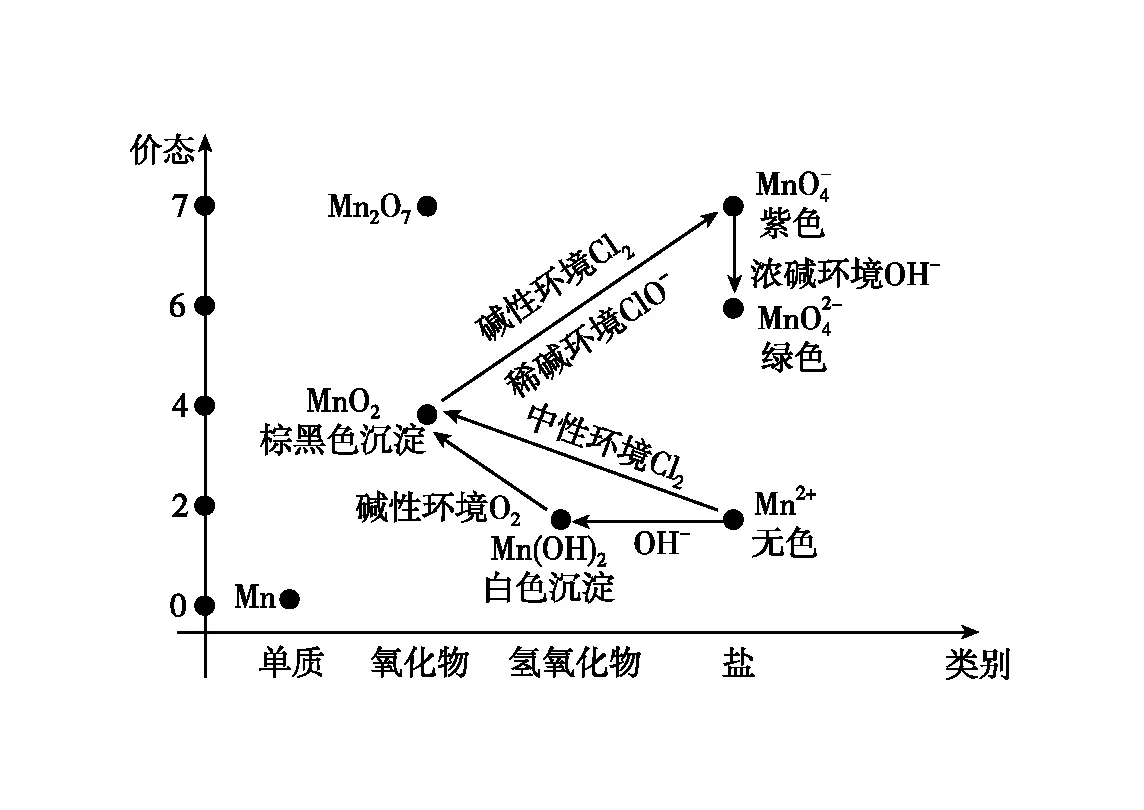
图10 锰的价类二维图
+2价锰,在碱性环境中还原性较强,可以被空气中的氧气氧化。
+4价锰,在碱性环境中主要表现还原性,在酸性环境中主要表现氧化性(实验室制备氯气)。
+6价锰,在碱性环境中可以稳定存在。
+7价锰,具有强氧化性,在碱性环境中转变为+6价,在酸性环境中转变为+2价,中性环境中转变为+4价。
二、真实问题情境下的方程式书写背后的必备积累
完成真实情境下的化学方程式的书写,需要一定的知识积累。下文罗列了部分存在竞争关系的非氧化还原反应的先后顺序和氧化还原反应的基本价态转化。(见表1,表2)
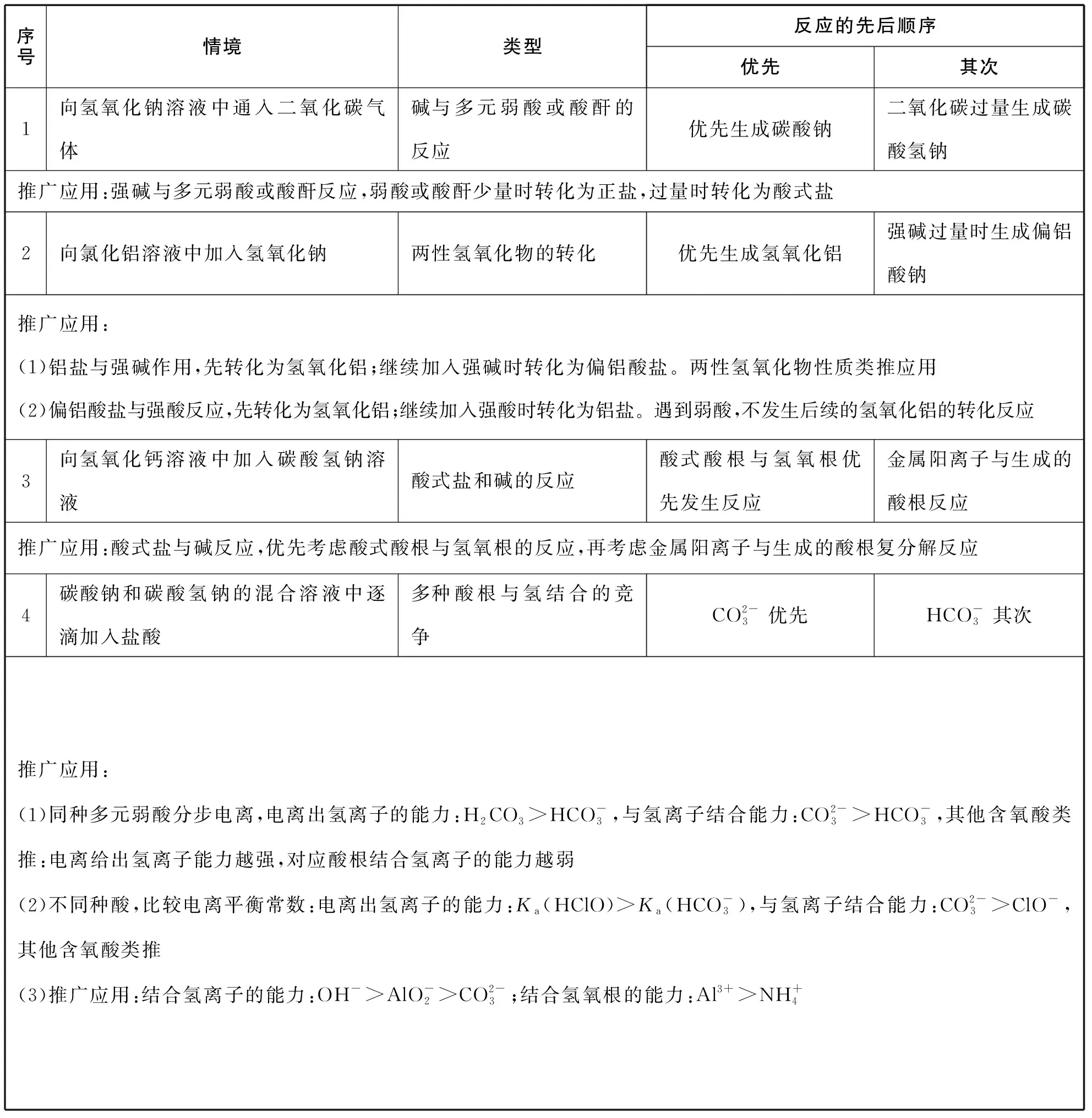
表1 必备知识积累之一:非氧化还原反应中的先后顺序
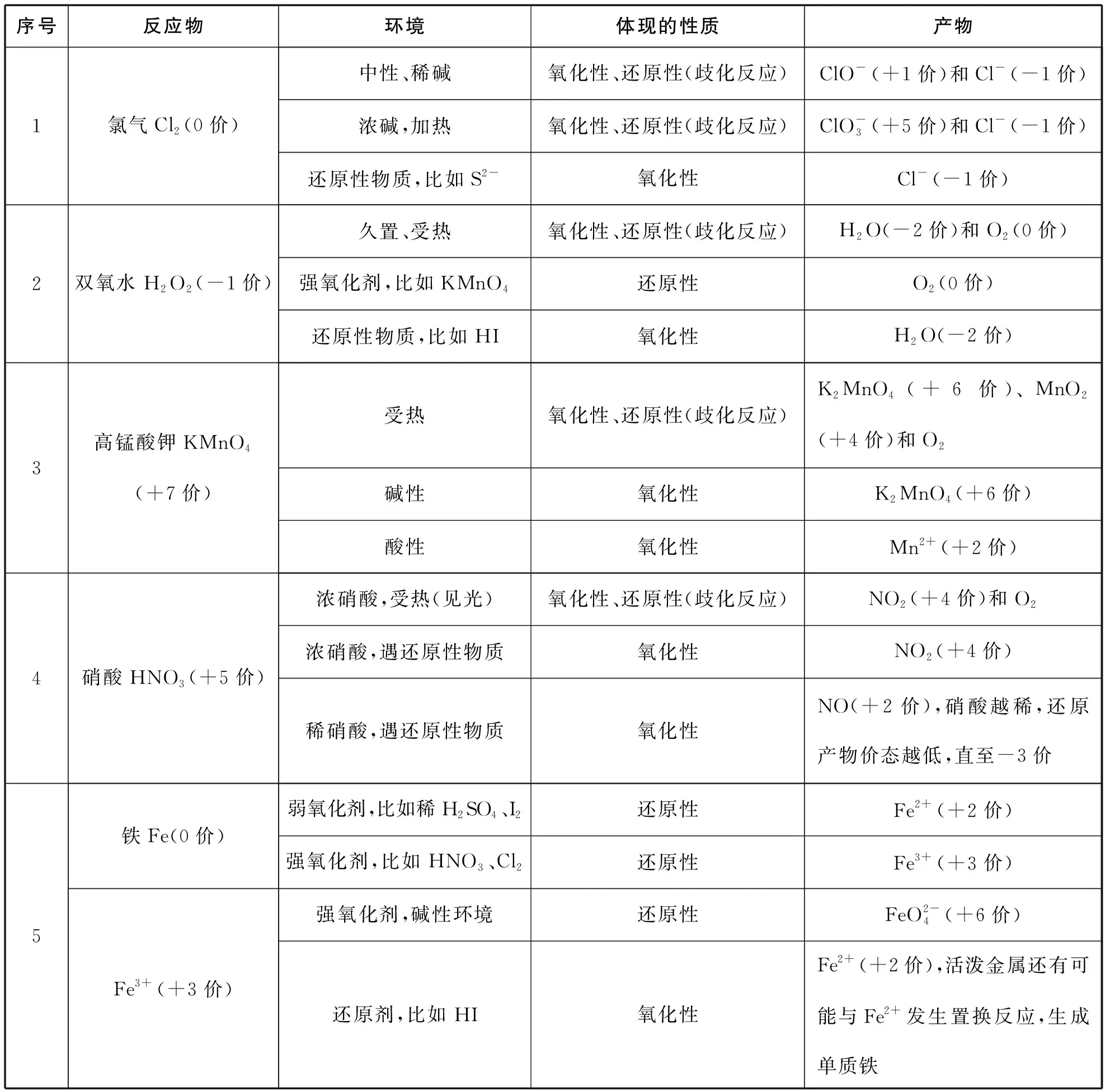
表2 必备知识积累之二:氧化还原反应中常见价态转化

