基于项目式学习的化学反应条件优化教学设计
——以工业废气中的二氧化碳合成甲醇为例
2023-08-08谭德山宗晓菲
谭德山 宗晓菲
(1.北京市顺义区教育研究和教师研修中心;2.北京市第四中学顺义分校)
一、理论分析
(一)教材分析
《普通高中化学课程标准》(2017年版2020年修订)(以下简称“新课标”)中提出化学学科核心素养包括“宏观辨识与微观探析” “变化观念与平衡思想” “证据推理与模型认知” “科学探究与创新意识” “科学态度与社会责任”。新课标对化学反应、限度和速率这一主题中化学反应调控的要求为:认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用。知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义。
结合新课标中的要求,选择实际生产中的化学反应调控问题为真实情境。经过调研,本课例选择现代社会亟待解决的“碳排放”问题为主题,以工业废气中的二氧化碳与氢气反应的调控为研究对象。本课例的指导思想是从理论分析与真实情境的矛盾出发,引导学生基于实际结果,形成解决真实情境中化学反应速率和化学平衡问题的方法,体现化学反应速率和化学平衡对于调控化学反应的作用,培养学生“证据推理与模型认知” “变化观念与平衡思想” “科学态度与社会责任”的学科核心素养。
化学反应速率、化学平衡和化学反应的方向等化学反应原理知识,在人教版(2019)教科书中属于高中化学选择性必修1《化学反应原理》第二章内容。化学反应速率和化学平衡体现了以下价值:(1)学科价值,化学反应速率和化学平衡是中学理论化学的基础,是学习后续章节水溶液中的离子平衡的基础;(2)社会价值,应用化学反应速率和化学平衡理论实现对生产生活中化学反应的调控和利用,使反应符合人们的需求;(3)学生价值,化学反应速率和化学平衡能够使学生更深刻、更全面地理解化学反应,有助于培养学生的学科素养。本章虽然没有具体地介绍化工生产内容,但选择化工生产最适宜的条件必然涉及化学反应速率和化学平衡等理论的应用。教师可以引导学生学会分析具体反应的特点,进而可以利用所学理论知识进行合理选择,同时要学会全面思考各种条件的相互影响,在比较中趋利避害,找到最优化的条件,使学生体会化学理论对于实际生产的指导作用。
(二)学情分析
高三第一轮复习中,由于已完成对于化学反应速率和化学平衡的章节复习,故学生对于该章节的基础概念掌握熟练。在前测中,对熟悉的可逆反应,改变一个外界条件时,大部分学生可以准确地分析出化学反应速率的变化和化学平衡的移动。但是对于真实情境的分析,如体系中有多个化学反应同时发生,对于工业生产中复杂图表的分析(如2019年北京卷,27(1)④题;2018年北京卷,26(4)题等),学生缺乏有效的分析方法,往往还是靠猜测。这是重点要去解决、突破的问题。
二、教学目标
(一)教学及评价目标
1.通过利用工业废气中的二氧化碳加氢合成甲醇的反应,对反应条件进行优化,让学生体会化学平衡和速率相关知识的应用价值,形成从限度、速率和实际生产等多个角度综合分析、解决工业生产实际问题的基本思路。
2.通过本课时的学习,培养学生树立绿色化学理念,认识到利用化学反应将无用物质转化为有用物质是解决环境问题的重要途径之一。
(二)核心素养发展目标
1.变化观念与平衡思想:通过真实情境中的化学反应调控问题,认识化学反应有一定的限度和速率,是可以通过改变外界条件进行调控的。
2.证据推理与模型认知:培养学生建立外界条件、图表和实验结果之间的逻辑关系,让学生体会处理真实情境下问题的方法。
3.科学态度与社会责任:认识化学反应速率和化学平衡的调控在工业生产中的重要作用,探索最适宜的化工生产条件,树立绿色化学观念。
三、教学流程
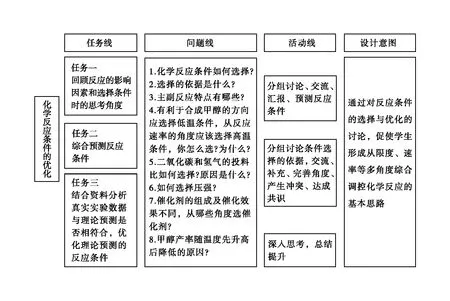
四、教学重点
1.提升学生从图表、文字中提取有效信息,并结合已有知识体系,运用“全面搜索”的方法对信息进行加工的能力。
2.从理论向实际应用迁移,掌握实际生产中化学反应调控问题的解题思路。
五、教学过程
环节一:提出课题
【教师】今年南极冰川融化的新闻频繁上热搜。全球变暖的主要原因是什么?如何利用化学手段将无用废气变为有用的资源是解决全球变暖的研究方向之一。科学家提出利用废气二氧化碳加氢制甲醇,一可以减少碳排放,二可以制得清洁能源。

ΔH=-49.0 kJ/mol
本节课的目的就是利用所学知识为该反应投入工业生产确认反应条件。
【学生】倾听思考。
【设计意图】由全球变暖引出利用化学反应将无用物质转化为有用物质是解决环境问题的重要途径之一,认识到化学学科在生产生活中具有的重要意义。
环节二:综合预测反应条件
任务一:回顾反应的影响因素和选择条件时的思考角度
【教师】如果你作为实际生产者,你需要考虑哪些方面?尽可能有序、完整地进行思路表达。
【学生】思考、回答。
针对化学反应角度:平衡转化率大、速率快;
针对实际生产角度:安全、成本、方便、环保...
涉及的影响因素:浓度(投料比)、气体压强、温度、催化剂等。
【设计意图】尽可能引导学生系统、有序地思考条件因素和优化角度,形成思维模型。
任务二:综合预测反应条件
【资料】以二氧化碳和氢气为原料合成甲醇时,通常存在着以下反应:


ΔH=+41.2 kJ/mol
【教师】1.主副反应的特点有哪些?
2.理论预测反应条件,填写在学案上。
【学生】讨论、分享。
主反应特点:放热、气体系数和减小。
副反应:吸热,气体系数和不变。
调控目标:提高速率、提高转化率、促进主反应、抑制副反应。
条件选择:高压、低温、提高反应物浓度、加入催化剂。
【教师】整理学生答案,引导学生在增加副反应的思考维度后关注平衡转化率、平衡产率的表达差异;关注催化剂的活性和选择性。
【设计意图】运用反应限度及反应速率的基本知识,从不同角度对主副反应同时进行考量,探讨不同条件的利弊。
环节三:分析实验数据,确定适合的反应条件
任务三:结合资料分析真实实验数据与理论预测是否相符合,优化理论预测的反应条件
【学生】小组讨论,汇报优化结果。
任务四:结合不同小组的汇报内容,进行问题解答,依次分析各因素对该反应的影响
活动一:确定实际投料比的选择
2.氢气的来源:通过电解水产生氢气或通过甲烷水蒸气重整制氢得到氢气,生产成本较高。
【教师】利用问题线,对学生的思维路径进行引导。
1.结合K和Qc关系,你认为提高哪一种反应物用量对平衡移动的影响更大?
3.理想状态时,二氧化碳的转化率=甲醇的产率,结合图像你发现了什么问题?请对发现的问题进行分析,并加以解决。
4.是否有办法提高原料的利用率?
【学生】针对以上问题分析整理。
活动二:确定实际压强的选择
【资料】不同压强对甲醇产率的影响图像
【教师】观察图像,选择合适的反应压强,并说明原因。压强是否越大越好?综合理论数据与实际生产成本等问题优化压强的选择。
【学生】从图中数据变化可看出,压强越高,甲醇的产率越高,但从成本投入角度看,压强越高生产成本越高。
活动三:确定实际催化剂的选择
【资料】催化剂组成的改变对甲醇产率和选择性的影响
【教师】分析实验数据选择合适的催化剂,并说明原因。
【学生】阐述不同催化剂选择的原因。3组优点:选择性100%,没有副产物生成。4组优点:单位时间内生成甲醇的量更多,反应速率快,催化剂活性更好。综合考虑,与其他催化剂相比,3组和4组都有各自的优点,实际生产时可以按需选择。
活动四:确定实际温度的选择
【材料】反应温度与甲醇产率的关系。请关注图中数据的测定标准:其他条件相同时,不同温度下,加入相同催化剂,在相同生产时间段内,测得甲醇的产率。
【教师】理论上,低温有利于合成甲醇,即温度越高甲醇平衡产率越低。结合主副反应的特点及研究化学反应的两个角度,请回答:
1.为何图像中温度升高,实际产率呈先升高后降低的趋势。
2.选择合适的反应温度,并说明原因。
【学生】第一阶段,甲醇的产率随温度的升高而升高。
因为该温度下反应未达平衡,甲醇的产率受速率影响,温度越高,反应速率越快,甲醇的产率越高;温度越高,催化剂的活性越好,反应速率加快。
第二阶段,甲醇的产率随温度的升高而降低。
因素1:该温度下,反应已达平衡状态。温度升高,主反应逆向移动,甲醇的产率降低;
因素2:随着温度的继续升高,催化剂的活性减弱,反应速率减慢,甲醇的产率降低。
【教师】资料中的产率都是一定时间内的数据,并不是平衡转化率和平衡产率。低温条件下有利于甲醇的生产,可实际生产中,低温状态几乎测不到生成物,是因为该温度不处在催化剂的活性范围内。因此确定温度时,通常需要在催化剂的活性温度范围内,研究温度对产率的影响。
【设计意图】通过引导学生阅读资料、图表,针对实验数据进行分析,将抽象的条件预测更直观、具体的呈现出来。引导学生体会实验证据和理论证据的不同特点。提升学生提取信息、应用信息和利用所学知识解决问题的能力。对分析问题的依据,建立理论和实验两个维度。通过理论和实际的联系,学生可以了解理论依据和实验证据对于解决问题各自的贡献。经过上述分析,学生能够意识到工业生产的目的是获得利润,因此选择合成甲醇的适宜条件时,既不能片面追求高转化率,也不能片面追求高反应速率,应选择以较高反应速率获得适当转化率的反应条件。
环节四:归纳总结形成思路
【教师】经过本次项目活动,同学们已经明确了工业废气中二氧化碳和氢气合成甲醇的反应特点以及对其有利的反应条件。事实上,除甲醇外,还有很多化工原料,如甲醛、乙烯、乙醇、二甲醚等,都有可能利用二氧化碳作为碳源进行合成。垃圾是放错地方的资源,这一思路也可以应用在将我们生活中其他废弃物转变为对我们有用物质的合成中去。
【问题】针对一个特定的实际问题,我们能否归纳出调控反应条件的思路和方法?
【学生】针对给定化学反应,根据反应的焓变、气体系数和等特点,初步从平衡和反应速率两个维度明确温度和压强的趋势,综合安全、成本、技术等实际情况以及可能发生的副反应的特点,选择适当反应物的适当浓度和投料比例,同时选择活性和选择性都较强的催化剂,并注意催化剂活性温度范围。最终通过实验数据的验证将这些理论预测落实为具体的反应条件。
【设计意图】通过反应条件的选择与优化的归纳总结,促使学生形成从限度、速率等多角度综合调控化学反应的基本思路。

六、教学反思
本课例采用“微项目式学习”的教学方式,通过情境、问题和活动的设计,以实际问题为教学的任务,以真实情境为教学的载体,以化学知识为解决问题的工具,教学内容和教学过程与学生认知过程中的思维发展路径相一致,与综合问题解决所需的知识发展脉络相一致,这样的教学设计更有利于化学学科素养的落地。
此教学设计是在真实情境中基于学科核心素养建构思维模型的教学,具有以下两个特点:在教学过程中,利用问题了解学生思维路径和思考过程的细节,将抽象的表格和图形转化为可被学生提取利用的化学信息,培养学生建立外界条件、图表和实验结果之间的逻辑关系,让学生学会处理真实情境下问题的方法,分别从外界因素对于化学反应速率和化学平衡的影响这两个角度进行思考,培养了学生“证据推理与模型认知”的学科核心素养;提高了学生对于化学反应速率与化学平衡的认知水平,通过真实情境中的化学反应调控问题,认识到化学变化有一定的限度和速率,是可以通过改变外界条件进行调控的,在分析改变外界条件对于复杂体系影响时,也能从多角度分别进行具体的分析,解决简单的实际问题,培养了学生“变化观念与平衡思想”的学科核心素养。
探讨如何利用工业废气中的二氧化碳合成甲醇——
化学反应条件优化任务单
任务一:如果你作为实际生产者,你需要考虑哪些方面?
任务二:综合预测反应条件


ΔH=+41.2 kJ/mol
小组活动:1.主副反应的特点有哪些?
2.理论预测反应条件,填写在学案上。

表1 整理主反应和副反应特点
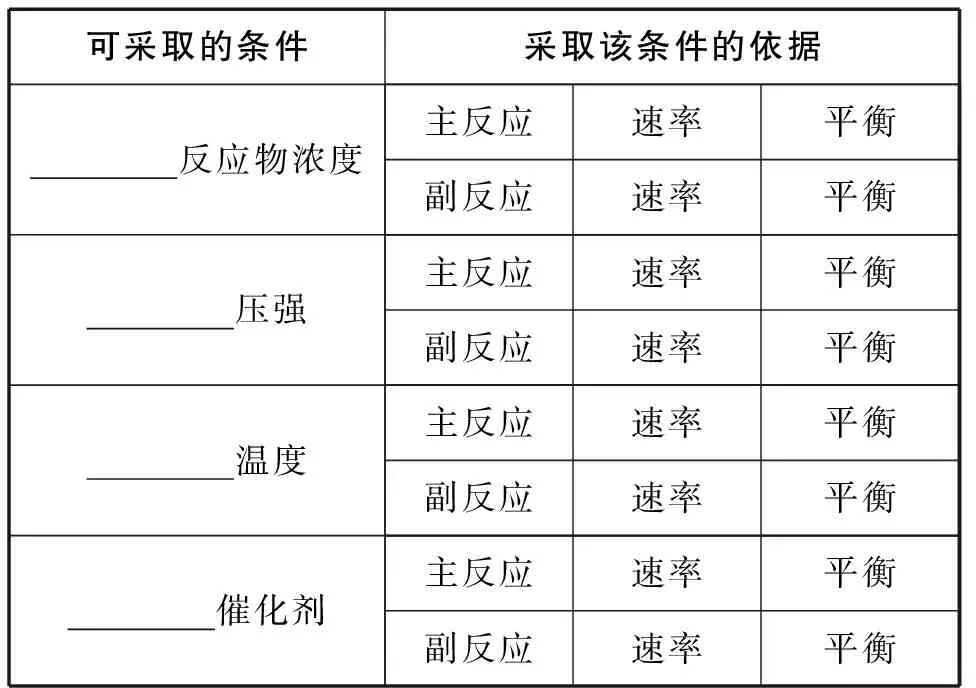
表2 理论预测反应条件
任务三:根据理论预测,查阅资料中的真实实验数据
小组活动:结合问题,优化反应条件

浓度(投料比)压强温度催化剂
资料数据单
一、浓度资料
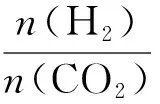
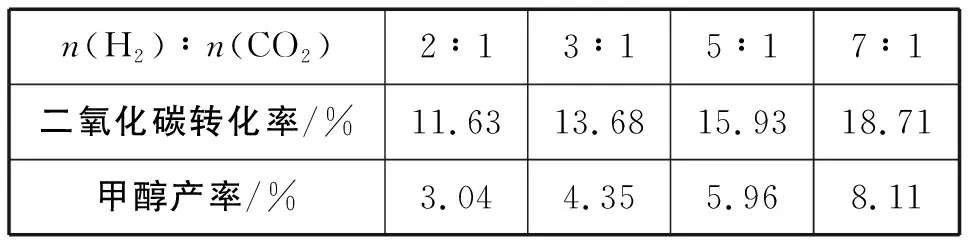
n(H2)∶n(CO2)2∶13∶15∶17∶1二氧化碳转化率/%11.6313.6815.9318.71甲醇产率/%3.044.355.968.11
(2)在等温条件下,若气体的总压不变,则气体的总投料量相同。
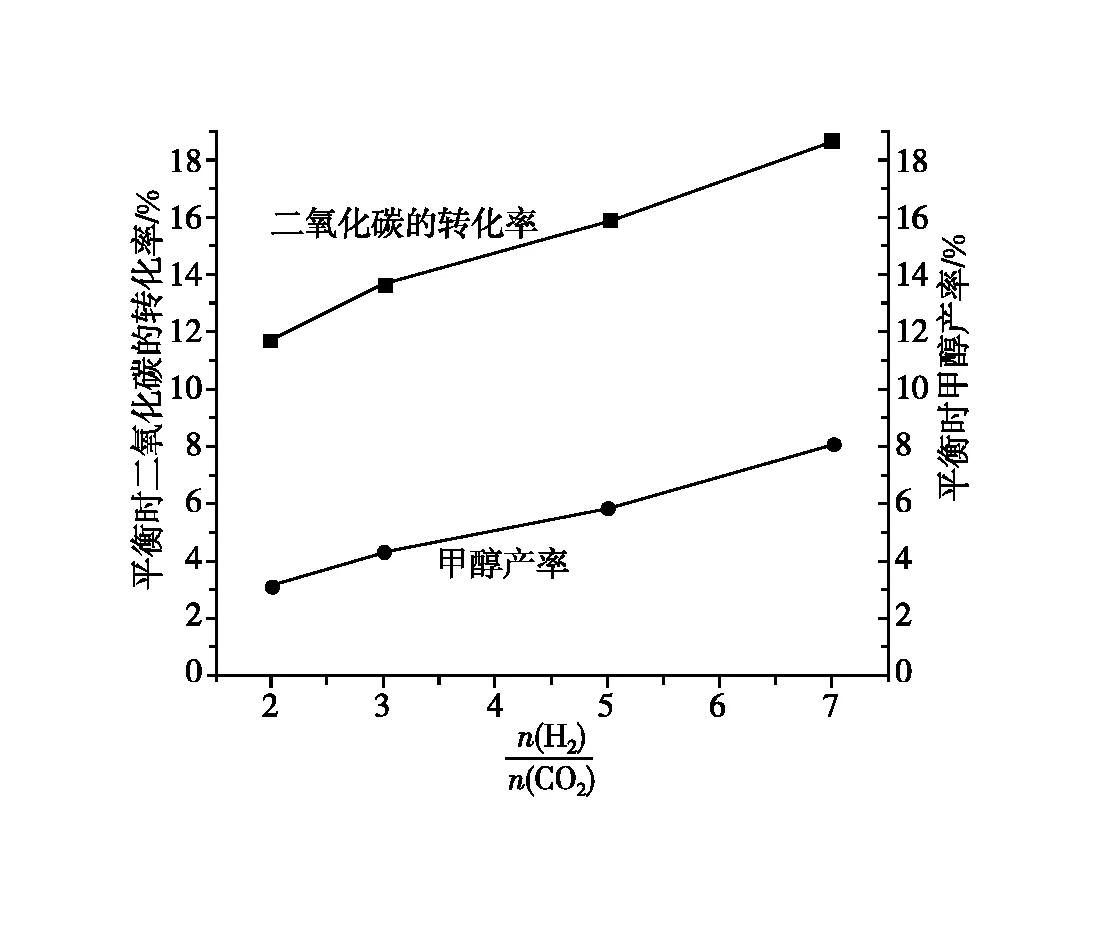
图1 不同对二氧化碳的转化率及甲醇的产率的影响
资料2:氢气的来源:通过电解水产生氢气或通过甲烷水蒸气重整制氢得到氢气,生产成本较高。
小组讨论:
1.结合K、Qc关系,提高哪一种反应物浓度对平衡移动影响更大?
3.理想状态时,二氧化碳的转化率=甲醇的产率,结合图像你发现了什么问题?请对发现的问题进行分析,并加以解决。
二、压强资料
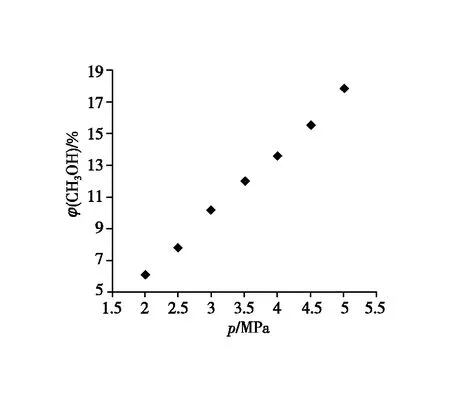
图2 反应压强与甲醇产率的关系
小组讨论:
1.观察图像,选择合适的反应压强,并说明原因?
三、催化剂资料
资料1:催化剂组成的改变对甲醇产率和选择性的影响
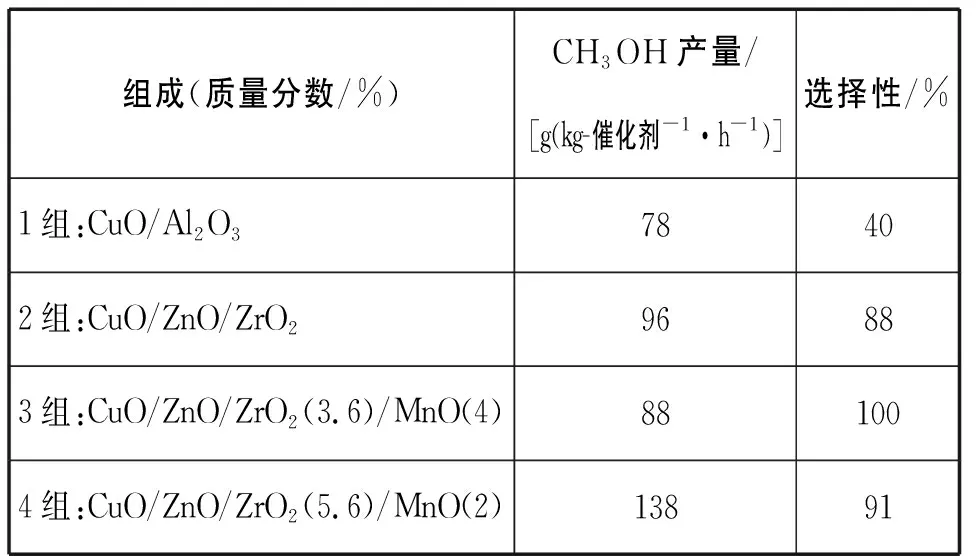
组成(质量分数/%)CH3OH产量/[g(kg-催化剂-1·h-1)]选择性/%1组:CuO/Al2O378402组:CuO/ZnO/ZrO296883组:CuO/ZnO/ZrO2(3.6)/MnO(4)881004组:CuO/ZnO/ZrO2(5.6)/MnO(2)13891
(2)选择性:生成甲醇的二氧化碳在全部二氧化碳反应物中所占的比例。
(3)甲醇产量/[g·(kg-催化剂-1·h-1)]:单位质量催化剂在单位时间内所获得的产物质量;常用于评价催化剂活性。
小组讨论:
1.分析实验数据选择合适的催化剂,并说明原因?
四、温度资料
其他条件相同时,不同温度下,加入相同催化剂,在相同生产时间段内,测得甲醇的产率。
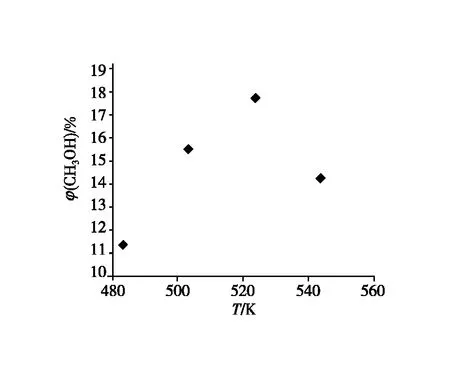
图3 反应温度与甲醇产率的关系
(2)以CuO为主要活性成分的铜基催化剂是目前二氧化碳加氢合成甲醇研究的主要对象之一,这种催化剂的活性温度范围通常为433~543 K。
小组活动:
理论上,低温有利于合成甲醇,即温度越高甲醇平衡产率越低。结合主副反应的特点及研究化学反应的两个角度,请回答:
1.选择合适的反应温度,并说明原因?
