小鼠成肌细胞低氧/复氧模型的建立及验证*
2023-08-07席婷姚晓光胡君丽
席婷, 姚晓光, 胡君丽
小鼠成肌细胞低氧/复氧模型的建立及验证*
席婷1, 姚晓光2△, 胡君丽2
[1新疆医科大学研究生学院,新疆 乌鲁木齐 830001;2新疆维吾尔自治区人民医院高血压中心,新疆高血压研究所,国家卫生健康委高血压诊疗研究重点实验室,新疆维吾尔自治区重点实验室“新疆高血压病研究实验室”,新疆高血压(心脑血管)疾病临床医学研究中心,新疆 乌鲁木齐 830001]
构建体外小鼠成肌细胞间歇性低氧/复氧模型并验证。设定三气培养箱的混合气中1%或4% O2含量为低氧培养条件,二氧化碳培养箱中的条件为复氧条件,将小鼠成肌细胞(C2C12)分别按不同氧浓度(1%和4%)及复氧循环周期(6 h和8 h)处理,结束后观察细胞增殖情况,测定细胞培养液中葡萄糖、乳酸脱氢酶(lactic dehydrogenase, LDH)及分泌性蛋白质分子——含III型纤连蛋白结构域蛋白5(fibronectin type III domain containing 5, FNDC5)浓度,测定细胞低氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)蛋白的表达水平。(1) 1%低氧浓度组较4%低氧浓度组细胞增殖慢、FNDC5含量低,培养液中葡萄糖浓度高、LDH活性及细胞中HIF-1α蛋白表达较高(<0.05)。(2)1%低氧浓度条件下,与循环周期6 h组相比,循环周期8 h组细胞活力显著下降(<0.05)。本研究模拟了体外小鼠成肌细胞在不同低氧/复氧条件下的损伤状况及FNDC5的差异表达,1%低氧浓度和复氧循环周期6 h可作为较佳的体外C2C12细胞实验模型建立条件。
小鼠成肌细胞;间歇性低氧;含III型纤连蛋白结构域蛋白5;缺氧诱导因子1α
阻塞性睡眠呼吸暂停(obstructive sleep apnea, OSA)是一种常见的睡眠呼吸障碍性疾病,可引发或加重心脑血管疾病并导致代谢紊乱,尤其与高血糖、胰腺β细胞凋亡、胰岛素抵抗之间存在显著关联[1-2]。间歇低氧可导致胰腺组织氧化应激状态和胰腺β细胞凋亡,OSA与血糖异常两者在神经-内分泌-代谢方面关系复杂、相互影响。骨骼肌运动后产生一种分泌性蛋白质分子——含III型纤连蛋白结构域蛋白5(fibronectin type III domain containing 5, FNDC5),裂解后释放出一种多肽物质鸢尾素(irisin),可作用于脑、肝、心脏、骨骼肌等,在降低血糖中起着重要的作用[3],已有研究提示该物质可能参与2型糖尿病(type 2 diabetes mellitus, T2DM)的进展[4],而血清FNDC5水平也与OSA发生及发展有关。曹冰等[5]研究显示合并较不合并有OSA的T2DM患者血清Irisin水平低。目前间歇性低氧对骨骼肌相关的葡萄糖代谢中间途径尚不完全明确,有关体外骨骼肌细胞间歇性低氧诱导模型仍处在探索阶段。
细胞低氧-复氧模型被广泛的用于机体缺血再灌注研究,有以下两种造模方法,物理性造模方法的难点在于实验条件的控制和低氧状态的平衡与维持;化学性造模方法的难点主要是造成实验所需低氧状态所需化学试剂的作用剂量及作用时间的选择。因此,模型成功的建立需要在实验的过程中针对不同细胞及不同的实验要求,摸索适合的造模方法。本实验选取肌源性祖细胞-成肌细胞作为研究对象,观察在不同程度低氧-复氧条件下,体外培养的小鼠成肌细胞活力、损伤情况、低氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)及FNDC5等相关指标变化,对于后续OSA致糖尿病的发病机制研究具有参考意义。
材料和方法
1 主要材料
C2C12小鼠成肌细胞购自武汉普诺赛生命科技有限公司。
2 主要试剂与仪器
胎牛血清(fetal bovine serum, FBS)购自依科赛生物公司;磷酸盐缓冲液(phosphate-buffered saline, PBS)粉剂购自北京中杉金桥生物公司;CCK-8检测试剂盒购自北京全式金生物技术有限公司;小鼠FNDC5 ELISA试剂盒购自武汉华美生物公司;抗HIF-1α抗体购自Abcam;蛋白预染Marker购自北京索莱宝科技有限公司;葡萄糖测定试剂盒、乳酸脱氢酶(lactic dehydrogenase, LDH)测试盒购自南京建成生物工程研究所;胰酶(0.25% Trypsin-EDTA)及DMEM(高糖)培养基均购自赛默飞世尔科技(中国)有限公司;PVDF膜(0.45 μm)购自Millipore。ChemiScope 3000化学发光仪购自上海勤翔科学仪器有限公司;酶标仪购自Bio-Rad;三气培养箱购自上海力申科学仪器有限公司;CO2细胞培养箱购自上海力康仪器有限公司。
3 方法
3.1试剂配制10%血清DMEM(高糖)培养液:10 mL的FBS加入90 mL的DMEM(高糖)培养液中,添加1 mL的青-链霉素双抗溶液;10% CCK-8溶液配制:按照CCK-8与完全培养基1∶9比例配制10% CCK-8检测溶液。
3.2细胞培养(1)细胞复苏:从液氮中取出冻存的细胞,置于37 ℃水浴中快速晃动冻存管2 min,加入到DMEM(高糖)培养液,离心弃上清,将细胞接种到培养瓶中,放入37 ℃、饱和湿度、5% CO2细胞培养箱中培养。(2)细胞传代:取出细胞,弃去培养液,加入3 mL无菌PBS缓冲液反复冲洗后弃去,加入1 mL的胰酶,使胰酶溶液平铺在细胞层面上,缓缓摇动细胞培养瓶,并放于37℃培养箱中消化1~2 min,加入1 mL的DMEM培养液终止胰酶的消化作用,并用吸头反复冲洗培养瓶底将未脱落的细胞冲洗下来后离心,并用2 mL的DMEM培养液重悬沉淀的细胞,倒置显微镜下观察细胞,并调整合适的细胞密度接种到培养瓶中,37 ℃,饱和湿度,5% CO2细胞培养箱中培养。(3)取生长状态良好,融合率达90%的C2C12细胞,用完全培养液制备成密度为每5×104/mL个单细胞悬液,用于不同氧浓度条件下的培养实验。
3.3不同氧浓度培养条件下的细胞培养将上述C2C12细胞随机分为5个组进行培养,各组气相培养环境的培养液、温度及湿度同前。低氧浓度、低氧-复氧循环次数分别如下:
(1) 正常对照(control)组:常氧条件下培养;1%间歇低氧(intermittent hypoxia, IH) 6 h组(IH6-1%组):即1%的O2低氧60 min,20%的O2复氧30 min,低氧和常氧交替进行4个循环,共培养6 h;IH6-4%组:即4%的O2低氧60 min,20%的O2复氧30 min,低氧和常氧交替进行4个循环,共培养6 h;IH8-1%组:即1%的O2低氧60 min,20%的O2复氧30 min,低氧和常氧交替进行5个循环,继续30 min的低氧,共培养8 h;IH8-4%组:即4%的O2低氧60 min,20%的O2复氧30 min,低氧和常氧交替进行5个循环,继续30 min的低氧,共培养8 h。
4 主要观察指标检测
4.1细胞形态学观察各组细胞处理完成后,在倒置光学相差显微镜下观察细胞形态及贴壁细胞的数量变化。
4.2CCK-8检测细胞活力各组细胞处理完成后,每孔加入CCK-8溶液,常氧条件下在培养箱中孵育,1 h后用酶标仪测定450 nm处的吸光度()值。
4.3生化试剂盒检测细胞培养上清液中LDH水平及葡萄糖(glucose, GLU)浓度各组细胞处理完成后,收集各组细胞上清,进行生化指标检测。参照LDH测定试剂盒和GLU测定试剂盒实验操作说明进行测定,计算公式:葡萄糖浓度(mmol/L)=(测定值-空白值)/(标准值-空白值)×标准品浓度(5.5 mmol/L);LDH浓度(U/L)=(测定值-对照值)/(标准值-空白值)×标准品浓度(0.2 μmol/L)×1 000。
4.4ELISA试剂盒检测细胞培养上清液中FNDC5水平采用ELISA试剂盒进行以下试剂配制。在样本孔中加入细胞培养上清液100 μL,晃动混匀后覆板贴,37 ℃温育2 h,弃去液体,甩干。加生物素标记抗体工作液100 μL,覆板,37 ℃温育1 h。弃去孔内液体,甩干,洗板3次。每次浸泡2 min,每孔200 μL,甩干。每孔加辣根过氧化物酶标记亲和素工作液100 μL,覆板,37 ℃温育1 h。弃去孔内液体,甩干,洗板5次。每次浸泡2 min,每孔200 μL,甩干。每孔加底物溶液后加终止溶液50 μL,终止反应。用酶标仪在450 nm波长处依序测量各孔的值。
4.5Western blot检测细胞中HIF-1α蛋白的表达水平(1)将收集的细胞冷PBS漂洗,离心弃上清,加入100 μL RIPA裂解液,在玻璃匀浆器冰上充分匀浆,冰浴放置1 h后离心收集上清。(2)加入适量5×SDS-PAGE上样缓冲液(含β-巯基乙醇),100 ℃沸水加热处理5 min,使蛋白充分变性,离心取上清备用。(3)样品及预染蛋白每孔上样25 μg。(4)电泳:80 V恒压使溴酚蓝至分离胶处,恒压100 V,90 min,溴酚蓝到达较底部时,停止电泳。(5)转膜:SDS-PAGE结束后,将PVDF膜在甲醇中浸泡10 s,蒸馏水中漂洗1 min,制备转膜“三明治”,夹子的黑色面在下,依次是海绵—滤纸—胶—PVDF膜—滤纸—海绵—夹子的透明面,恒压转膜,电压100 V,β-actin转膜时间为60 min,HIF-1α转膜时间为90 min。(6)转膜后将PVDF膜水洗3次,每次5 min,用含5%脱脂奶粉的封闭液封闭转印膜1 h,用TBST稀释Ⅰ抗,4 ℃孵育过夜后加2 mL至膜上,用ChemiScope mini化学发光仪检测、拍照。
5 统计学处理
运用SPSS 25.0软件对各组数据进行统计学分析。所有计量数据采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,进一步两组间比较采用LSD方法。以<0.05为差异有统计学意义。
结果
1 倒置显微镜下各组细胞形态改变
细胞图像通过显微镜(×400)摄取,正常对照组细胞贴壁生长,形态饱满,排列紧密,多呈梭型、多角形,细胞边缘完整清晰;间歇性缺氧组成肌细胞正常形态被破坏,生长缓慢,部分细胞脱落;其中IH8-1%组形态变化更明显,部分细胞融合成片,死细胞悬浮在培养液中。见图1。
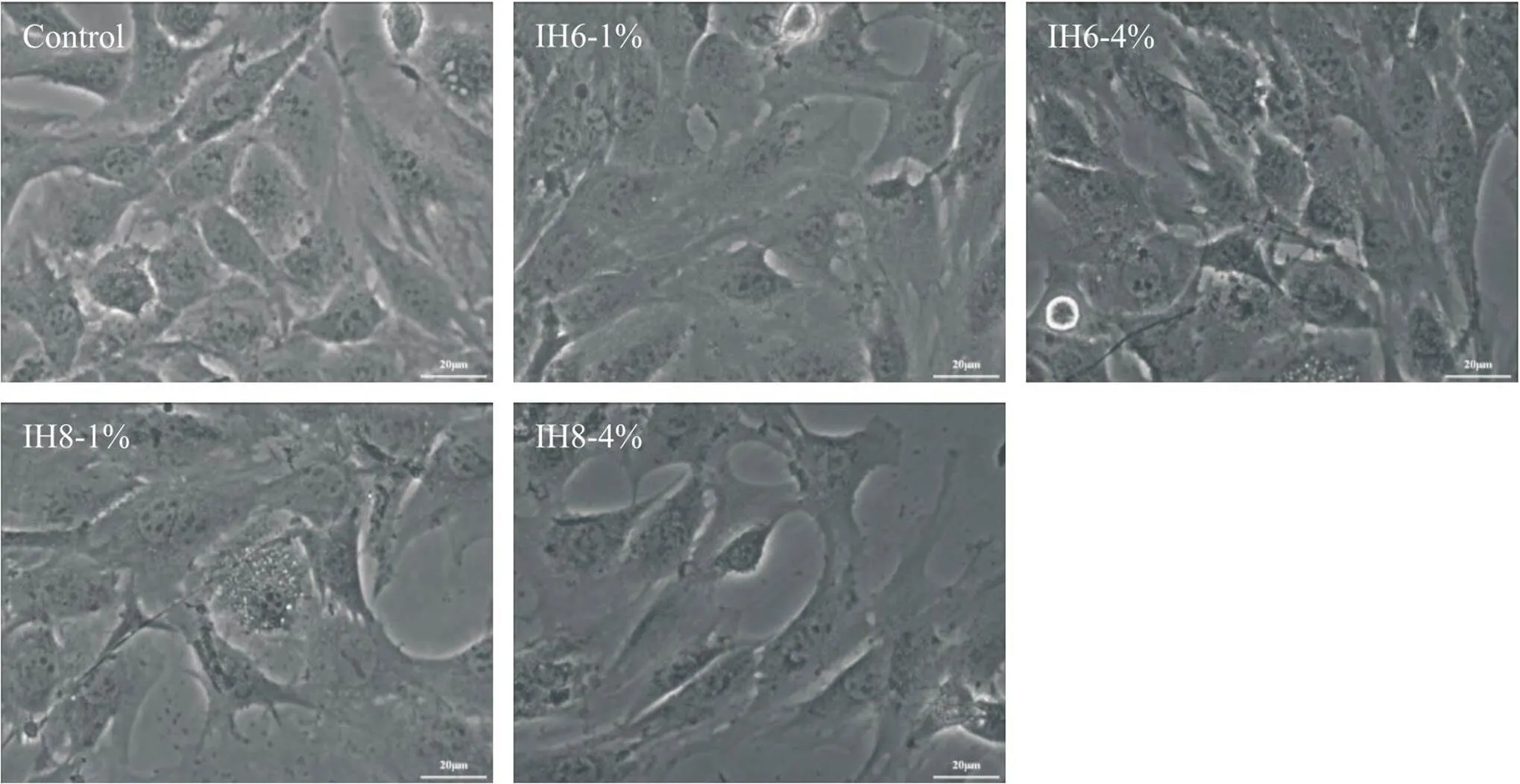
Figure 1. Morphological changes in C2C12 cells after treated with different oxygen concentrations and hypoxia-reoxygenation cycles. Observation under the microscope revealed that cells in the control group exhibited a large spherical shape with tightly arranged spindle-shaped or polygonal cells, having clearly demarcated cell edges.The normal morphology of cells in the IH groups was disrupted, with slow growth, indistinct cell boundaries, and some cell shedding. The IH8-1% group showed the most significant morphological changes, with cell swelling and cell fusion in some locations, accompanied by some suspended necrotic cells. The scale bar=20 μm.
2 细胞活力检测及细胞培养上清液中LDH含量测定
与对照组相比,间歇性缺氧组细胞活力均下降,IH6-1%组、IH8-1%组细胞活力分别低于IH6-4%组、IH8-4%组,结果均有显著差异(0.05);LDH含量在低氧复氧4个循环(IH6)组中出现了轻度增加,而在低氧复氧5个循环(IH8)组中显著增加。实验IH8-1%组细胞活力最低、LDH含量最高,与对照组、IH8-4%、IH6-1%、IH6-4%组相比结果均有显著差异(0.05),见表1。

表1 不同分组细胞活力、LDH含量比较
△0.05control group;▲0.05IH6-1% group;▽0.05IH6-4% group;▼0.05IH8-1% group.
3 细胞培养液中葡萄糖和FNDC5浓度测定
在低氧复氧5个循环(IH8)组中,IH8-1%组葡萄糖浓度高于IH8-4%组;而IH8-1%组FNDC5浓度组低于IH8-4%组,结果均有显著差异(0.05)。在低氧复氧4个循环(IH6)组中IH6-1%组葡萄糖浓度高于IH6-4%组;IH6-1%组FNDC5浓度低于IH6-4%组,但差异均无统计学意义(>0.05),见表2。

表2 不同分组细胞培养液上清中GLU、FNDC5浓度比较
△0.05control group;▲0.05IH6-1% group;▽0.05IH6-4% group;▼0.05IH8-1% group.
4 Western blot检测细胞中HIF-1α蛋白表达
成肌细胞HIF-1α蛋白主要表达在细胞核中,与对照组比较,实验组HIF-1α蛋白表达水平明显增加,结果均有显著差异(0.05)。其中IH8-1%组HIF-1α蛋白表达水平最高,与IH6-1%、IH6-4%组比较均有显著差异(0.05),见图2、表3。

Figure 2. The protein expression of HIF-1α was detected by Western blot.

表3 不同分组的小鼠成肌细胞中HIF-1α蛋白表达水平
△0.05control group;▲0.05IH6-1% group;▽0.05IH6-4% group.
讨论
OSA患者低氧程度和低氧时间对于对糖尿病的发生发展均有重要作用。本研究利用小鼠成肌细胞体外实验,观察了不同氧浓度和低氧复氧时间条件下C2C12细胞变化,结果显示低氧-复氧环境中氧浓度和循环时间对C2C12细胞增殖、活力及其分泌的FNDC5浓度均有影响,进而影响葡萄糖代谢。与人体心肌细胞浓度(2%~6%)[6]相比,骨骼肌细胞在发育中处于低氧(3.6%~4.0%)微环境[7],但目前尚无准确定义OSA事件期间动物骨骼肌细胞氧浓度的数据。本研究选取轻度低氧1%、生理性低氧4%两个低氧条件,该低氧条件与Martin等[8]研究模拟C2C12小鼠成肌细胞相似,持续暴露24 h观察细胞功能受损状况。蔡晓红[9]等自主研发设计细胞氧舱,建立人肺腺癌细胞A549的低氧体外模型,设置低氧60 min/复氧30 min,6个循环。Wang等[10]研究建立人内皮细胞不同间歇低氧模式的体外模型,设定不同复氧时间(0.25 min/1.75 min/5.25 min/8.25 min)及循环时间(6.32 h/9.32 h/12 h/20 h),即不同种类细胞体外研究的低氧及复氧持续时间各不相同。本研究考虑到骨骼肌细胞耐低氧能力比较强,培养箱气相的平衡并不瞬时,气体置换需要一定时间,为达到所需的低氧浓度,故本研究加以改进,设置低氧/复氧时间60 min/30 min,交替6/8个循环模拟低氧模型,结果显示低氧-复氧时间延长将降低C2C12成活率。在间歇性低氧条件下,人体细胞可以将其主要代谢策略从主要的线粒体呼吸转向糖酵解速率的增加,糖酵解的变构调节与低氧诱导因子密切相关,其主要负责上调葡萄糖转运蛋白和糖酵解酶的转录[11],有利于在低氧条件下维持能量代谢。HIF由多个亚单位组成,其中HIF-1α在低氧应答的调控机制中起着核心作用。在本实验中,IH6-1%组和IH8-1%组在相同的低氧浓度下,随低复氧循环时间延长,HIF-1α蛋白表达含量增加显著;IH8-1%组和IH8-4%组在相同的复氧循环时间下,氧浓度较低者,HIF-1α蛋白表达含量增加更多,即供氧浓度越低,暴露时间越长,细胞HIF-1α蛋白表达量越高。这与Chávez等[12]较早在持续低氧大鼠脑组织中HIF-1α的表达实验结果有所不同,该研究在持续低氧(10%)的条件下,在第12 h时HIF-1α表达达到高峰,随后含量逐渐下降,第21 h时恢复至基础水平,这可能与组织对低氧的适应性调节有关,这同时也提示间断低氧不同于持续低氧,这种特殊的高频率的低氧模式,低氧程度更重,对组织的损害更大。LDH通常用来衡量细胞膜损伤程度,本实验中IH8组LDH含量高于IH6组,且IH8-1%组显著高于IH8-4%组,这提示低氧诱导成肌细胞的氧化应激反应,可能不仅取决于低氧的程度,还取决于复氧的频率,这与李宏杰等[13]研究结果一致。
Boström等[14]最先在小鼠肌肉组织中检测到FNDC5,在体内经过剪切和修饰后转变形成肌肉因子Irisin,上调棕化相关基因和UCP-1蛋白的表达[15],加速能量消耗,促进骨骼肌对葡萄糖的吸收,改善糖耐量和胰岛素抵抗[16]。在我们研究中观察到IH8-1%组FNDC5表达量最低,较IH6-1、IH6-2组有统计学差异,这也间接证明在细胞模型基础上低氧可能通过引起FNDC5下降,导致血糖代谢紊乱。在4组实验中,IH8-1%组细胞损伤严重,凋亡明显,参与氧化应激的HIF-1α蛋白表达含量最高,而在糖代谢通路中的FNDC5的表达量最低,致培养液中葡萄糖含量最高,但该组较IH6-1%组活力低,循环周期长,IH6-1%组同样在细胞损伤、生化指标、FNDC5等方面与其他各组有统计学差异,故认为IH6-1%组为较佳处理组。
细胞研究作为与整体动物研究互补的研究手段,既能够模拟活体细胞一系列病理生化改变,又具有条件可控、样本均一可比、重复性强的优点,但本研究仍有不足之处:(1)细胞生长在几毫米厚的培养液中,溶解在培养液中的氧气受气体扩散和自由对流等的影响,由于本实验条件有限,未能动态测定培养箱中的氧浓度;(2)在低氧阶段结束时,未测定各个观察指标数值。总之,本研究通过对低氧浓度及复氧循环时间两个因素进行把控,较好地模拟了体外小鼠骨骼肌细胞低氧/复氧后损伤状况及FNDC5的差异表达,为OSA致糖代谢通路异常的研究提供良好的实验模型。
[1] Xu H, Liang C, Zou J, et al. Interaction between obstructive sleep apnea and short sleep duration on insulin resistance: a large-scale study: OSA, short sleep duration and insulin resistance[J]. Respir Res, 2020, 21(1):151.
[2]李光, 柴文戍, 康健. 间歇低氧小鼠胰腺β细胞凋亡及其机制的实验研究[J]. 中国病理生理杂志, 2011, 27(4):794-797.
Li G, Chai WS, Kang J. Pancreas of intermittent hypoxia mice β experimental study on apoptosis and its mechanism[J]. Chin J Pathophysiol, 2011, 27(4):794-797.
[3] Huh JY, Panagiotou G, Mougios V, et al. FNDC5 and irisin in humans: I. predictors of circulating concentrations in serum and plasma and II. mRNA expression and circulating concentrations in response to weight loss and exercise[J]. Metabolism, 2012, 61(12):1725-1738.
[4] Moreno-Navarrete JM, Ortega F, Serrano M, et al. Irisin is expressed and produced by human muscle and adipose tissue in association with obesity and insulin resistance[J]. J Clin Endocrinol Metab, 2013, 98(4):769-780.
[5]曹冰, 王莉, 邢钰敏, 等. 2型糖尿病患者血清鸢尾素、摄食抑制因子-1、3-硝基酪氨酸水平与糖脂代谢和阻塞性睡眠呼吸暂停低通气综合征的关系研究[J]. 现代生物医学进展, 2022, 22(20):3887-3891.
Cao B, Wang L, Xing YM, et al. Study on the relationship between the levels of serum iris, feeding inhibitor-1, 3-nitrotyrosine, glucose and lipid metabolism and obstructive sleep apnea hypopnea syndrome in patients with type 2 diabetes[J]. Prog Mod Biomed, 2022, 22(20):3887-3891.
[6] Mas-Bargues C, Sanz-Ros J, Román-Domínguez A, et al. Relevance of oxygen concentration in stem cell culture for regenerative medicine[J]. Int J Mol Sci,2019, 20(5):1195.
[7]张维华, 於丽明, 韩欣欣,等.低氧对骨骼肌成肌细胞增殖分化的影响及相关机制研究进展[J]. 生理科学进展, 2019, 50(5):326-332.
Zhang WH, Yu LM, Han XX, et al. Research progress in the effects of hypoxia on the proliferation and differentiation of skeletal muscle myoblasts and related mechanisms [J]. Prog Physiol Sci, 2019,50 (5):326-332 .
[8] Martin N, Aguilar-Agon K, Robinson GP, et al. Hypoxia impairs muscle function and reduces myotube size in tissue engineered skeletal muscle[J]. J Cell Biochem, 2017, 118(9):2599-2605.
[9]蔡晓红,洪芳芳,陈利亚, 等.一种改良的间歇性低氧细胞模型方法[J]. 中国病理生理杂志,2016,32(1):187-192.
Cai XH, Hong FF, Chen LY, et al. An improved method for intermittent hypoxia cell model [J]. Chin J Pathophysiol, 2016,32 (1): 187-192.
[10] Wang J, Li X,Endothelial dysfunction in a cell culture model exposed to various intermittent hypoxia modes[J]. High Alt Med Biol, 2020, 21(4):388-395.
[11] Semenza G L. HIF-1 mediates metabolic responses to intratumoral hypoxia and oncogenic mutations[J]. J Clin Invest, 2013, 123(9):3664-3671.
[12] Chávez J C, Agani F, Pichiule P, et al. Expression of hypoxia-inducible factor-1alpha in the brain of rats during chronic hypoxia[J]. J Appl Physiol, 2000, 89(5):1937-1942.
[13] 李宏杰, 章广玲, 张连元, 等. 一种用于研究骨骼肌缺血/再灌注损伤的细胞模型[J]. 中国应用生理学杂志, 2005, 21(3):356-358.
Li HJ, Zhang GL, Zhang LY, et al. A cell model for studying skeletal muscle ischemia/reperfusion injury[J]. Chin J Appl Physiol, 2005, 21(3):356-358.
[14] Boström P, Wu J, Jedrychowki MP, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]. Nature, 2012, 481(7382):463-468.
[15] Korta P, Pocheć E, Mazur-Bialy A. Irisin as a multifunctional protein: implications for health and certain diseases[J]. Medicina (Kaunas), 2019, 55(8):485.
[16] Lee P, Linderman JD, Smith S, et al. Irisin and FGF21 are cold-induced endocrine activators of brown fat function in humans[J]. Cell Metab, 2014, 19(2):302-309.
Establishment and verification of a mouse myoblast hypoxia/reoxygenation model
XI Ting1, YAO Xiaoguang2△, HU Junli2
[1,830001,;2,,,"",(),830001,]
To establish anmouse myoblast model of intermittent hypoxia/reoxygenation.An O2content of 1% or 4% in the mixture in a three-gas incubator was established as the hypoxic culture condition, and the environment in a carbon dioxide incubator was established as the reoxygenated culture condition. Mouse myoblasts (C2C12) were exposed to different oxygen concentrations (1% and 4%) and reoxygenation cycles (6 h and 8 h). Then, cell proliferation was detected, and concentrations of glucose, lactate dehydrogenase (LDH) and fibronectin type III domain containing 5 (FNDC5) in C2C12 cell culture medium were measured. In addition, the expression level of the hypoxia-inducible factor-1α (HIF-1α) protein of C2C12 cells under different experimental conditions was detected by Western blot.(1) The 1% oxygen concentration group showed slower cell proliferation, lower FNDC5 content, and higher glucose levels in culture medium, LDH activity, as well as higher HIF-1α protein expression compared to the 4% oxygen concentration group (<0.05). (2) Under 1% oxygen concentration, the 8 h cycle group showed significantly decreased cell viability compared to the 6 h cycle group (<0.05).This study simulates the differences in injury status and FNDC5 expression in mouse myoblasts under different hypoxia/reoxygenation conditions. A 1% oxygen concentration and reoxygenation cycle of 6 hours can be used as a better experimental model for C2C12 cells.
mouse myoblasts; intermittent hypoxia; fibronectin type III domain containing 5; hypoxia-inducible factor-1α
1000-4718(2023)07-1339-06
2023-01-30
2023-05-31
0991-8565043; E-mail: yaoxg12345777@163.com
R337.1; R363; R-33
A
10.3969/j.issn.1000-4718.2023.07.023
[基金项目]新疆维吾尔自治区自然科学基金资助项目(No. 2021D01C173)
(责任编辑:李淑媛,余小慧)
