褪黑素对胆红素脑病大鼠脑顶叶皮质AQP4的调控及其保护机制研究*
2023-08-07张茗越周龙洋蒲淞崔爱洁张丽荣陈春燕薛凯歌樊萍甘胜伟
张茗越, 周龙洋, 蒲淞, 崔爱洁, 张丽荣, 陈春燕,薛凯歌, 樊萍, 甘胜伟,△
褪黑素对胆红素脑病大鼠脑顶叶皮质AQP4的调控及其保护机制研究*
张茗越1, 周龙洋1, 蒲淞1, 崔爱洁1, 张丽荣2, 陈春燕2,薛凯歌2, 樊萍3, 甘胜伟1,2△
(1重庆医科大学基础医学国家级实验教学示范中心,重庆 400016;2重庆医科大学基础医学院神经科学研究中心,重庆 400016;3重庆市第五人民医院妇产科,重庆 400062)
研究脑顶叶皮质水通道蛋白4(aquaporin 4, AQP4)在褪黑素(melatonin, MT)治疗胆红素脑病(bilirubin encephalopathy, BE)中的表达变化,以及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)/蛋白激酶C(protein kinase C, PKC)信号通路在MT对AQP4调控中的作用,以探讨MT对BE的治疗机制。80只出生5~7 d的健康SD乳鼠,根据其处理方式,随机分为以下5组:假手术组、BE模型组、MT干预组、PKC抑制剂(PKC inhibitor, PKCi)干预组和mTOR抑制剂(mTOR inhibitor, mTORi)干预组。采用HE染色和尼氏染色检测各组鼠脑皮质病理改变;采用干-湿重法测定各组脑顶叶皮质含水量;应用免疫荧光染色法检测脑皮质AQP4的表达区域;运用TUNEL染色法检测脑顶叶皮质神经细胞的凋亡变化;使用Western blot法测定各组鼠脑顶叶皮质AQP4、caspase-3、cleaved caspase-3和PKCε的表达量。HE和尼氏染色显示,MT可减轻胆红素所致神经细胞的损伤。干-湿重法结果显示,MT可降低BE乳鼠脑顶叶皮质脑含水量。免疫荧光染色显示,BE组AQP4荧光强度增加,主要表达于大脑顶叶皮质血管壁和星形胶质细胞膜;MT干预可阻止BE所致AQP4表达的增加。TUNEL染色显示,MT可减少BE所致细胞凋亡。Western blot显示,与假手术组相比,BE组脑顶叶皮质AQP4、cleaved caspase-3和caspase-3表达增加,PKCε表达降低;MT干预可降低BE鼠顶叶皮质AQP4、cleaved caspase-3和caspase-3表达,增加PKCε表达。PKCi和mTORi均可下调PKCε的表达,阻止MT通过mTOR/PKC信号通路降低AQP4的表达。MT可通过减少BE大鼠脑顶叶皮质中AQP4的表达来缓解脑水肿,并减少caspase-3介导的神经细胞凋亡。MT下调AQP4表达的机制与mTOR/PKC信号通路的激活有关。
胆红素脑病;褪黑素;水通道蛋白4;mTOR/PKC信号通路
胆红素脑病(bilirubin encephalopathy, BE)是由于新生儿血液中未结合胆红素(unconjugated bilirubin, UCB)水平升高,透过尚未成熟的血脑屏障入脑,对脑细胞产生严重损伤的疾病。它是新生儿高胆红素血症的严重并发症之一,病死率及致残率高,约50%~75%的患儿死于急性期,而幸存者绝大多数仍留有各种严重的神经系统后遗症,如智力低下、听觉受损、发育障碍等[1],给患者及其家庭带来很大负担。
水通道蛋白4(aquaporin 4, AQP4)是脑中表达量最多、水转运功能最强的水通道蛋白,参与星形胶质细胞水平衡功能的调控[2]。AQP4的表达异常将导致细胞水平衡功能异常,引起细胞毒性脑水肿的发生[3-4],进而使细胞膜通透性增加,导致UCB更易通过扩散作用进入细胞产生毒性作用[5]。本组的前期研究证实,UCB的神经毒性将增加大脑皮质AQP4的表达[6],而在BE模型中发现,脑血管周围的星形胶质细胞足突会产生水肿[7],而该部位正是AQP4在脑中的极性分布区域之一[8-9],提示UCB可能促进星形胶质细胞足突AQP4表达的增加,导致脑内水转运失衡及神经细胞水肿的发生,而神经细胞水肿将导致其对UCB的神经毒性敏感性增加[5]。另外,UCB对神经细胞的毒性作用还可通过引起细胞内Ca2+超载、内质网相关凋亡等途径激活凋亡关键酶caspase-3,促使蛋白酶家族呈级联式激活,导致神经细胞凋亡[10]。由此可见,UCB导致的脑水肿是由AQP4介导的细胞毒性水肿[7],并可加重UCB对星形胶质细胞和神经元的神经毒性作用,最终导致神经细胞凋亡。
褪黑素(melatonin, MT)是由哺乳动物和人类的松果体产生的吲哚类神经内分泌激素,有很强的自由基清除能力和间接抗氧化作用[11]。MT具有高脂溶性,使其容易透过血脑屏障和细胞膜进入神经元,对包括BE在内的多种神经性疾病发挥保护作用[11-13]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种丝氨酸/苏氨酸蛋白激酶,可与不同的亚基相互结合形成mTOR复合体1(mTOR complex 1, mTORC1)和mTORC2两个复合体,其中mTORC2可通过TOR序列调控下游效应子蛋白激酶C(protein kinase C, PKC)疏水基序的磷酸化而调节其活性[14-15]。有研究表明,MT可以激活星形胶质细胞和神经元中mTOR/PKC途径[16-18],降低细胞膜上AQP4的表达[17, 19];另有文献表明,脑卒中模型中PKC的上调也可抑制AQP4的表达[20-22]。同时,MT能够增强脑固有的抗氧化剂状态,抑制细胞内Ca2+水平的升高,进而抑制caspase-3活化,减少神经细胞凋亡[23]。然而,MT是否可通过mTOR信号通路激活PKC,下调AQP4的表达,从而在BE大鼠中发挥脑保护作用,尚未见报道。
本研究采用SD乳鼠制备BE模型,探究MT是否可通过mTOR分子激活下游PKC信号通路,从而降低AQP4表达,以阻止BE中神经细胞的水肿,并下调caspase-3减轻神经细胞凋亡,对抗UCB的神经毒性作用,为临床上使用MT治疗BE提供理论依据和实验基础。
材料和方法
1 材料及动物模型
1.1实验动物SPF级SD孕鼠,由重庆医科大学实验动物中心提供。所有孕鼠均在12 h明/暗环境,(22±1) ℃,采用纯净水和标准啮齿动物饲料喂养。待其分娩后,新生鼠由母鼠喂养至5~7 d,体重(15±2) g备用。
1.2实验材料胆红素(源叶生物);MT(Sigma-Aldrich);PKC抑剂制(PKC inhibitor, PKCi)Ro 31-8220和mTOR抑制剂(mTOR inhibitor, mTORi)Torkinib (PP242)均购自MedChemExpress;兔来源AQP4单克隆抗体、兔来源mTOR多克隆抗体和兔来源PKCε多克隆抗体(Abcam);兔来源caspase-3多克隆抗体和荧光Ⅱ抗(碧云天公司);α-tubulin抗体(Proteintech)。
2 药品配制
2.1胆红素溶液避光称取晶体胆红素5 mg溶于50 μL 0.5 mol/L NaOH溶液中,加入ddH2O 450 μL,使用0.5 mol/L HCl调节pH至8.5,配制成浓度为1.71 mol/ L、pH为8.5的胆红素溶液,将配制好的胆红素溶液置于-20 ℃的黑暗环境中保存。
2.2MT溶液的配制10 mg MT溶于1 mL无水乙醇中,加入19 mL生理盐水,无水乙醇浓度为5%,置于4 ℃环境中保存,现配现用。
2.3Ro 31-8220溶液的配制将0.9 mg Ro 31-8220溶于60 μL DMSO中,充分溶解后再依次加入240 μL PEG300、30 μL Tween-80和270 μL生理盐水,用ddH2O定容至3 mL,置于4 ℃环境下保存。
2.4PP242溶液的配制避光取1 mg PP242粉末溶于0.14 mL无水乙醇中,用生理盐水将无水乙醇稀释至5%,置于4 ℃环境下保存,现配现用。
3 实验动物分组、BE模型的建立及干预组给药
筛选出产后5~7 d的健康SD乳鼠80只,随机分为假手术(sham)组、BE模型(BE)组、MT干预(BE+MT)组、PKCi干预(BE+MT+PKCi)组和mTORi干预(BE+MT+mTORi)组5组,每组16只,参照胡影等[24]的方法制备BE模型及进行如下处理(在进行小脑延髓池注射时,先抽取相应体积的脑脊液,再注射不含胆红素的溶剂或胆红素溶液,避免增加的颅内压对新生乳鼠造成影响):(1)sham组:先腹腔注射注射不含PKCi或mTORi的溶剂67 mL/kg,30 min后腹腔注射不含MT的溶剂10 mL/kg,再30 min后小脑延髓池注射注射不含胆红素的溶剂2 mL/kg;(2)BE组:先腹腔注射注射不含PKCi或mTORi的溶剂67 mL/kg,30 min后腹腔注射注射不含MT的溶剂10 ml/kg,再30 min后小脑延髓池注射胆红素溶液2 mL/kg (即20 mg/kg);(3)BE+MT组:先腹腔注射注射不含PKCi或mTORi的溶剂67 mL/kg,30 min后腹腔注射MT溶液10 ml/kg (即10 mg/kg),再30 min后小脑延髓池注射胆红素溶液2 mL/kg (即20 mg/kg);(4)BE+MT+PKCi组:先腹腔注射PKCi Ro 31-8220溶液67 mL/kg,30 min后腹腔注射MT溶液10 mL/kg (即10 mg/kg),再30 min后小脑延髓池注射胆红素溶液2 mL/kg (即20 mg/kg);(5)BE+MT+mTORi组:先腹腔注射mTORi PP242溶液67 mL/kg,30 min后腹腔注射MT溶液10 mL/kg (即10 mg/kg),再30 min后小脑延髓池注射胆红素溶液2 mL/kg (即20 mg/kg)。在注射胆红素溶液后24 h后取脑,进行后续实验。
4 方法
4.1一般情况及神经行为变化观察造模前及造模后24 h,观察各组乳鼠的一般情况及神经行为学变化并进行对比。观察各组乳鼠体温、皮色、心率、呼吸及其他一般情况,观察是否出现反射丧失或不正常运动,是否出现肌阵挛或肌张力障碍等异常神经行为学变化。并将造模后24 h观察的信息与造模前进行比较。后续取脑时判断脑组织是否有胆红素沉积、血肿或损伤,根据观察信息综合判断是否造模成功。
4.2脑组织含水量测定各组选取6只SD乳鼠,采用干-湿重法测定大鼠脑顶叶皮质含水量。其过程为:取造模成功后的大鼠,腹腔注射戊巴比妥钠麻醉后,断头处死,取脑顶叶皮质,用滤纸吸干脑组织表面血液,放在已标记的锡箔纸上称重,即为脑组织湿重(wet weight, WW);即刻放入100 ℃烤箱烘烤2 d,经过3次称量重量不再变化,即为脑组织干重(dry weight, DW);用公式计算脑含水量。脑含水量=(WW-DW)/WW。
4.3脑切片的制备、HE染色和尼氏染色各组选取5只乳鼠,使用戊巴比妥钠麻醉后于冰上剪开右心耳,经左心室快速灌注0.9 %氯化钠20 mL,采用4%多聚甲醛PBS溶液50 mL继续灌注。断头取脑,将已固定的脑组织置于4%多聚甲醛PBS固定液后固定24 h后,置于10%、20%、30%梯度蔗糖溶液脱水,OCT包埋剂包埋,行冰冻切片,切片厚度10 μm,风干,部分切片进行HE染色及尼氏染色,剩余切片标记后置于-20 ℃冰箱保存待用。
4.4Western blot各组选取5只乳鼠,腹腔麻醉后置于冰上,左心室快速灌注预冷PBS 20 mL。快速断头取脑,分离大脑顶叶皮质,使用含PMSF的细胞裂解液提取蛋白,在冰上匀浆后将裂解液于4 ℃低温离心机中12 000 r/min离心30 min,取上清液,BCA法检测蛋白浓度,使用SDS-PAGE分离蛋白,电转印后使用封闭液封闭PVDF膜,使用AQP4、caspase-3、cleaved caspase-3、PKCε和α-tubulin Ⅰ抗及相应Ⅱ抗进行孵育,DAB显色分析,最终结果使用AQP4/α-tubulin、caspase-3/α-tubulin、cleaved caspase-3/α-tubulin和PKCε/α-tubulin条带灰度比值表示。
4.5免疫荧光染色取冰冻切片,37 ℃复温1 h。用0.01 mol/L PBS漂洗3次,每次10 min。使用1% BSA封闭,盖封口膜放入湿盒,37 ℃封闭1 h。随后滴加AQP4 Ⅰ抗,覆盖组织,置于温盒中4 ℃冰箱过夜。第2天从冰箱中取出后于室温复温1 h,随后0.01 mol/L PBS漂洗3次,每次10 min;擦干,滴加已被荧光标记的Ⅱ抗,37 ℃孵育1 h,0.01 mol/L PBS漂洗3次,每次10 min,使用5% DAPI-甲醇溶液孵育5 min,0.01 mol/L PBS漂洗3次,每次10 min,随后使用50%甘油+50% PBS封片。建立空白对照,使用Ⅰ抗稀释液代替Ⅰ抗外,其余步骤一致。使用激光共焦显微镜(Leica)观察并拍照。
5 统计学处理
应用SPSS 24.0统计软件包进行资料的统计学分析。测定资料数据均以均数±标准误(mean±SEM)表示。采用单因素方差分析进行多组间比较,采用SNK-检验进行组间两两比较。以<0.05为差异有统计学意义。
结果
1 5~7日龄SD乳鼠造模后一般情况
各组乳鼠经相应处理后24 h观察一般情况,可见sham组一般情况良好,无反射丧失或不正常运动,无肌阵挛或肌张力障碍等异常神经行为学变化,对外界刺激反应较强,取脑发现脑组织无异常色素沉积、无血肿或损伤;BE组一般情况较差,对外界反应刺激弱,可见明显角弓反张、不能直线行走、向轻瘫侧转圈或倾倒,部分乳鼠出现肌阵挛、肌张力增高等异常行为学变化,取脑发现脑组织明显黄染,部分区域如第三、四脑室出现明显黄色色素淤积,无异常血肿或脑干、小脑损伤;BE+MT组一般情况较BE组有所改善,对外界刺激一般,可观察到反射减弱及不能直线行走,未观察到肌阵挛、肌张力障碍,取脑后可见脑组织黄染及脑室中黄色色素沉积,无异常血肿或脑干、小脑损伤。
2 MT减轻BE模型大鼠脑皮质损伤
HE染色结果显示,sham组脑皮质神经细胞核染色明显,细胞核完整,排列整齐;BE组脑皮质神经细胞核染色不均,各细胞核染色颜色不一致,与sham组比较,神经细胞排列极性改变,细胞空泡样变;BE+MT组脑皮质细胞染色明显,呈蓝紫色,部分细胞核完整,排列较为整齐,出现少量异常核象,周围组织呈伊红色均染,出现空泡,但数量明显少于BE组,未观察到有异常色素沉积,见图1A。尼氏染色显示,sham组脑皮质神经细胞呈整齐极性排列,染色呈浅蓝色;BE组脑皮质神经细胞极性消失,染色不均,胞体变小,同视野下细胞尼氏体减少,出现大量细胞空泡化;BE+MT组脑皮质神经细胞数量较少,尼氏体减少,但较BE组有所好转,见图1B。上述HE及尼氏染色在BE组及MT干预组中的表现提示了BE可能造成脑组织皮质损伤,而经过MT处理后BE所致的皮质损伤减轻。
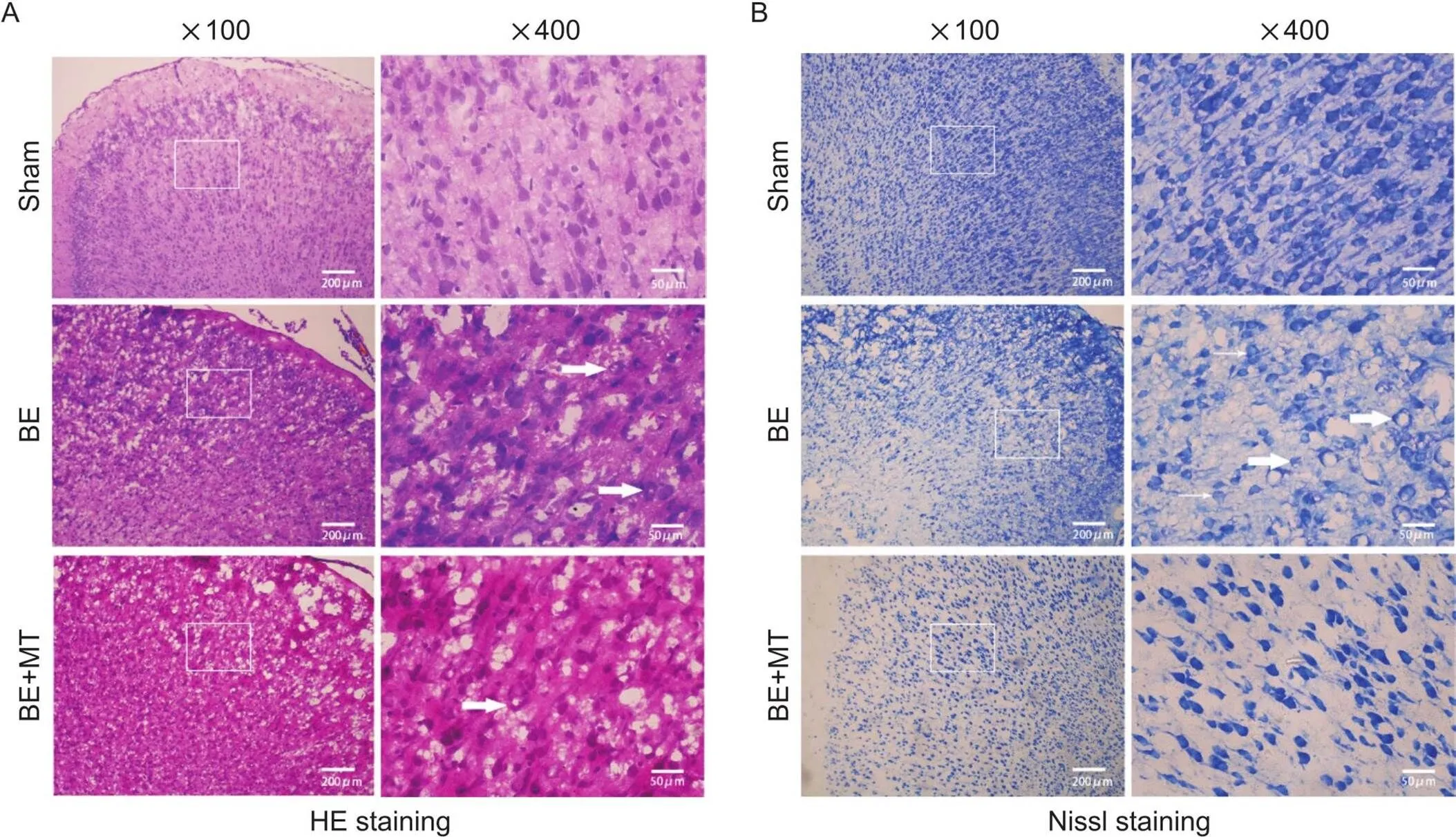
Figure 1. Pathological changes of the parietal cortex of the rats in different groups observed by HE staining (A) and Nissl staining (B). Scale bar=200 or 50 μm.
3 MT降低BE模型大鼠脑水肿程度
采用干-湿重法测定脑含水量的变化,对各组脑组织含水量进行分析。实验结果显示,经胆红素处理的各组脑组织含水量均大于sham组(<0.01),MT可降低BE模型大鼠的脑水肿程度(<0.05),见图2B。利用免疫荧光染色和Western blot,对各处理组的大脑皮质中AQP4表达和分布情况进行分析。免疫荧光结果显示,sham组乳鼠脑皮质AQP4主要位于血管壁上;BE组乳鼠脑皮质AQP4表达量较sham组增多,多见于血管壁上,BE组细胞膜上AQP4表达增多,在胞质表面呈线性排列;BE+MT组乳鼠脑皮质中AQP4表达明显下降,血管周围AQP4表达量明显低于BE组,AQP4在胞质表面不呈线性排列(图2A)。平均荧光强度分析趋势提示BE组AQP4表达强度较sham组显著升高,BE+MT组较BE组显著下降(图2A)。Western blot结果显示,BE组乳鼠脑皮质AQP4表达量明显高于sham组(<0.01),而与BE组相比,BE+MT组AQP4表达量明显降低(<0.01),与免疫荧光染色平均荧光强度趋势相同,见图2C。
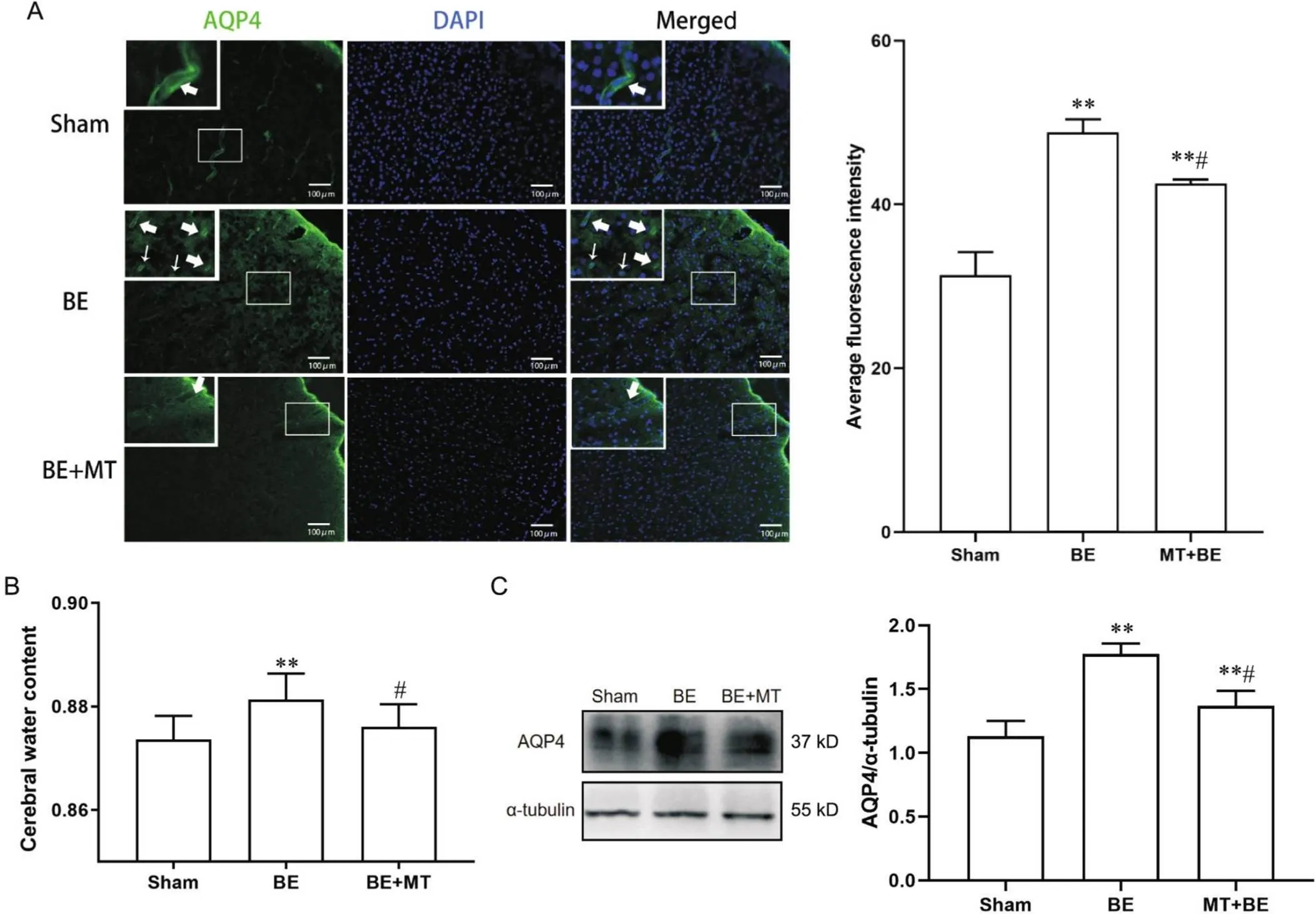
Figure 2. The expression and localization of AQP4 in the parietal cortex and the cerebral water content of the rats in different groups. A: localization of AQP4 demonstrated by immunofluorescence [green: AQP4; blue: DAPI; wide arrow: AQP4 lies on the end feet of astrocytes along the vessels; narrow arrow: AQP4 is arranged in line around the cell membrane. Scale bar (including the insets)=100 µm]; B: cerebral water content in different groups; C: the protein levels of AQP4 of the parietal cortex in different groups. Mean±SEM. n=6. **P<0.01 vs sham group; #P<0.05 vs BE group.
4 MT减少BE中神经细胞凋亡
为了研究BE对神经细胞的凋亡作用,以及MT对其的影响,使用TUNEL染色检测各组顶叶皮质凋亡情况。TUNEL染色结果显示,与假手术组相比,BE组中TUNEL阳性细胞明显增多;而在经过MT处理后,TUNEL阳性细胞明显减少,见图3A。利用Western blot对各组大脑皮质中caspase-3及cleaved caspase-3进行半定量分析。Western blot结果显示,BE组和sham组中caspase-3无显著差异(>0.05),但BE组cleaved caspase-3表达量较sham组明显增加(<0.01),BE+MT组caspase-3表达量明显下降(<0.05),cleaved caspase-3表达量显著低于BE组(<0.01),与sham组无显著差异(>0.05),见图3B。上述结果提示,BE大鼠顶叶皮质可发生凋亡,而MT可阻止BE大鼠顶叶皮质中凋亡的发生。
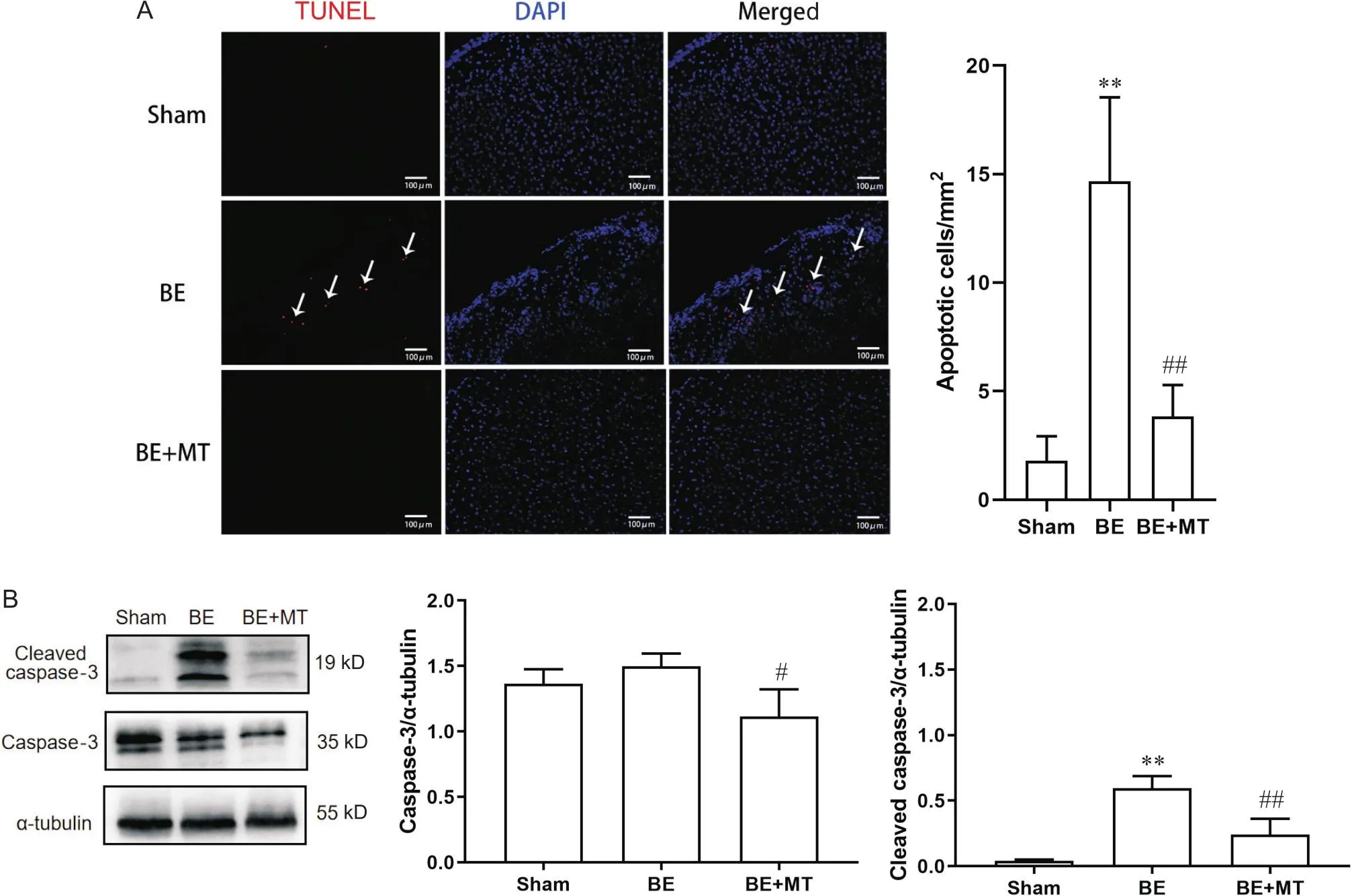
Figure 3. The apoptosis and the expression of cleaved caspase-3 and caspase-3 in the parietal cortex of the rats in different groups. A: the location of apoptosis (indicated by arrows) of the parietal cortex observed by TUNEL staining (scale bar=100 µm), and the number of apoptotic cells per mm2; B: the protein levels of cleaved caspase-3 and caspase-3 in the parietal cortex. Mean±SEM. n=5. **P<0.01 vs sham group; #P<0.05, ##P<0.01 vs BE group.
5 PKC抑制剂可以逆转MT所致BE模型顶叶皮质PKC及AQP4表达的增加
为研究BE中PKCε的变化在MT对AQP4调控中的作用,采用Western blot对各组大脑皮质PKCε和AQP4表达量进行半定量分析。结果显示,与sham组相比,BE组PKCε表达量显著下降(<0.01);MT组中PKCε表达量较BE组显著增加(<0.01);而BE+MT+PKCi组中PKCε表达量又较BE+MT组显著降低(<0.05),见图4。上述结果提示,PKCε参与了BE的进展,而MT也可通过激活PKCε来阻止BE的进展。
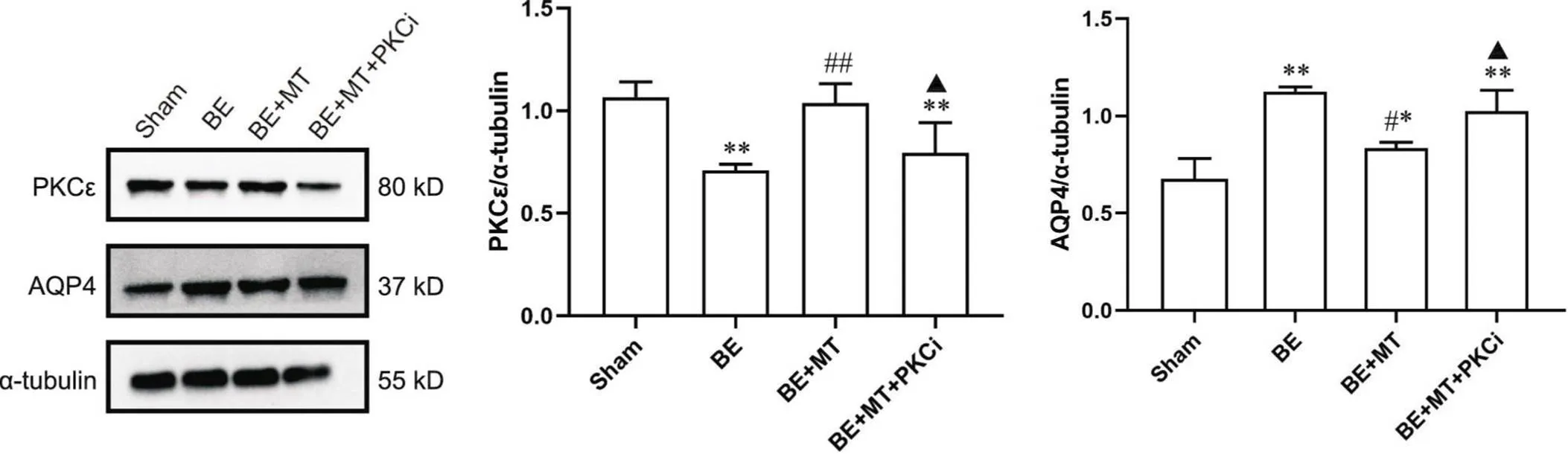
Figure 4. The protein levels of PKCε and AQP4 in the parietal cortex of the rats in different groups, and the effect of PKC inhibitor (PKCi) Ro 31-8220. Mean±SEM. n=5. **P<0.01 vs sham group; #P<0.05, ##P<0.01 vs BE group; ▲P<0.05 vs BE+MT group.
6 MT通过mTOR/PKCε信号通路参与对BE模型AQP4水平的调控
作为PKC的上游信号分子,mTOR的激活可以促进PKC的表达[24-25]。为研究mTOR在BE发生发展中的作用,以及MT通过mTOR/PKCε参与BE的治疗过程,用mTORi PP242处理BE+MT组,通过Western blot对各组大脑皮质AQP4表达量进行半定量分析。结果显示,BE+MT+mTORi组AQP4表达量与BE组相比无显著差异(>0.05),但比BE+MT组和sham组显著增多(<0.05),逆转了MT对BE组AQP4的下调效应;同时,BE+MT+mTORi组PKCε表达量与BE组相比无显著差异(>0.05),但与BE+MT组相比显著降低(<0.01),见图5。上述结果提示,MT通过对BE所致AQP4升高进行调控是通过上调mTOR表达,间接影响PKCε表达实现的。
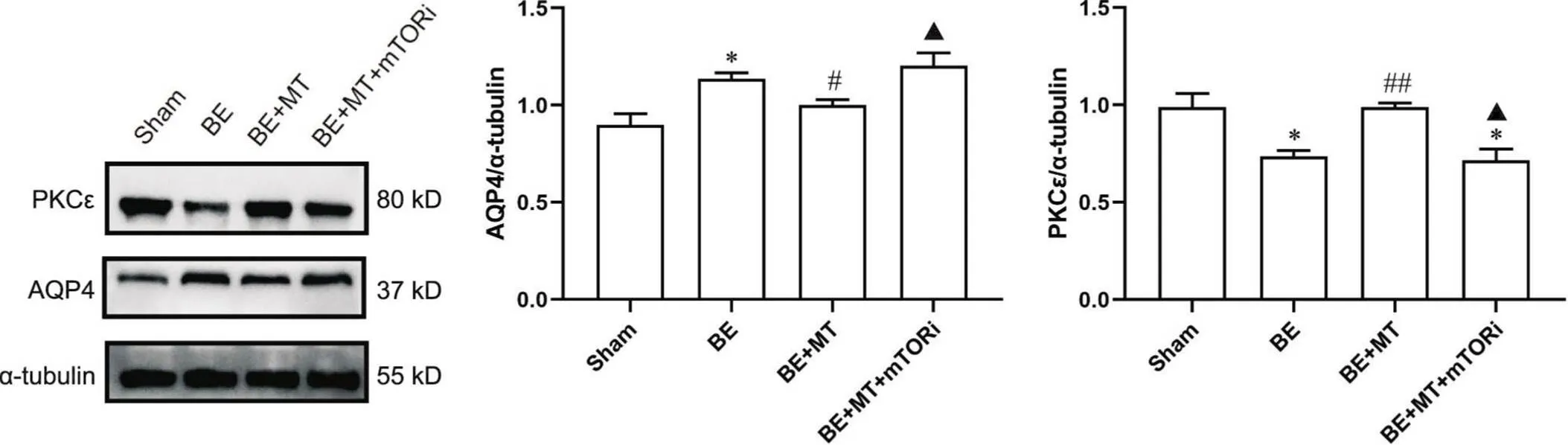
Figure 5. The protein levels of PKCε and AQP4 in the parietal cortex of the rats in different groups, and the effect of mTOR inhibitor (mTORi) PP242. Mean±SEM. n=5. *P<0.05 vs sham group; #P<0.05 vs BE group; ▲P<0.05 vs BE+MT group.
讨论
BE作为新生儿高胆红素血症的严重并发症,具有较高的死亡率,并可导致一系列神经系统后遗症。BE的发病机制主要与UCB的神经毒性有关,在BE患儿中常见的病理改变为神经细胞的水肿,并且水肿改变在BE的发生发展中具有重要的意义[5]。脑水肿分为细胞毒性水肿、离子性水肿、血管源性水肿和出血转换[25]。研究表明,AQP4的表达异常与细胞毒性水肿的发生密切相关,AQP4表达于大脑星形胶质细胞终足膜上,对水具有通透性[26],降低AQP4的表达能减轻脑出血后脑组织的细胞毒性水肿[27]。由于细胞毒性水肿与BE的进展有密切的关系,因此调控脑AQP4的表达可能有助于BE的治疗。
本课题组前期研究表明,UCB将使SD乳鼠BE模型大脑皮质[6]及海马[28]中AQP4表达增加,并在BE造模后24~48 h达到峰值,且AQP4表达变化可能与BE中神经细胞水肿有关[5]。在本研究中,我们发现脑组织AQP4表达变化与脑含水量具有密切联系:与假手术组相比,BE组脑顶叶皮质AQP4表达增加,免疫荧光结果显示,BE鼠脑AQP4主要表达于顶叶皮质细胞膜及血管内皮细胞上,且AQP4的表达增加与BE顶叶皮质含水量增加趋势一致,证实AQP4参与了BE中脑水肿的形成。
MT可通过PKC信号通路对脑缺血模型中脑水肿和神经细胞凋亡进行调控[29],对多种神经系统疾病具有保护作用[30]。另有研究表明,MT可通过mTOR途径对星形胶质细胞代谢进行调控[16, 31-32]。mTOR属于PI3K相关激酶,能被雷帕霉素特异性抑制,mTOR通路通过TOR序列控制PKC的磷酸化,进一步介导PKC的调控。经雷帕霉素抑制mTOR的信号传递后,小鼠的PKC亚型丰度和活性降低,其带来的影响与给予小鼠PKC抑制剂的结果一致[32],提示mTOR信号通路的抑制可降低PKC表达和活性。上述研究表明,MT可通过mTOR信号通路对PKC进行调控,同时有研究证实MT可通过激活PKC,抑制AQP4的表达[29]。本实验免疫荧光实验结果显示,与sham组相比,UCB大幅上调BE顶叶皮质的AQP4表达,同时在星形胶质细胞终足膜及周围细胞膜[9]上观察到AQP4表达上升,证实了BE将导致血管周围星形胶质细胞终足膜上AQP4的表达升高。而使用MT干预后上述部位AQP4的表达均降低,表明MT能显著逆转UCB导致的AQP4上调。在使用UCB处理后,SD乳鼠顶叶皮质中AQP4的表达较sham组明显增高,而PKC亚型PKCε的表达量明显降低,但在使用MT对BE组进行干预后,SD乳鼠顶叶皮质中的AQP4表达出现降低,PKCε表达明显上升,而PKCε参与了脑中AQP4的调控[21, 33]。BE+MT组AQP4表达量降低与免疫荧光标记图像及荧光强度趋势相符合,以及Western blot中BE+MT组PKCε表达明显上升,进一步提示MT逆转UCB所致AQP4上调的作用,是由PKCε所介导的。
为了进一步明确PKC在MT对AQP4调控中的作用,我们使用PKC抑制剂Ro 31-8220进行干预,在我们的实验结果中,BE+MT+PKCi组脑AQP4表达量明显高于未使用PKCi的BE+MT组,且PKCε的表达量和AQP4表达量呈负相关,证实了MT可通过激活PKCε,从而降低AQP4的表达,达到对BE小鼠脑功能的保护作用。
同时为了明确mTOR在MT对BE治疗中的作用,研究中也使用了mTOR抑制剂PP242进行干预。PP242作为雷帕霉素特异性抑制剂,能通过抑制mTOR复合物的表达,来降低PKC的表达[25]。即PKC可作为mTOR的下游效应分子,受到mTOR的调控[34]。mTOR途径的激活可减轻蛛网膜下腔出血早期脑损伤介导的脑水肿[35]。本实验使用PP242干预后,在BE+MT+mTORi组中,AQP4表达量与BE组的表达水平接近,其干预效果与使用PKC抑制剂结果类似,提示MT降低BE顶叶皮质AQP4的效应被mTORi所阻止,也进一步证实了MT通过激活mTOR/PKC途径参与对BE脑中AQP4的调控。
此外,caspase-3作为凋亡级联“瀑布”的重要酶分子,也可改变线粒体膜通透性,干扰线粒体电子传递链运输,使线粒体合成ATP的功能受损[36-38],最终导致细胞水肿和凋亡。cleaved caspase-3作为caspase-3的活性裂解产物,可以进一步反映细胞凋亡水平[21, 37, 39]。我们的实验结果证实MT能够显著下调BE组顶叶皮质caspase-3及cleaved caspase-3的水平,且与TUNEL、AQP4表达水平具有同步变化;UCB介导下的caspase-3和cleaved caspase-3的升高,伴随着AQP4表达量升高,同时TUNEL阳性细胞数量增加,提示这种凋亡与UCB介导的AQP4升高具有相关性,并且外源性MT可降低BE的神经细胞凋亡。本研究结果与MT在其它神经系统疾病模型如局灶性脑缺血[40]、阿尔兹海默病[41]、多发性硬化[42]中降低脑caspase-3及凋亡水平的研究结果一致。
本研究中BE组及MT干预组脑含水量变化提示,BE可发生脑水肿,而MT可减轻甚至阻止BE脑水肿的形成。免疫荧光染色及Western blot结果证实,UCB可增加BE脑中AQP4的表达,从而促进BE脑水肿的形成,而MT对BE脑水肿的干预也是通过调控AQP4的表达部位及表达强度实现的。通过BE中AQP4表达量与TUNEL、caspase-3及cleaved caspase-3凋亡指标的同步变化,我们认为上述蛋白变化之间的关系为,随着UCB介导的AQP4表达升高,导致细胞毒性水肿的形成,增加细胞对UCB的敏感性,来增强UCB对细胞的毒性作用,产生正反馈的致病效应,最终促使细胞器如线粒体的水肿[43],进一步激活caspase家族蛋白,介导神经细胞凋亡[21, 37]。而本实验证实MT可通过mTOR/PKC途径,阻断脑水肿的形成,又可直接阻止细胞凋亡产生,因而对UCB的致病效应具有良好的保护效应,对BE的治疗具有应用价值。综上所述,MT可通过减少BE脑顶叶皮质中AQP4的表达来缓解脑水肿,并减少caspase-3介导的神经细胞凋亡。而MT下调AQP4表达的机制与mTOR/PKC信号通路的激活有关。
[1] Slusher TM, Owa JA, Painter MJ, et al. The kernicteric facies: facial features of acute bilirubin encephalopathy[J]. Pediatr Neurol, 2011, 44(2):153-154.
[2] Kitchen P, Salman MM, Halsey AM, et al. Targeting aquaporin-4 subcellular localization to treat central nervous system edema[J]. Cell, 2020, 181(4):784-799.e19.
[3]刘佳丽, 王晔. 缺血后处理通过水通道蛋白-4对大鼠缺血再灌注损伤的脑保护作用及其机制[J]. 中风与神经疾病杂志, 2019, 36(3):209-213.
Liu JL, Wang Y. Ischemic postconditioning alleviates brain edema after ischemia reperfusion in rats through down-regulation of aquaporin-4[J]. J Apopl Nerv Dis, 2019, 36(3):209-213.
[4] Abo El Gheit RE, Atef MM, Badawi GA, et al. Role of serine protease inhibitor, ulinastatin, in rat model of hepatic encephalopathy: aquaporin 4 molecular targeting and therapeutic implication[J]. J Physiol Biochem, 2020, 76(4):573-586.
[5] Turkel SB, Miller CA, Guttenberg ME, et al. A clinical pathologic reappraisal of kernicterus[J]. Pediatrics, 1982, 69(3):267-272.
[6]文凤, 樊萍, 隆令, 等. 胆红素脑病SD乳鼠模型中脑水通道蛋白-4表达发生变化[J]. 中国生物化学与分子生物学报, 2019, 35(12):1384-1391.
Wen F, Fan P, Long L, et al. Expression and significance of brain AQP4 in the neonatal SD rat model of bilirubin encephalopathy[J]. Chin J Biochem Mol Biol, 2019, 35(12):1384-1391.
[7] Chen HC, Tsai DJ, Wang CH, et al. An electron microscopic and radioautographic study on experimental kernicterus. I. Bilirubin transport via astroglia[J]. Am J Pathol, 1969, 56(1):31-58.
[8]黄娟. 细胞毒性脑水肿的发生发展过程中AQP4内化和溶酶体分选现象及其机制的研究[D]. 重庆: 重庆医科大学, 2014.
Huang J. The internalization and lysosomal degradation of AQP4 in cytotoxic brain edema and its mechanism[D].Chongqing: Chongqing Medical University, 2014.
[9] Jorgačevski J, Zorec R, Potokar M. Insights into cell surface expression, supramolecular organization, and functions of aquaporin 4 isoforms in astrocytes[J]. Cells, 2020, 9(12):2622.
[10] Watchko JF, Tiribelli C. Bilirubin-induced neurologic damage: mechanisms and management approaches[J]. N Engl J Med, 2013, 369(21):2021-2030.
[11] Gunata M, Parlakpinar H, Acet HA. Melatonin: a review of its potential functions and effects on neurological diseases[J]. Rev Neurol (Paris), 2020, 176(3):148-165.
[12] 王维苹, 朱耀峰, 张金, 等. 褪黑素对帕金森病模型大鼠代谢机能和DA能神经元的保护作用[J]. 解剖学研究, 2017, 39(2):81-84, 161-162.
Wang WP, Zhu YF, Zhang J, et al. The protective effect of melatonin on dopaminergic neurons and on the metabolic function in rats with Parkinson disease[J]. Anat Res, 2017, 39(2):81-84,161-162.
[13] Pandi-Perumal SR, Srinivasan V, Maestroni GJ, et al. Melatonin: Nature's most versatile biological signal? [J]. FEBS J, 2006, 273(13):2813-2838.
[14] Baffi TR, Lordén G, Wozniak JM, et al. mTORC2 controls the activity of PKC and Akt by phosphorylating a conserved TOR interaction motif[J]. Sci Signal, 2021, 14(678):eabe4509.
[15] Baffi TR, Newton AC. Protein kinase C: release from quarantine by mTORC2[J]. Trends Biochem Sci, 2022, 47(6):518-530.
[16] Hao EY, Wang DH, Chang LY, et al. Melatonin regulates chicken granulosa cell proliferation and apoptosis by activating the mTOR signaling pathway via its receptors[J]. Poult Sci, 2020, 99(11):6147-6162.
[17] Xu LX, Lv Y, Li YH, et al. Melatonin alleviates brain and peripheral tissue edema in a neonatal rat model of hypoxic-ischemic brain damage: the involvement of edema related proteins[J]. BMC Pediatr, 2017, 17(1):90.
[18] Tiong YL, Ng KY, Koh RY, et al. Melatonin prevents oxidative stress-induced mitochondrial dysfunction and apoptosis in high glucose-treated schwann cells via upregulation of Bcl2, NF-κB, mTOR, Wnt signalling pathways[J]. Antioxidants (Basel), 2019, 8(7):198.
[19] Koral L, Ovali MA, Tufekcioglu NK, et al. The role of AQP3 and AQP4 channels in cisplatin-induced cardiovascular edema and the protective effect of melatonin[J]. Mol Biol Rep, 2021, 48(11):7457-7465.
[20] Wei X, Zhang B, Cheng L, et al. Hydrogen sulfide induces neuroprotection against experimental stroke in rats by down-regulation of AQP4 via activating PKC[J]. Brain Res, 2015, 1622:292-299.
[21] Noël G, Tham DKL, Guadagno E, et al. The laminin-induced phosphorylation of PKCδ regulates AQP4 distribution and water permeability in rat astrocytes[J]. Cell Mol Neurobiol, 2021, 41(8):1743-1757.
[22] Datta A, Sarmah D, Kaur H, et al. Post-stroke impairment of the blood-brain barrier and perifocal vasogenic edema is alleviated by endovascular mesenchymal stem cell administration: modulation of the PKCδ/MMP9/AQP4-mediated pathway[J]. Mol Neurobiol, 2022, 59(5):2758-2775.
[23] Kunduzova OR, Escourrou G, Seguelas MH, et al. Prevention of apoptotic and necrotic cell death, caspase-3 activation, and renal dysfunction by melatonin after ische-mia/reperfusion[J]. FASEB J, 2003, 17(8):872-874.
[24] 胡影, 田巧红, 华子瑜, 等. 小脑延髓池注射胆红素溶液建立新生大鼠胆红素脑病模型的评价[J]. 重庆医科大学学报, 2008, 33(2):177-181, 244.
Hu Y, Tian QH, Hua ZY, et al. Evaluation of a new approach that inject bilirubin solution into cerebellomedullary cistern to establish bilirubin encephalopathy model in neonatal mouse[J]. J Chongqing Med Univ, 2008, 33(2):177-181, 244.
[25] 刘亚玲, 于秋红, 王丛, 等. 脑损伤后继发脑水肿的分型及其分子机制研究进展[J]. 中华物理医学与康复杂志, 2021, 43(6):567-570.
Liu YL, Yu QH, Wang C, et al. Research progress in classification and molecular mechanism of secondary brain edema after brain injury[J]. Chin J Phys Med Rehab, 2021, 43(6):567-570.
[26] Nagelhus EA, Ottersen OP. Physiological roles of aquaporin-4 in brain[J]. Physiol Rev, 2013, 93(4):1543-1562.
[27] Xu M, Su W, Xu Q. Aquaporin-4 and traumatic brain edema[J]. Chin J Traumatol, 2010, 13(2):103-110.
[28] 张丽荣, 樊萍, 胡嘉恒, 等. 胆红素对幼年大鼠海马细胞凋亡及水通道蛋白4表达的影响[J]. 神经解剖学杂志, 2022, 38(1):85-92.
Zhang LR, Fan P, Hu JH, et al. The effects of bilirubin on cell apoptosis and the expression of aquaporin4 in hippocampus of young rats[J]. J Neuroanat, 2022, 38(1):85-92.
[29] Bhattacharya P, Pandey AK, Paul S, et al. Melatonin renders neuroprotection by protein kinase C mediated aquaporin-4 inhibition in animal model offocal cerebral ischemia[J]. Life Sci, 2014, 100(2):97-109.
[30] 裴进升, 张华. 褪黑素对新生鼠胆红素脑损伤的保护机制[J]. 广东医学, 2012, 33(12):1706-1708.
Pei JS, Zhang H. Protective mechanism of melatonin on bilirubin brain injury in neonatal rats[J]. Guangdong Med, 2012, 33(12):1706-1708.
[31] Mueed Z, Rai PK, Kamal MA, et al. Decoding the inter-relationship between sleep disorders and Alzheimer's di-sease pathogenesis[J]. CNS Neurol Disord Drug Targets, 2021, 20(8):723-735.
[32] Li H, Zhang Y, Liu S, et al. Melatonin enhances prolifera-tion and modulates differentiation of neural stem cells via autophagy in hyperglycemia[J]. Stem Cells, 2019, 37(4):504-515.
[33] Chen SJ, Yang JF, Kong FP, et al. Overactivation of corticotropin-releasing factor receptor type 1 and aquaporin-4 by hypoxia induces cerebral edema[J]. Proc Natl Acad Sci U S A, 2014, 111(36):13199-13204.
[34] Ribeiro MC, Peruchetti DB, Silva LS, et al. LPS induces mTORC1 and mTORC2 activation during monocyte adhesion[J]. Front Mol Biosci, 2018, 5:67.
[35] Tian J, Yang L, Wang P, et al. Exogenous CGRP regulates apoptosis and autophagy to alleviate traumatic brain injury through Akt/mTOR signalling pathway[J]. Neurochem Res, 2020, 45(12):2926-2938.
[36] Pessoa J. Live-cell visualization of cytochrome c: a tool to explore apoptosis[J]. Biochem Soc Trans, 2021, 49(6):2903-2915.
[37] Kalpage HA, Wan J, Morse PT, et al. Cytochromephosphorylation: control of mitochondrial electron transport chain flux and apoptosis[J]. Int J Biochem Cell Biol, 2020, 121:105704.
[38] 王海鹏, 刘同帅, 于群, 等.基因敲减促进氧糖剥夺/复氧诱导的小鼠神经母细胞瘤N2a细胞凋亡[J]. 中国病理生理杂志, 2021, 37(8):1422-1429.
Wang HP, Liu TS, Yu Q, et al. Knockdown ofgene promotes apoptosis of mouse neuroblastoma N2a cells induced by oxygen-glucose deprivation/reoxygenation[J]. Chin J Pathophysiol, 2021, 37(8):1422-1429.
[39] Earnshaw WC, Martins LM, Kaufmann SH. Mammalian caspases: structure, activation, substrates, and functions during apoptosis[J]. Annu Rev Biochem, 1999, 68:383-424.
[40] Kilic E, Kilic U, Yulug B, et al. Melatonin reduces disseminate neuronal death after mild focal ischemia in mice via inhibition of caspase-3 and is suitable as an add-on treatment to tissue-plasminogen activator[J]. J Pineal Res, 2004, 36(3):171-176.
[41] Luengo E, Buendia I, Fernández-MC, et al. Pharmacological doses of melatonin impede cognitive decline in tau-related Alzheimer models, once tauopathy is initiated, by restoring the autophagic flux[J]. J Pineal Res, 2019, 67(1):e12578.
[42] Vakilzadeh G, Khodagholi F, Ghadiri T, et al. The effect of melatonin on behavioral, molecular, and histopathological changes in cuprizone model of demyelination[J]. Mol Neurobiol, 2016, 53(7):4675-4684.
[43] Hu JH, Fan P, Zhang LR, et al. Neuroglobin expression and function in the temporal cortex of bilirubin encephalopathy rats[J]. Anat Rec (Hoboken), 2022, 305(2):254-264.
Melatonin down-regulates cerebral parietal cortex aquaporin 4 and induces neuroprotection through mTOR/PKC signaling in bilirubin encephalopathy rats
ZHANG Mingyue1, ZHOU Longyang1, PU Song1, CUI Aijie1, ZHANG Lirong2, CHEN Chunyan2, XUE Kaige2, FAN Ping3, GAN Shengwei1,2△
(1,,400016,;2,,,400016,;3,,400062,)
To investigate the changes of cerebral parietal cortical aquaporin 4 (AQP4) and neural apoptosis induced by melatonin (MT) in bilirubin encephalopathy (BE), and to determine the role of the mammalian target of the rapamycin (mTOR)/protein kinase C (PKC) signaling pathway in the therapeutic mechanism of MT for BE.Eighty 7-day-old Sprague-Dawley (SD) rats were randomly divided into sham group, BE group, MT group, PKC inhibitor (PKCi) group, and mTOR inhibitor (mTORi) group. The BE model was established in neonatal SD rats by injecting bilirubin solution into the cisterna magna. In the mTORi group, the mTOR inhibitor solution was then injected intraperitoneally 1 h before modeling, and the MT solution was injected intraperitoneally 30 min before modeling. At 24 h after modeling, the brains of neonatal SD rats were removed, and hematoxylin-eosin (HE) and Nissl staining were used to detect cortical pathological changes in each group. The water content of the cerebral cortex was measured using the wet-dry weight method, and the expression level of AQP4 in cerebral cortex was detected by immunofluorescence staining. TUNEL staining was used to detect the neuronal apoptosis, and the expression levels of AQP4, caspase-3, cleaved caspase-3 and PKCε were detected by Western blot.Compared with BE group, HE and Nissl staining showed that MT alleviated unconjugated bilirubin (UCB)-induced neural damage. The wet-dry weight method showed that the water content of the cerebral parietal cortical area was decreased after treatment with MT. Immunofluorescence staining showed that AQP4 was mainly expressed along the vessels on the end feet membrane of astrocytes, and MT prevented increased AQP4 levels induced by UCB. TUNEL staining showed that MT alleviated the cerebral parietal cortical neuronal apoptosis caused by BE. Western blot showed that in comparison with sham group, AQP4 and cleaved caspase-3 expression levels were increased, and PKC expression was decreased in the parietal cortex of the rats in BE group. MT intervention reduced the increased expression levels of AQP4 and cleaved caspase-3, and decreased expression of PKCε. Treatment with PKCi or mTORi reversed the ameliorative effect of MT on the above-mentioned pathological changes in BE group.Treatment with MT induces potential neuroprotection in the neonatal SD rat model of BE by activating mTOR/PKC signaling pathway.
bilirubin encephalopathy; melatonin; aquaporin 4; mTOR/PKC signaling pathway
1000-4718(2023)07-1199-10
2022-08-30
2023-06-16
15825906442; E-mail: 406970700@cqmu.edu.cn
R363.1+3; R741
A
10.3969/j.issn.1000-4718.2023.07.006
[基金项目]重庆市卫生计生委2015年科研计划项目(No. 2015MSXM109);中华医学会医学教育分会立项课题(No. 2020B-N13332);国家级大学生创新创业训练计划项目、重庆医科大学大学生科学研究与创新实验项目(No. SRIEP202004);重庆市2022年创新人才工程项目(No. CY220408)
(责任编辑:余小慧,李淑媛)
