基于模型认知的高中化学教学研究
——以“化学反应的限度”为例
2023-08-07文/赵拯
文/赵 拯
引 言
“证据推理与模型认知”是化学学科核心素养的重要组成部分。模型认知作为一种常用的科学研究方法,不断推动微观体系和宏观世界相互验证与相互促进。模型认知能力是指通过观察、实验、分析、推理等手段,提炼出研究对象的本质特征、构成要素及关系,构建认识事物的实物模型或过程模型来解释化学现象,揭示化学规律的能力。
“化学反应的限度”是人教版化学必修第二册的内容,是培养学生模型认知能力良好的素材。化学平衡是可逆反应在一定的条件下达到的最大限度。其中,反应速率、系统浓度、外界条件是模型认知的关键要素。该内容与前面元素化合物知识学习方式略显不同,内容较为抽象,原理相对复杂。因此,在新课教学时,激发学生学习动力,不断吸引学生注意力,注重学生认知模型建构尤为重要。
一、知识分析与内容组织
(一)知识分析
课程标准中关于“化学反应的限度”内容,要求学生了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡状态,认识化学变化是有条件的,学会运用控制变量方法研究化学反应,了解控制反应条件在生产生活和科学研究中的作用[1]。可逆反应的概念很简单,很容易理解,但其中的内涵相当丰富。在教学过程中,教师可通过创设实验情境,让学生在实验操作中体验到什么是可逆反应,初步形成化学平衡体系的认知模型;让学生充分利用抽象思维,不断深化认知模型,并归纳出化学平衡的特征,并在此基础上,通过化学平衡装置进行实验,感知外界条件的改变对化学反应限度的影响。
(二)组织方式
工业合成氨反应限度很低,如何提高反应的限度?限于条件苛刻,合成氨的实验无法在课堂演示并研究。为此,笔者查阅资料,根据学生的认知基础设计了具有可逆性的原电池,让学生分组实验,通过观察电流表示数的变化来形象化可逆化学反应的进程。在实验过程中,教师要引导学生观察与思考,通过问题链的形式,督促学生对实验现象进行剖析,在追问中层层递进,螺旋式上升,最终建构化学平衡的基本认知模型。在此基础上,教师通过该认知模型,提供相关信息,与学生一起探讨工业制氨的条件选择。
二、教学活动设计
环节一:情境创设,任务驱动
教师讲解:饥饿是一种由于膳食能量获取不足而引起的不舒服的身体感觉。当一个人无法靠定期摄入足够的膳食能量来过上健康的生活时,就会患上慢性疾病。你可能想象不到,全球还有几亿人处于饥饿状态。其实,对于饥饿感觉,大家都深有体会,上完上午的四节课后大家就饥肠辘辘,那冲向食堂的速度说明了一切(学生笑)。如果冲到食堂发现只能排队打稀饭,你们是什么感受?谈到粮食,我们不得不讲到氮肥。前面我们已经学过,作为合成氮肥的最关键一步是:。氮气和氢气在常温常压下,几乎是不反应的。即使在高温、高压、催化剂下,反应的限度或产量也极少。今天我们就来研究如何提高反应的限度,即氨气的产率。
设计意图:通过教师讲解再现饥饿的情境,引发学生对粮食重要性的认同,逐渐引导到氮肥的生产,即工业合成氨上来,并提出本节课的核心问题:如何提高氨气的产率(合成氨的反应限度)。
环节二:温故知新,激活旧知
教师引导:工业合成氨是一个可逆反应。什么是可逆反应呢?这就涉及两个概念:正反应和逆反应。请大家针对,说一说这个反应中哪个是正反应,哪个是逆反应?
学生回答:氮气和氢气合成氨气是正反应;氨气分解为氮气和氢气是逆反应。
教师强调:可逆反应中的正反应和逆反应,不要忘了有个前提,在相同条件下。例如,氢气和氧气点燃生成水,水电解为氢气和氧气,由于反应条件不同,我们不能讲这个反应是可逆反应,自然也没有该反应的正反应和逆反应的说法了。那么,我们如何准确地叙述合成氨这个反应的正反应和逆反应呢?
学生回答:在相同条件下,正反应:氮气和氢气生成氨气;同时,逆反应:氨气分解为氮气和氢气。
教师启发:要提高工业合成氨的限度,我们的思路是正反应尽可能多发生,即合成氨的程度多点,分解氨的程度少点。
设计意图:通过可逆反应概念的回忆,强调同一条件下这一前提,并从概念中引导学生从正反应和逆反应角度进行思考,为后面的模型建构做好准备。
环节三:实验操作,挖掘要素
由于工业合成氨反应条件是高温、高压、催化剂,实验室很难模拟。为此,教师选择了一个可以让大家亲手操作的实验来组织探究。
根据原电池知识,只要是自发的氧化还原反应就可以设计成原电池。Ag+和Fe3+都具有一定的氧化性,Fe2+和单质银具有一定的还原性。它们之间的反应具有一定的可逆性,即为Ag++ Fe2+Ag + Fe3+[2]。我们可以将正反应(Ag++ Fe2+→Ag + Fe3+)、逆反应(Ag++ Fe3+→Ag++ Fe2+)分别设计成原电池。
以石墨棒和银棒作为反应的电极,设计两组原电池并装配实验仪器。装置如图1 所示。
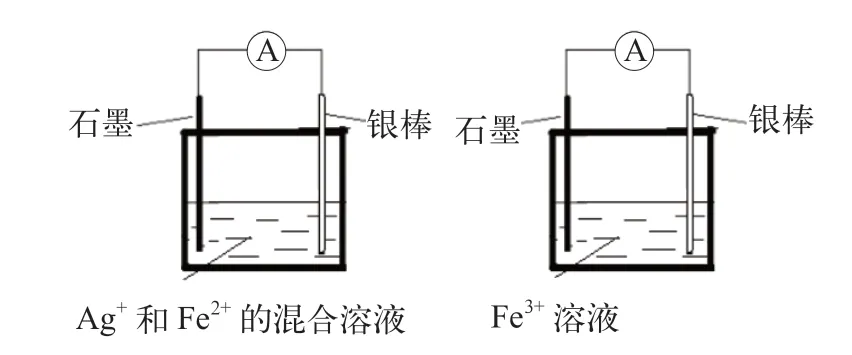
图1 原电池装置图
学生分组实验并汇报现象:电流表指针正向偏转,另一个反应反向偏转。
教师:指针偏转,这与同学们的预测一致。但偏转方向不同,这是由于正负极不一样的原因。随着时间推进,这两个电流表指针会怎么变化呢?
学生1:正向的偏向反向,反向的偏向正向。该反应是可逆反应。
学生2:最终两个指针应该都会指向“0”刻度。电池电量用完就没有电子转移了。
教师:大家的预测都很有道理。因为这个过程时间略长,老师将这两个实验装置进行拍摄后现快放,大家看看谁预测的结果正确。
学生:过一段时间后,指针都指向中间的“0”刻度。
教师:电流表指数为“0”,就是电子不再转移了。那么,装置中的反应是不是已经停止了?
学生:反应已经停止。
教师追问:是不是第一个容器中所有Fe2+都转变成Fe3+?同样,第二个反应容器中是否所有的Fe3+都转变成Fe2+?
提示:检验是否有Fe3+可用KSCN 溶液,检验Fe2+可用酸性KMnO4溶液。
学生:取样后加试剂检验,发现两个装置中均含有Fe2+和Fe3+。
教师:混合液中是否有Ag+?你们可以检测一下。
学生:溶液中不仅有Fe2+和Fe3+存在,而且还存在Ag+。
教师追问:当电流表的指数为“0”时,各离子在体系中是共存的,你还坚持“反应已经停止”了吗?
学生:反应还在进行中。
教师追问3:那么,指数为“0”说明了什么?
学生:当正反应和逆反应同时存在,两边电子互相“对峙”,不再流动,推测正逆反应的速率相等。
可逆反应不论从正反应开始,还是从逆反应开始,一段时间后反应就达到最大限度,即达到该条件下的平衡状态。此时,体系中各离子浓度不再变化,正反应速率等于逆反应速率。
设计意图:人教版必修第二册刚学过原电池,在教师的引导下,师生合作将可逆反应设计成两个方向的原电池。原电池的设计突破了学生无法直接观察到溶液中离子浓度的变化,通过示数的变化推理出溶液中浓度的改变。教师通过不断追问和实验验证,推动学生挖掘出化学平衡的关键要素:反应物和生成物的浓度不再变化,正逆反应速率相等。
环节四:深化认知,构建模型
教师:刚刚我们研究的是平衡状态,现在从起始状态开始来研究。对于化学反应速率,一般来说,反应物浓度越大,速率越快。以时间为横坐标,速率为纵坐标,对正反应和逆反应进行画图。
师生合作:在起始状态,反应物c(Ag+)、c(Fe2+)是最大值,正反应速率最快;逆反应离子浓度为0,速率为0。随着反应进行,Ag+与Fe2+离子浓度逐渐减小,速率逐渐减慢;生成物溶液浓度逐渐增加,速率也随之提高。随着时间推进,正反应速率与逆反应速率相等时,各离子浓度就保持不变了。我们将这个过程用图形的方式表达出来(如图2)。
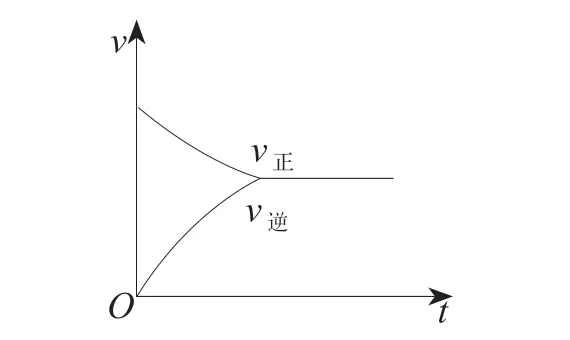
图2 正逆反应速率随时间变化的示意图
教师:当体系中各离子浓度不再变化,并不是指溶液中各离子浓度相等,只是达到了反应的最大限度。比如本实验中,两个原电池经过一定时间后,电流表示数为“零”,说明反应达到平衡。
提供信息:现在我们从定量角度进一步来研究可逆反应的体系中离子浓度的变化,反应前c(Fe2+)=c(Ag+)=0.100 mol/L,c(Fe3+)=0,随着反应进行,正反应离子浓度逐渐减小,速率减小;反应达到最大限度时,测得c(Fe2+)=c(Ag+)=0.045 mol/L;c(Fe3+)=0.055 mol/L。
师生合作:我们进行画图,初步感受一下这个过程中溶液离子浓度的改变(如图3)。
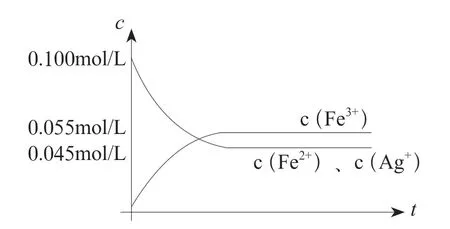
图3 溶液中各离子达到平衡时的改变情况
设计意图:师生合作,从浓度与速率的正相关的层面粗略地表示反应达到最大化学限度时,正、逆反应的关系。在此基础上,由定性到定量,引导学生从定量化的角度,对溶液中各离子浓度的改变进行图形表征,进一步深化对化学平衡认知模型的理解。
环节五:探究条件,深化模型
教师:在一定条件下,化学反应的限度是个定值。那么,是不是反应限度不能改变呢?我们来尝试通过外界条件的改变,如改变温度、改变反应物或生成物浓度来探究是否对化学限度有影响。
视频实验1:对已达到化学反应限度的装置加热,发现指针发生偏转。
视频实验2:在已达到化学反应限度的装置滴加浓银离子溶液,指针也发生偏转。
教师总结:对已达到平衡体系的化学反应,可以从反应物或生成物的浓度角度、体系温度的角度,甚至从气体压强的角度来探究化学反应的限度变化规律。如果我们能掌握其中的变化规律,就可以用改变条件来改变反应的限度,为生产生活服务。如工业合成氨,我们的目标是“又快又多”,现从化学反应速率和限度来考虑(见表1)。
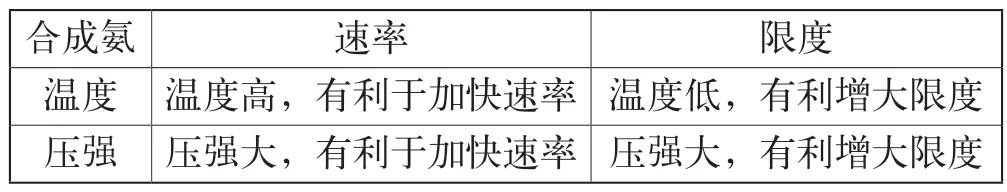
表1
同学们,正是科学家对化学限度的不懈追求,使得粮食产量不断提高,饥饿离我们越来越远。
设计意图:化学反应限度的改变不是本节课的重点,但需要让学生了解反应限度也不是一成不变的,而且改变是非常有意义的。
三、教学反思
本节课内容充实,节奏紧凑,从课堂气氛和课后练习来看,绝大多数学生能够接纳化学反应的限度宏观表现和微观特征,能够自主地判断出反应是否达到限度,归纳出化学平衡的特征。教师在课堂上利用模型建构这条隐线,以合成氨为问题导向,借助原电池实验操作,分析和解构化学反应的限度的特点。教师借助原电池模型对化学反应限度的认知进行模型建构,有利于学生在实验中获得相关证据,接受新知识。
结 语
学生在化学学习过程中所获得的具体知识是非常容易遗忘的,但蕴藏其中的学科思想和方法会根植于学生的头脑,形成从化学视角认识事物和处理问题的思维习惯,这就是化学观念的形成。教师在进行建构时,要不失时机地提出问题,鼓励学生进行科学探究,提升学生核心素养,并在与学生一起探索的过程中不断提升学生的化学学科理解力,让学生可以用化学的眼光观察世界,用化学的视角去解决以后生活和工作中遇到的问题。
