便秘型肠易激综合征患者使用利那洛肽的疗效和不良反应评价:基于PSM的回顾性对照研究
2023-08-05戴亨纷郑彩云蔡筱蕾蔡慧美韩海燕
戴亨纷,郑彩云,蔡筱蕾,蔡慧美,韩海燕
0 引言
肠易激综合征(Irritable bowel syndrome,IBS)是一种功能性胃肠道紊乱疾病,主要临床表现为腹痛、腹胀、排便习惯和(或)大便性状改变[1]。全球IBS发病率达10%[2],我国IBS的患病率为1.4%~11.5%[3],一般女性患者多于男性患者。便秘型肠易激综合征(IBS-C)是最常见的IBS亚型,患者以腹部症状为主,常伴有慢性功能性便秘。尽管IBS-C和慢性特发性便秘(CIC)是基于Rome标准的不同疾病,但它们越来越被认为是功能性肠病的单一谱系,其中可能存在显著的重叠,并可能发生从一种疾病到另一种疾病的过渡[4],两者诊断上易混淆,治疗上类似。IBS-C影响全球约1.3%的人口[5],然而,不到一半的IBS-C患者到医疗机构寻求治疗,且大多数出现便秘的患者倾向于在初级医疗保健环境(如社区卫生院、家庭医生等)寻求治疗[6]。大多数来医院就诊的IBS-C患者已经尝试过饮食和生活方式的改变甚至非处方(OTC)药物使用,但效果有限。因此,对于IBS-C患者,选择改善症状为主的初始疗法还是选择个体化的综合治疗策略具有一定挑战性。
利那洛肽(Linaclotide)是鸟苷酸环化酶-C(GC-C)激动剂,于2012年8月首次在北美和日本被批准用于治疗成年IBS-C和CIC,在我国(包括香港和澳门)和欧洲被批准的适应证为成人IBS-C[7]。研究表明,利那洛肽在胃肠道局部起作用,其双重作用机制为:①结合并激活肠上皮细胞内、外的GC-C受体,GC-C的激活导致胞内和胞外环磷酸鸟苷(cGMP)浓度增加。细胞内cGMP的增加刺激氯化物和碳酸氢盐分泌到肠腔,导致肠液分泌增加,使肠道转运加速;②细胞外cGMP的增加可降低肠内痛觉神经的敏感度(提高肠道痛阈),改善腹痛[8]。在前期的几项随机对照临床试验中,利那洛肽已被证明对IBS-C的许多肠道症状持续有效,包括大便频率、大便一致性、排便完整性和腹泻。此外,在重要的腹部症状,包括腹痛、腹部不适和腹胀等方面,与安慰剂相比有明显改善[9-11]。玉燕萍等[12]纳入6篇RCT研究,对利那洛肽治疗IBS-C的疗效和安全性进行meta分析,发现利那洛肽具有良好的疗效、安全性和耐受性。由于利那洛肽在我国上市时间较短,一项多中心临床研究表明,利那洛肽(290 μg/d)对我国IBS-C患者的腹痛、便秘症状和总体结局有明显改善[13-14]。由于IBS-C患者自我用药、饮食干预、OTC用药以及联合用药等因素的影响,进行真实世界研究更能获得利那洛肽的临床使用价值及潜在获益或风险的临床证据。我国尚未见相关的真实世界研究报道,因此,本研究汇总笔者所在医院利那洛肽的临床使用数据,分析利那洛肽治疗IBS-C的临床疗效和不良反应,探究利那洛肽治疗IBS-C的安全性和效益性。
1 资料与方法
1.1 纳入和排除标准 本研究为回顾性对照研究。研究对象为符合罗马III或IV标准的成年IBS患者(>18岁),且伴有便秘症状发生,即IBS-C患者。由于IBS-C鉴别诊断较繁杂,可以根据患者发生腹痛、自发性排便次数(≤5次/周)、完全自发性排便次数(≤3次/周)和粪便形状为块状便/硬便来辅助诊断[4,15]。纳入标准:①符合上述诊断标准的IBS-C成年患者;②治疗组的利那洛肽使用时间≥7 d。排除标准:①腹泻型IBS患者和混合型(便秘和腹泻混合)IBS患者;②具有器质性胃肠道疾病患者;③恶性肿瘤患者;④长期卧床、鼻饲管进食等行动不便患者。抽取使用利那洛肽治疗的IBS-C患者为治疗组,同期住院使用其他药物治疗的IBS-C患者为对照组。
1.2 临床资料 回顾性收集2019年9月至2022年8月福建医科大学附属福州市第一医院收治的IBS-C患者,根据是否使用利那洛肽分为治疗组和对照组。通过病案系统提取患者临床治疗的资料,隐去患者姓名,采用患者住院号进行识别。为了保证两组患者资料混杂因素的均衡可比性,降低混杂偏倚,对提取的有效资料采用倾向性评分匹配法进行匹配。
1.3 研究指标 本研究使用入组患者的住院号作为识别信息提取患者的住院数据,不涉及患者姓名等隐私。提取的资料包括患者的一般资料、用药后的疗效和不良反应,以及缓解症状所用药物的费用指标。一般资料包括住院号、性别、年龄、民族、婚姻状态、住院天数、总费用、药品费用占比、胃肠道基础疾病等。用药和治疗指标包括利那洛肽使用天数、是否进行胃肠镜检查、胃肠镜结果、胃肠道主要症状、联合使用的胃肠道药物、是否使用止痛药、腹痛症状缓解情况、IBS-C症状缓解的效益比。

2 结果
2.1 PSM匹配及基线结果 本研究共纳入158例IBS伴有便秘的患者,对照组104例,治疗组54例。PSM匹配前,两组患者婚姻状态差异有统计学意义(P<0.05),见表1。匹配后,两组各纳入患者46例,两组患者的性别、年龄、民族、婚姻状态、工作现状、胃肠道基础疾病、药品费用占比和医保类型比较差异均无统计学意义(P>0.05),具有可比性,基线一致,见表2。
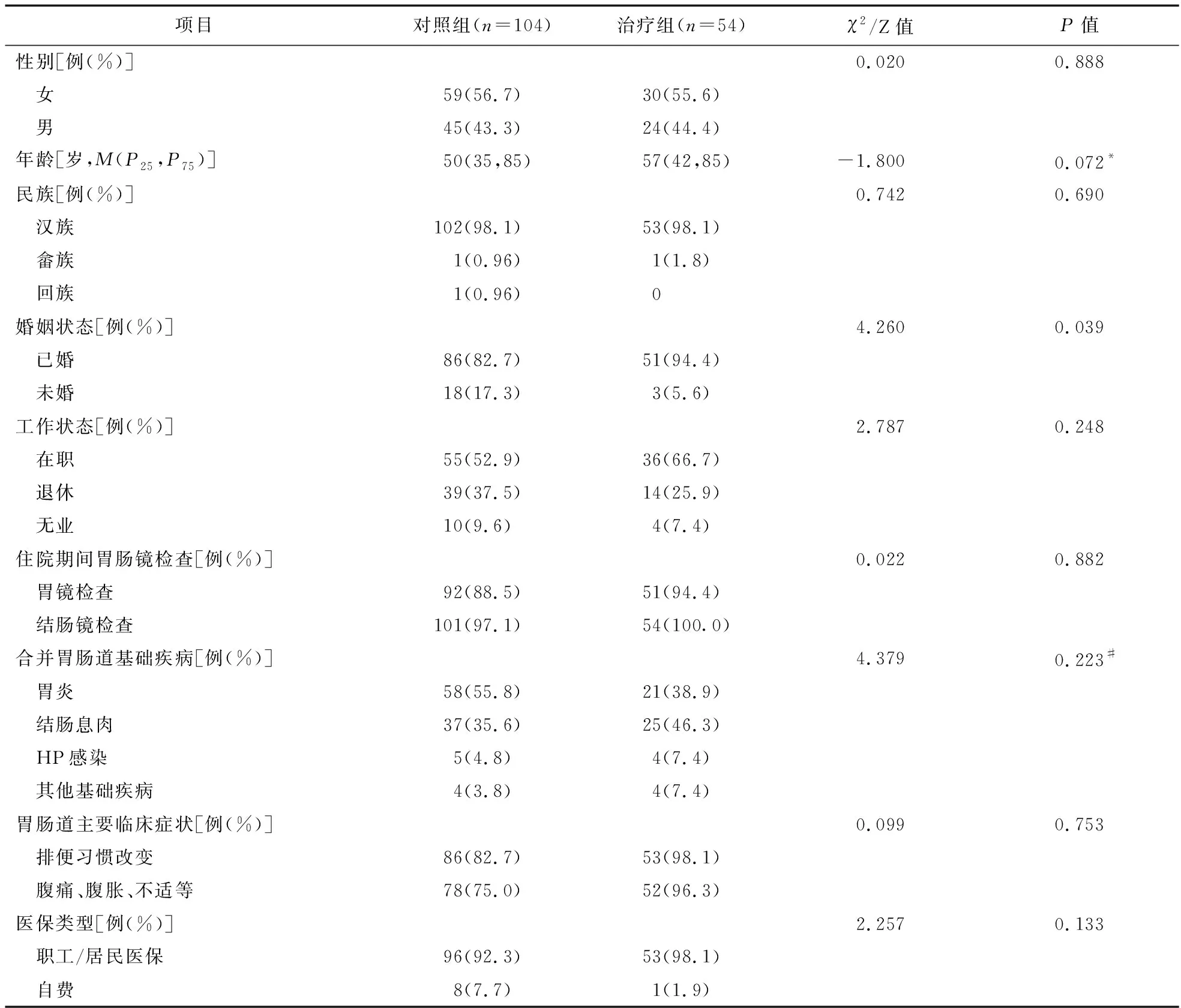
表1 PSM匹配前两组患者的基本信息比较

表2 PSM匹配后两组患者的基本信息比较
2.2 两组患者用药后疗效及不良反应比较 治疗组和对照组患者的胃肠镜检查比率、胃肠镜结果、胃肠道主要临床症状、联合使用的胃肠道药物(尤其是微生物制剂等)、止痛药的使用率以及不良反应比较,差异均无统计学意义(P>0.05)。两组患者均未出现严重的腹泻导致脱水或严重电解质代谢紊乱的情况。与对照组相比,使用利那洛肽治疗的患者的便秘和腹痛症状缓解更明显(P<0.05)。治疗组中有1例患者使用利那洛肽7 d后出现连续性腹泻,胃肠镜检查明确肠道肿物(息肉样,非恶性肿瘤),随后转至外科治疗后出院。还有1例患者使用利那洛肽10 d后,出现了黑便(大便隐血试验阳性++),随后的胃肠镜检查诊断为胃肠道严重的糜烂性溃疡伴出血,由于该患者使用的胃肠道药物较多,不能明确其大便出血是否与药物相关,遂停用了大部分可疑的胃肠道药物。见表3。
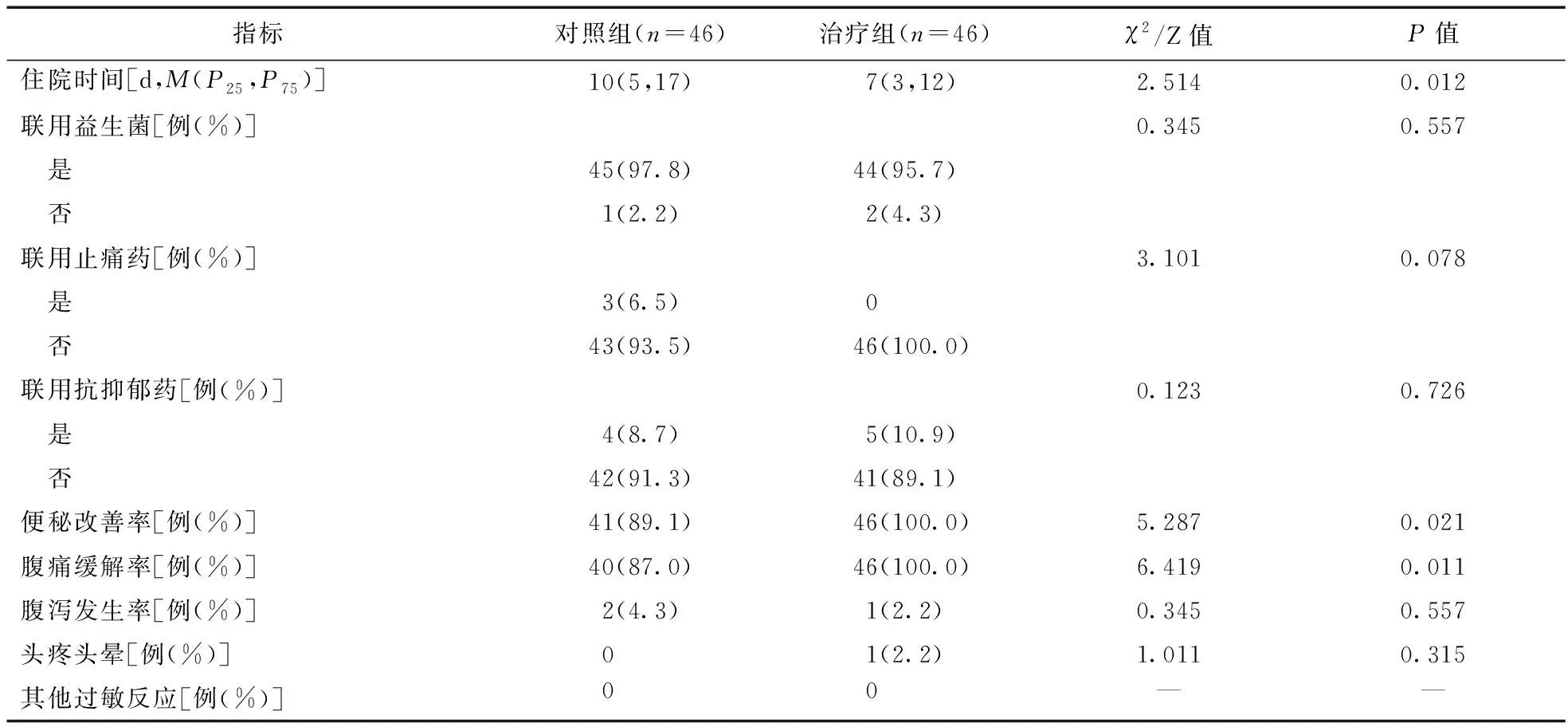
表3 两组患者用药后疗效和不良反应比较
2.3 费用指标 两组患者的住院总费用差异无统计学意义(P>0.05)。IBS-C患者住院期间用于缓解便秘症状的药品总费用与对照组相比显著降低(P<0.05)。见表4。

表4 两组患者的效益和成本的比较
3 讨论
IBS是一种常见的胃肠疾病,主要表现为腹痛、腹胀和排便习惯改变。其发生机制主要与肠道动力失调、内脏高敏感性、脑-肠轴功能失调、炎症反应、饮食和心理等因素相关。IBS-C是IBS的一个亚型,约占IBS的1/3[5],主要表现为腹部症状(如腹痛和腹胀)、大便量减少、大便硬、排便费力和排便不畅。通常建议改变生活方式或长期服用药物来控制IBS-C患者的症状,然而,这些治疗主要是缓解单一的症状,往往有多种治疗和药物的替换,没有达到令人满意的效果[16]。一项在我国进行的IBS所致经济负担的研究报告称,每年每个患者的总支出估计为18 262.7元[17]。因此,IBS给患者和医疗系统带来了巨大的经济负担。考虑到大多数IBS-C患者在推荐处方药物治疗前,通过不同的OTC类药物治疗和生活方式干预都未能获得缓解,促分泌剂如利那洛肽通常被首选作为一线处方药物。IBS患者常出现便秘、腹痛、腹部不适或腹胀等症状,大量研究已证明利那洛肽对上述症状有效,现指南强烈推荐利那洛肽作为这一常见的功能性胃肠病的一线药物选择[18]。
2019年及以前的多项临床试验显示,与安慰剂相比,利那洛肽治疗可显著改善腹痛和排便,然而,来自临床试验的数据可能不能准确地反映临床实践的设定[19]。关于利那洛肽治疗IBS-C的真实研究很少,在中国甚至亚洲也没有关于利那洛肽使用的真实研究[20]。最近在我国开展的一项多中心、前瞻性、单臂、观察性的真实世界研究(队列研究),通过评估患者的排便、腹部症状、IBS症状严重程度量表(IBS-SSS)、IBS生活质量问卷(IBS-QOL)、Zung焦虑自评量表(SAS)和抑郁自评量表(SDS)在接受利那洛肽治疗12周的IBS-C患者中的变化,确定了利那洛肽在临床实践中的有效性和安全性[21]。
本回顾性研究表明,利那洛肽在缓解IBS-C患者的临床症状(如便秘、腹痛、排便习惯改变等)方面是可行和安全的。经过PSM匹配后,使用利那洛肽和未使用利那洛肽的两组患者基线情况达到一致。从两组患者联合用药方面看,治疗组和对照组在联合使用益生菌、止痛药和抗抑郁药物上没有明显差异。IBS-C患者应用利那洛肽时,腹泻、腹痛和头晕头痛等不良反应的发生情况与对照组相比,差异无统计学意义,证明其在真实世界研究中具有一定的安全性。与用药前相比,利那洛肽可明显缓解IBS-C患者的便秘和腹痛症状,与传统治疗药物相比,差异有统计学意义。使用利那洛肽可以减少患者因便秘和腹痛等肠道不适症状住院的时间,同时还能降低IBS-C患者的用药成本(缓解IBS-C症状所需的药物费用和便秘改善所需药物费用显著降低)。
IBS-C一方面以腹部症状多见,传统治疗主要以多潘立酮、胃复安、莫沙必利、匹维溴铵或曲美布汀等胃肠动力调节剂为主,另一方面以便秘症状为主,治疗上常依赖于容积性、渗透性以及刺激性泻剂如小麦纤维素颗粒、乳果糖口服溶液、聚乙二醇4000散、开塞露、酚酞片、番泻叶、芦荟等。利那洛肽既可以改善便秘症状,又对内脏高敏感所致的腹部症状有缓解作用,故在IBS所含的两种症状治疗的指南中均被列为可供选择的药物[3,22]。本研究中,经利那洛肽或经传统药物治疗的患者的便秘症状均有明显的改善,可能与药物作用于肠道传输功能、内脏敏感性、肠道免疫功能、肠道微生态失衡等多种因素有关[23]。且治疗组与对照组相比,改善更显著,可能与利那洛肽的双作用机制(增加肠道传输和降低内脏敏感性)有关,因此在IBS-C患者治疗初期,利那洛肽起效较快,与本研究的治疗组缓解IBS-C患者症状的疗效/成本比有更优的结果一致。利那洛肽治疗也能显著改善患者的生活质量。此前的一项Ⅲ期临床试验表明,与安慰剂相比,利那洛肽显著改善了生活质量,在接受利那洛肽治疗12周后,超过一半以上患者的IBS诱导的-生活质量评分(IBS-QOL)得到了改善[24]。
本研究发现,与利那洛肽治疗相关的不良事件是腹泻,与我国最近为期12周的队列研究中观察到的利那洛肽的安全性以及前期III期临床试验中观察到的情况相似[7,21],没有迹象表明长期使用利那洛肽会出现额外的不良事件。王浩等[25]基于FAERS数据库对利那洛肽上市后的不良事件进行全面的挖掘分析,得出利那洛肽相关性的不良事件报告数前五位为腹泻、便秘、腹胀、腹痛和腹部不适。腹泻是最常见的与治疗相关的不良反应,约11.3%的患者接受利那洛肽治疗后出现轻度腹泻,但没有严重腹泻[10]。在临床实践中,腹泻被认为是药物活性的标志,而不是许多患者的不良事件[26]。不良事件可能也与利那洛肽的服用时间、用药疗程以及其他药物相互作用有关。利那洛肽用于IBS-C患者的推荐使用时间是首餐前至少30 min服用,疗程持续2周疗效更优,服药期间避免同时服用其他促动力或促分泌的药物。
本研究存在一定的局限性,由于IBS属于胃肠道功能性疾病,在临床上IBS的诊断本身具有一定的挑战性,且较少把IBS作为主诊断收治患者,导致本研究的病例数可能偏少。大部分IBS-C患者都采用过其他药物治疗,效果不明显才启用利那洛肽治疗,因此,与对照组相比,治疗上可选择的药物可能较少,亦可理解为对照组治疗无效的患者大部分成为了利那洛肽的治疗组。在真实的临床诊疗过程中,由于患者自行服用的一些维生素、纤维素以及特殊饮食,为利那洛肽的疗效评估带来较多的混杂因素。此外,益生菌、活菌等微生物制剂的广泛使用可能影响患者的胃肠道菌群的稳态系统,促进或者抑制肠道上皮细胞酶和受体的代谢,从而可能影响利那洛肽的作用靶点。
IBS患者通常对使用处方疗法治疗便秘相关症状有所顾虑。一项对美国人群的调查发现,超过90%的特发性便秘患者完全依赖OTC类药物来控制便秘症状[6],在向医疗机构寻求进一步治疗前,他们平均尝试过3次OTC类药物,即表明其不愿意加强治疗,这样从心理上对新的处方药物治疗期待度下降。当不停更换IBS患者的药物治疗方案时,对其进行健康科普教育,有助于缓解便秘等功能性胃肠障碍,尤其应该让患者意识到各种症状反应的时间(肠道及腹部症状)可能是可转变的,例如:排便频率的最佳改善可能相当快(几小时到几天内),而腹痛、腹部不适和腹胀的最大改善可能延迟几周至几个月。同时,联合使用某些药物,如非甾体类抗炎药可能会影响其他药物的疗效,在药物治疗过程中,也应注意药物之间的相互作用。对于IBS-C患者症状的改善和缓解,最简单、直接的治疗策略是采用单一疗法,理想情况下,单一药物可明显改善症状。然而,对于一些患者来说,单一药物可能不足以完全缓解症状。排除严重器质性病变导致的排便障碍后,可能需要联合治疗以达到更优疗效[27-28]。在充分考虑到患者的风险/获益平衡后,应考虑联合治疗。
综上所述,利那洛肽治疗IBS-C 1周及以上疗程后,对患者的便秘和腹痛症状有明显的改善作用,且能在降低用药成本的前提下,更快地缓解IBS-C的症状。
