程序性死亡受体1/ 程序性死亡配体1 免疫抑制剂联合化疗治疗晚期转移性三阴性乳腺癌的疗效
2023-08-05钱钰婷夏俊贤通信作者李梦君
钱钰婷,夏俊贤(通信作者),李梦君
1 暨南大学 (广东广州 510632);2 暨南大学第二临床医学院 (广东深圳 518020)
三阴性乳腺癌(triple negative breast cancer,TNBC)发病率占全部乳腺癌的15%~20%,因极具侵袭性且缺乏有效的靶向治疗方案,其预后不良[1],因此,亟需更有效的治疗方法。TNBC 具有高肿瘤浸润淋巴细胞和细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)水平表达,因此,程序性死亡受体1(programmed cell death protein 1,PD-1)/PD-L1 抑制剂的免疫治疗成为TNBC 患者的治疗方法[2-3]。有研究表明,PD-1 抑制剂(帕博利珠单抗)和PD-L1 抑制剂(阿特珠单抗)在转移性三阴乳腺癌(metastatic triplenegative breast cancer,mTNBC)中显示出较好效果[4]。然 而,IMPassion 131 试 验 在mTNBC 中 得出阴性结果[5]。所以,本研究主要分析PD-1/PDL1 免疫抑制剂在mTNBC 中的总体疗效并进行亚组分析。
1 对象与方法
本研究依据系统回顾和荟萃分析的首选报告项目(PRISMA)的2020 年更新版指南[6]进行。
研究对象:具有病理确诊的mTNBC 患者,年龄≥18 岁。
干预措施:免疫联合化疗组采用免疫联合化疗;对照组采用单纯化疗。
研究结局:首要研究终点为无进展生存期(progression-free survival,PFS)和 客 观 缓 解 率(objective response rate,ORR)[ORR= 完全缓解+部分缓解];次要研究终点为总生存(overall survival,OS)和安全性。
研究设计:Ⅲ期随机对照临床试验(randomized controlled trial,RCT)。
文献检索策略:检索PubMed、Embase、The Cochrane Library 数据库,时间限制于2022年3月前,由两位研究者(YQ 及JX)制定检索策略并检索。
文献筛选与资料提取:提取的数据包括纳入研究的一般特征、患者的基本信息和主要结果。纳入研究的一般特征包括第一作者、发表年份、试验名称、国家临床试验注册号、试验设计、参与者数量和类型、治疗方案、中位随访持续时间。患者的信息包括年龄、种族、绝经状态、美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分、PD-L1 表达水平和既往化疗的使用情况。此外,PFS、ORR、OS 和安全性结果也进行了提取。
纳入研究的质量评价:纳入的RCT 用Cochrane 评估工具进行质量评估[7]。
统计学方法:数据采用风险比(hazard ratio,HR)和优势比(odds ratio,OR)统计。使用Review Manager version 5.4 软件进行分析。使用Chi2 检验和I2值评估异质性。显著性水平设置为P<0.05。
2 结果分析
共检索出1 814 项研究。通过研究筛选流程(图1),最终纳入3 项Ⅲ期RCT[5,8-9],纳入2 400 例mTNBC 患者,其中免疫联合化疗组1 448 例,对照组952 例。根据ECOG 评分,大多数(70%)患者ECOG 评分为0 分。在免疫联合化疗组中46%(801 例)的患者PD-L1 水平阳性,单纯化疗组中65%(496 例)的患者PD-L1 水平阳性。两组约30%患者出现肝转移[5,8-9]。
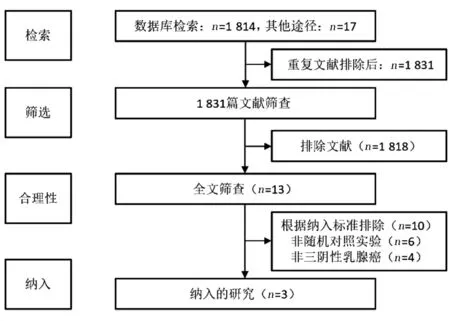
图1 研究筛选流程
2.1 文献质量评估
文献质量评估人员使用Cochrane 评估工具进行评估。所有纳入的RCT 均为双盲试验[5,8-9]。
2.2 PFS
3 项研究(2400 例mTNBC 患者)均报告了PFS[5,8-9]。本荟萃分析表明,免疫联合化疗可以显著延长意向性分析(intention-to-treat,ITT)人群(将所有受试者纳入分析、评估和比较的范围内)的PFS {HR:0.82 [0.74,0.90],P<0.0001}(图2)。
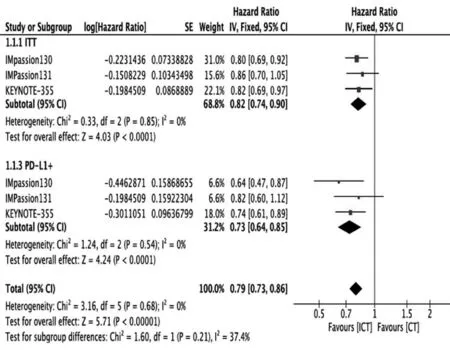
图2 在mTNBC 中免疫联合化疗组较单纯化疗组的PFS分析:ITT 人群和PD-L1(+)人群
PD-L1(+)的亚组中也得到类似结果{HR:0.73 [0.64,0.85],P<0.0001}(图2)。
2.3 ORR
在ITT 人群中(2 400 例),免疫联合化疗组的ORR 显著高于单纯化疗组{OR:1.38[1.16,1.63],P=0.0002}(图3)。PD-L1(+)的亚组中,免疫联合化疗组中的ORR 也显著提高{OR:1.58[1.25,1.99],P=0.0001}(图3)。
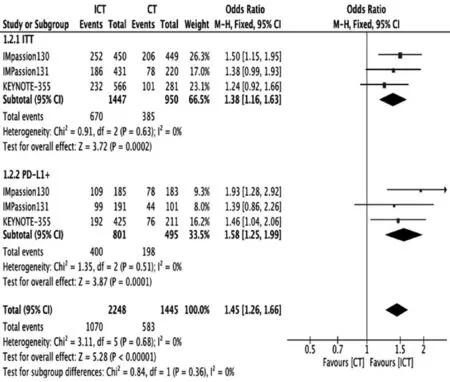
图3 在TNBC 中免疫联合化疗组与单纯化疗组ORR 值分析:ITT 人群和PD-L1(+)人群
2.4 OS
仅2 项研究报道了OS[5,9]。本荟萃分析表明,在mTNBC 患者中免疫治疗没有显著改善OS{HR:0.97 [0.75,1.25],P=0.80}(图4)。PD-L1(+)亚组也未改善OS {HR:0.87 [0.56,1.34],P=0.53}(图4)。
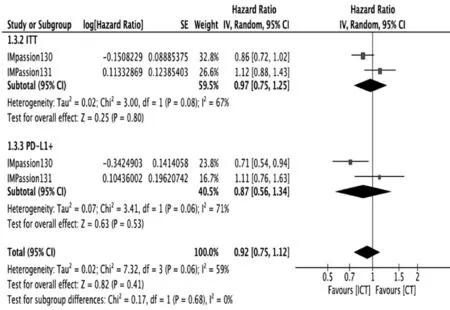
图4 免疫联合化疗在TNBC 中的总生存分析:ITT 人群和PD-L1(+)人群
2.5 亚组分析
评估患者不同亚组(年龄、种族、ECOG 表现状态、PD-Ll 表达、是否有肝转移和既往是否接受过化疗)对免疫联合化疗疗效的影响(图5)。年龄<65 岁{HR:0.83[0.73,0.94],P=0.004}、≥65 岁{HR:0.71 [0.57,0.89],P=0.003}和ECOG 表现状态0{HR:0.80 [0.70,0.91],P=0.001}和1{HR:0.81[0.72,0.92],P=0.001}对疗效没有影响,因为所有纳入的亚组研究结果都表明,免疫联合化疗显著延长了PFS。免疫联合化疗在白种人{HR:0.80[0.70,0.91],P=0.0007}及亚裔患者{HR:0.73[0.58,0.93],P=0.01}中均显著延长了PFS。免疫联合化疗在无肝转移{HR:0.80 [0.68,0.94],P=0.001}和既往 无 接 触 过NACT/ACT {HR:0.68 [0.56,0.81],P<0.00001}的患者中同样有PFS 获益。在PD-L1(-)组{HR:0.98 [0.83,1.15],P=0.80}、非洲裔美国人{HR:0.72 [0.42,1.24],P=0.24}、既往接触过NACT/ACT {HR:0.88 [0.77,1.01],P=0.07}及有肝转移{HR:0.82 [0.65,1.04],P=0.10}的患者中免疫联合化疗未达到PFS 优势(图5)。
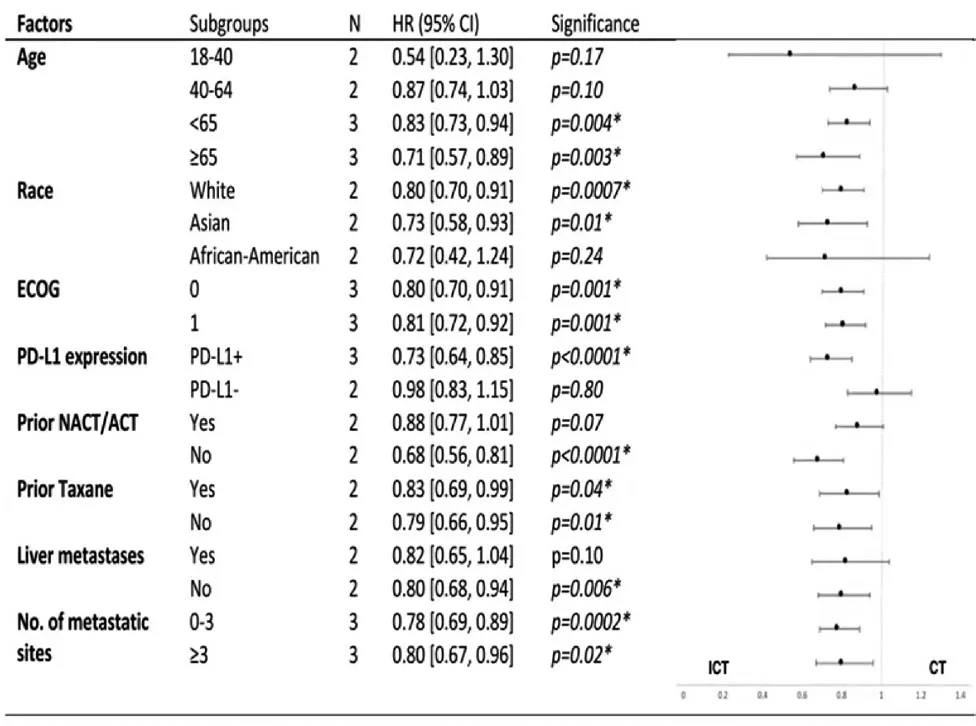
图5 亚组分析免疫治疗联合化疗对无进展生存的影响
2.6 毒性数据
毒性数据主要包括任何不良事件、治疗相关不良事件、严重不良事件、≥3 级不良事件和免疫治疗相关不良事件,免疫相关不良事件也称为特别关注的不良事件[5,8-9]、致命不良事件。
有2 项RCT 报告了任何不良事件,荟萃分析表明,两组比较差异无统计学意义{OR:1.87 [0.76,4.58],P=0.17}[5,9]。免疫联合化疗组较单纯化疗组更易出现严重不良事件{OR:1.40[1.08,1.80],P=0.01}[5,9]。3 项RCT 均报告免疫联合化疗组≥3 级不良事件的发生率较单纯化疗组显著升高{OR:1.32[1.11,1.57],P=0.002}[5,8-9]。此外,两组致命不良事件发生率相似{OR:1.01 [0.38,2.67],P=0.98}[5,8-9]。其中在≥3 级免疫治疗相关不良事件中,免疫联合化疗组较单纯化疗组有更高的免疫性肺炎(P=0.09)和免疫性肝炎(P=0.09)发生率。
3 发表偏倚
本研究因纳入文献较少(<10 篇),所以对PFS和≥3级不良事件的结果未进行发表偏倚检测。
4 讨论
PD-1 抑制剂和PD-Ll 抑制剂作为单一疗法或与化疗联合治疗mTNBC 有一定的疗效[4]。对OS 来说,与化疗相比,免疫治疗没有改善OS[10]。与既往研究[11]相似,免疫联合化疗在ITT 人群和PDL1(+)人群中均无OS 获益。IMPassion131 试验得到类似结果[5,9]。相反的是,在IMPassion130 试验中,不管是在ITT 人群还是在PD-Ll(+)人群中免疫联合化疗均显著提高了OS(ITT:HR:0.86 [0.72,1.02],P=0.078;PD-L1(+):HR:0.71 [0.54,0.94])[5,9]。
对于PFS 来说,本研究与既往研究[10]相似,免疫联合化疗在mTNBC 患者中可以延长PFS,在PD-L1(+)患者中,免疫治疗降低了20%的进展风险。IMPassion131 试验也得到类似结果。亚组分析显示亚裔、PD-Ll(+)、0-3 个转移部位、既往未接触过化疗、无肝转移的基线特征的患者有更好的PFS。1 项纳入19 项临床试验的荟萃分析[12]显示,亚裔和非亚裔在免疫治疗中均显著提高了PFS和OS。PD-L1 表达水平越高,免疫治疗对PFS 改善更显著。1 项荟萃分析表明,PD-L1(+)TNBC患者的1 年PFS 高于PD-L1(-)患者{1 年PFS:OR:1.55[1.02,2.36],P=0.04}[13]。
对于ORR 来说,既往荟萃分析[10]表明,免疫联合化疗在mTNBC 患者中可以提高ORR。在PDL1(+)患者中,免疫治疗提高了10% ORR。该结果也在另一荟萃分析[13]中得到验证{ORR:OR:1.44[1.09,1.91],P=0.0l}。
IMPassion130 与IMPassion131 试验之间的明显差异包括化疗药物不同(白蛋白紫杉醇对紫杉醇)、亚裔与非亚裔比例不同(18%、29%)、新发转移性患者比例不同(37%、31%)[5,9]。IMPassion131 试验有争议的论点是试验中允许同时使用类固醇类药物[5,14],因此类药物的免疫抑制活性可能与免疫治疗的抗肿瘤活性有关[11,15]。另外,既往的治疗方案线数对免疫治疗有负面影响[16-18]。
与预期一样,免疫治疗增加不良反应事件,主要表现为免疫治疗相关不良事件。免疫治疗相关不良事件需要特殊考虑和管理[15]。本研究表明,免疫治疗相关不良事件包括甲状腺功能减退、甲状腺功能亢进、肺炎、皮疹、结肠炎、肾炎和胰腺炎等。
本研究的不足包括纳入的研究较少,且在药物类型(PD-1 或PD-Ll 抑制剂)、化疗药物、PDLl 检测方法和种族方面存在差异。这些差异都可能导致荟萃分析中的异质性。
5 结论
免疫联合化疗可显著延长mTNBC 患者的PFS,并提高mTBNC 患者的ORR,仅中度增加免疫相关不良反应。就OS 而言,需要更多的随访及临床研究确定其长期疗效。
