非酒精性脂肪肝患者外周血NLR、TG/HDL-C变化及其临床意义
2023-08-04肖阳赵俊涛
肖阳,赵俊涛
(新郑市公立人民医院 消化内科,河南 郑州 451100)
非酒精性脂肪肝是临床常见的消化内科疾病,其发病原因为肝实质细胞脂肪变性以及脂肪异常囤积无法排出体外[1]。近年来,随着生活水平的逐步提高,非酒精性脂肪肝的发病率也呈现上升趋势,对患者生命健康和生活质量产生了严重影响[2]。目前,临床对非酒精性脂肪肝的诊断主要依靠肝脏影像学、肝活体组织学等为主要手段[3],但存在价格高,有创性的问,故寻找无创且价格低廉的检查手段是目前研究的重点。相关研究表明[4],非酒精性脂肪肝患者肝功能存在不同程度的损伤,且炎症反应和脂质代谢紊乱在非酒精性脂肪肝的病程发展中发挥重要作用。中性粒细胞/淋巴细胞(NLR)是亚临床炎性反应的指标,检测方便且价格低廉,实际应用中只需检查血常规即可,在预测肝损伤风险、肝硬化肝癌预后方面有重要作用[5-6]。另有相关研究表明[7],三酰甘油(TG)/高密度脂蛋白胆固醇(HDL-C)是反应脂代谢的生化指标,与非酒精性脂肪肝患者肝功能损伤和发生风险有关。基于此,推测将NLR、TG/HDL-C 两者联合应用于非酒精性脂肪肝中是否可以提升临床诊断价值,故本研究针对NLR、TG/HDL-C 水平在非酒精性脂肪中的诊断价值展开探究,以期为临床研究提供借鉴。
1 资料与方法
1.1 一般资料
选取2019 年6 月至2022 年6 月新郑市公立人民医院收治的112 例非酒精性脂肪肝患者作为研究组,另选取同期健康体检者112 例作为对照组。研究组男60 例,女52 例;年龄40~76 岁,平均(52.33±2.44)岁;平均体质量指数(BMI)(26.44±3.22)kg/m2;平均腰围(93.67±8.54)cm。对照组男58 例,女54 例;年龄41~76 岁,平均(52.66±2.77)岁;平均BMI(24.67±2.87)kg/m2;平均腰围(82.33±8.11)cm。两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。纳入标准:①研究组均符合《非酒精性脂肪性肝病防治指南(2018 更新版)》[8]中相关诊断标准;②对照组均经体检身体健康;③受试者均知情同意。排除标准:①合并心脑血管疾病或恶性肿瘤性疾病者;②合并长期饮酒者;③严重心、肝、肾功能异常者;④合并感染性疾病者;⑤自身免疫性疾病及获得性或先天性免疫缺陷性疾病者;⑥合并病毒性肝炎等其他类型的肝胆系统疾病者;⑦合并甲状腺功能减退、肾上腺皮质功能亢进症等。
1.2 方法
采集受试者清晨空腹静脉血6 mL,使用全自动生化分析仪检测肝功能指标[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GGT)]、TG 和HDL-C 水平,采用血液分析仪检测中性粒细胞、淋巴细胞计数,并计算NLR 和TG/HDL-C 值。
1.3 观察指标
①比较研究组和对照组外周血NLR、TG/HDL-C、ALT、AST、γ-GGT;②分析非酒精性脂肪肝患者外周血NLR 与TG、HDL-C、TG/HDL-C的相关性;③分析非酒精性脂肪肝患者外周血NLR、TG/HDL-C 与肝功能指标的相关性;④应用受试者工作特征(ROC)曲线分析NLR、TG/HDL-C及二者联合检测对非酒精性脂肪肝的诊断价值。
1.4 统计学方法
采用SPSS 18.0 软件进行数据处理。计量资料均行正态性检验,符合正态分布的计量资料以均数±标准差()表示,采用独立样本t检验,不符合正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,采用Mann-WhitneyU检验;计数资料以百分率(%)表示,采用χ2检验;应用Pearson 相关性分析外周血NLR、TG/HDL-C 与非酒精性脂肪肝患者肝功能的相关性,以及NLR 与TG、HDL-C、TG、HDL-C 的相关性,另应用ROC 曲线特征分析NLR、TG/HDL-C 对非酒精性脂肪肝的诊断价值。P<0.05 为差异有统计学意义。
2 结果
2.1 两组外周血NLR、TG/HDL-C、ALT、AST、γ-GGT 比较
研究组NLR、TG/HDL-C、ALT、AST、γ-GGT均高于对照组,差异有统计学意义(P<0.05)。见表1。
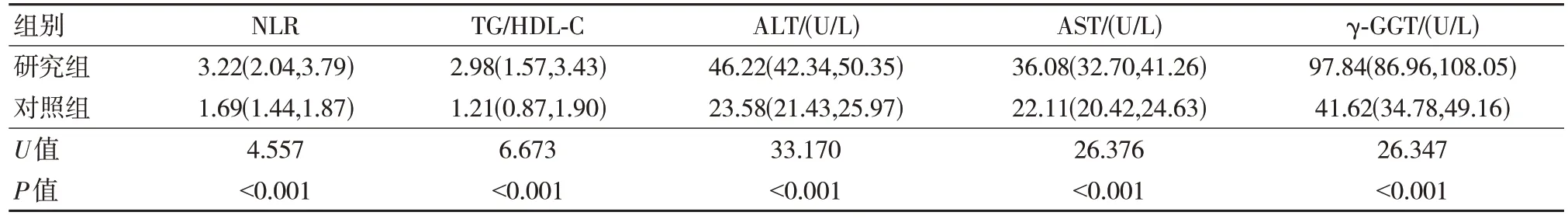
表1 两组外周血NLR、TG/HDL-C、ALT、AST、γ-GGT 比较 [n=112,M(P25,P75)]
2.2 非酒精性脂肪肝患者外周血NLR 与TG、HDL-C 和TG/HDL-C 的相关性分析
非酒精性脂肪肝患者外周血NLR 与TG、TG/HDL-C 均呈正相关(P<0.05),与HDL-C 呈负相关(P<0.05)。见表2。

表2 非酒精性脂肪肝患者外周血NLR 与TG、HDL-C 和TG/HDL-C 的相关性分析
2.3 非酒精性脂肪肝患者外周血NLR、TG/HDL-C与肝功能指标的相关性分析
非酒精性脂肪肝患者外周血NLR、TG/HDL-C与ALT、AST、γ-GGT 均呈正相关(P<0.05)。见表3。

表3 非酒精性脂肪肝患者外周血NLR、TG/HDL-C与肝功能指标的相关性分析
2.4 NLR、TG/HDL-C 单项及联合检测对非酒精性脂肪肝患者的诊断价值
NLR、TG/HDL-C 两者联合检测非酒精性脂肪肝的灵敏度高于单独检测,差异有统计学意义(χ2=4.082,P=0.043;χ2=13.691,P<0.001),AUC 也高于单独检测,差异有统计学意义(Z=2.845,P=0.004;Z=4.376,P<0.001),但特异度与单独检测比较差异无统计学意义(χ2=0.092,P=0.762;χ2=0.592,P=0.442)。见表4、图1。

图1 NLR、TG/HDL-C 单项及联合对非酒精性脂肪肝患者诊断价值的ROC 曲线

表4 NLR、TG/HDL-C 及二者联合检测对非酒精性脂肪肝患者的诊断价值
3 讨论
非酒精性脂肪肝由除酒精和其他明确的损肝因素所致,以弥漫性肝细胞大泡性脂肪变性为主要特征[9],在普通成人中发病率约为20%~33%,但在肥胖及2 型糖尿病患者发病率高达75%[10]。相关研究表明[11],非酒精性脂肪肝患者若未能及时诊断进行治疗,将由单纯脂肪肝转变为肝炎、肝硬化等疾病,部分患者甚至进展为肝衰竭、肝癌等,严重威胁患者生命健康。因此,探讨早期诊断非酒精性脂肪肝的实验室指标对指导临床治疗、改善患者预后具有重要意义。
本研究发现非酒精性脂肪肝患者外周血NLR、TG/HDL-C 均高于正常人群,且此类患者外周血NLR 与TG、TG/HDL-C 均呈正相关,与HDL-C 呈负相关,提示非酒精性脂肪肝患者存在炎症反应、脂质代谢紊乱,且二者关系密切。肝脏是脂质代谢与脂蛋白合成的重要器官,正常生理状态下肝脏摄取血液内游离脂肪酸生成TG,并释放TG 和载脂蛋白合成的脂蛋白进入血液[12]。但非酒精性脂肪肝患者TG 在肝脏内大量聚集,且随着TG 水平增加,肝脏超负荷运转,肝细胞出现脂肪变性,HDL-C 合成减少,TG/HDL-C 升高,引起脂质代谢紊乱[13-14]。同时,脂质代谢紊乱会诱导细胞氧化应激反应,引起内质网和线粒体功能障碍,促进活性氧的产生,进而使肝细胞凋亡并产生炎症反应[15]。NLR 是中性粒细胞和淋巴细胞的比值,中性粒细胞在非酒精性脂肪肝患者受炎症反应的影响时激活并大量募集,引起机体释放大量炎症细胞因子,促使淋巴细胞自身消耗与凋亡,加上淋巴细胞向肝内转移,外周血淋巴细胞数逐渐减少,NLR 呈升高趋势[16]。
本研究还发现,非酒精性脂肪肝患者ALT、AST、γ-GGT 均高于正常人群,且外周血NLR、TG/HDL-C 均与ALT、AST、γ-GGT 呈正相关,表明非酒精性脂肪肝患者肝功能异常,且与NLR、TG/HDL-C 关系密切。非酒精性脂肪肝是临床常见慢性肝病之一,ALT、AST、γ-GGT 作为肝功能相关指标,在非酒精性脂肪肝患者中呈现高表达,这与TUTUNCHI 等[17]的研究结果相一致。TG 是一种脂质或脂肪,HDL-C 则是一种有益的胆固醇分子,可以将脂肪胆固醇从体内运输到肝脏,进行排泄或再利用。相关研究发现[18],当脂质水平较高时脂肪将在肝脏内淤积诱发脂肪肝,损伤肝功能损伤,且肝功能损伤后则会进一步加重脂质代谢紊乱。NLR 主要反应机体的炎症状态,有关研究指出[19],肝细胞受损后会释放DAMP,并通过TLR4 和TLR9 信号通路激活中性粒细胞,进而激活Kuffer 细胞,促进IL-1β、IL-6 和TNF-α 的分泌,进而导致更多的肝细胞坏死,加重肝功能损伤。
ROC 曲线分析显示,NLR、TG/HDL-C 二者联合检测非酒精性脂肪肝的敏感度、AUC 均高于NLR、TG/HDL-C 单独检测,提示NLR、TG/HDL-C二者联合检测更有利于诊断、评估非酒精性脂肪肝患者病情。NLR 是两种不同却互补的免疫途径的比值,稳定性高,具有白细胞亚型的特质,在非酒精性脂肪肝的诊断和预测疾病的预后中具有重要价值[20]。TG 和HDL-C 是诊断代谢综合征的两种重要的脂质指标,可以反应脂质脂蛋白组分之间的总体相互作用,既往在CATANZARO 等[21]的研究中发现,TG/HDL-C 对非酒精性脂肪肝具有诊断价值。故本研究将NLR、TG/HDL-C 联合应用于非酒精性脂肪肝的临床诊断,从炎症、脂质方面共同进行诊断,显著提升了灵敏度,弥补单独检测的局限性,值得临床推广应用。
综上所述,非酒精性脂肪肝患者外周血NLR、TG/HDL-C 较高,且两者存在相关性,均与非酒精性脂肪肝患者肝功能损伤有关,且联合应用有助于临床诊断非酒精性脂肪肝。
