体外共培养诱导人羊膜上皮细胞向软骨细胞分化的初步研究
2023-08-04王康智晓东张玉强张文景王伟
王康,智晓东,张玉强,张文景,王伟
作者单位: 315040 宁波,宁波大学附属人民医院(王康);锦州医科大学附属第一医院(智晓东、张玉强、张文景、王伟)
骨关节炎(OA)的治疗关键在于软骨再生,但是目前药物治疗、物理治疗对于早中期OA 的治疗并没有逆转病程进展的确切疗效[1]。近些年来,干细胞治疗OA 的良好效果受到了普遍的关注[2]。常用的干细胞包括脂肪间充质干细胞(ADMSCs)、骨髓间充质干细胞(BMSCs)及脐带间充质干细胞(UCMSCs)等[3-4],但目前仍存在着许多局限性。人羊膜上皮细胞(hAECs)是近年来在干细胞治疗领域广受关注的“种子细胞”之一[5]。hAECs 较其他干细胞取材方便、来源丰富、免疫原性低,且hAECs 具有非致瘤性,应用更具安全性[6-7]。虽然以往有研究通过添加各种诱导试剂成功诱导了hAECs 软骨分化,但是这种诱导方法过程繁琐,而且无法在体外研究移植hAECs 至关节腔后与软骨细胞的相互作用[8]。而基于transwell 小室的共培养技术诱导方法具有操作方便、成本低和可建立研究两种细胞相互作用模型的优势。本研究以hAECs为前体细胞,在体外培养条件下,定向诱导分化为软骨细胞,以探讨其在OA细胞疗法上的应用前景,现报道如下。
1 资料与方法
1.1 材料来源 人关节软骨细胞购买于ProCell 公司,批号202102254。剖宫产后的羊膜收集自锦州医科大学附属第一医院妇产科,并获得伦理委员会批准。排除胎儿畸形,产妇先天性遗传病,及甲型肝炎、乙型肝炎、HIV、梅毒等传染病史,产妇术前签署了知情同意书。
1.2 hAECs的原代分离、纯化、培养以及传代 用镊子及直钳将羊膜从胎盘钝性剥离下来,0.9%氯化钠溶液洗净。用含100 U/ml 盘尼西林、100g/ml 链霉素的PBS 液200 ml 漂洗羊膜组织2 ~3 次,除去血细胞,2 h 内处理标本。从PBS 中取出羊膜,沥干多余水分,置于灭菌培养皿中,剪成3cm2左右,挪至10cm培养皿中。加入0.25%胰酶20ml,剪碎,转移至细胞筛网中,用瓶底研磨10 min,37 ℃恒温水浴锅中消化30 min,用200 目钢网过滤以去除组织块。加入5 ~10 ml FBS 中和胰酶,收集细胞悬液。未消化的羊膜组织可以继续用胰酶消化2 ~3 次。所有的细胞悬液,1200r/min 离心3min,弃上清,培养液重悬沉淀。台盼蓝计数,以1×105/cm2接种到直径为10 cm 的培养皿中。置体积分数为37 ℃、5%CO2细胞培养箱内培养2 h 后轻轻将未贴壁的细胞吸出,再接种于新培养皿中。在饱和湿度、37 ℃、5%CO2培养箱静置培养,48 h 后首次换液,待细胞达80%~90%融合时,用0.25%胰酶/0.02%EDTA 消化传代培养。
1.3 免疫组化鉴定hAECs 取第3 代hAECs,将细胞稀释至细胞浓度为2×107个/L,将1 ml 细胞悬液接种于培养皿中培养。24 h 后PBS 洗涤3 次,多聚甲醛固定,PBS 洗涤5 min;通透20 min,PBS 洗涤5 min×3 次。封闭,滴加一抗CK19(1∶1 000)或波形蛋白(1∶1 000),4 ℃过夜,PBS 洗涤5 min×3 次。滴加二抗(1∶100),孵育1 h,PBS 洗涤5 min×3 次。滴加DAPI 避光孵育5 min,PBS 洗涤5 min×3 次;封片,镜下观察。
1.4 流式细胞仪鉴定hAECs 取第3 代hAECs,将细胞浓度调整为1×105个/ml,离心,弃去上清液,将预先准备好的0.3%BSA 溶液加入EP 管中,每管200l,室温密封30 min,弃上清,加入小鼠抗人单克隆抗体分化簇CD73、CD90、CD105、CD29、CD34、CD45、SSEA-4 和HLA-DR,4 ℃静置20 min。上机检测细胞表型,IgG-PE 作阴性对照。从10 000 个活细胞中获取数据,并使用FCS Express 软件分析结果。
1.5 软骨细胞与hAECs 间接共培养体系的构建选择0.4m 的24 孔板transwell 小室。实验分为两组,实验组:在24 孔transwell 系统的上腔中接种4×104个自体关节软骨细胞(ACs),在培养板中接种了1×104hAECs。对照组:在24 孔transwell 系统的上腔中接种4×104hAECs,在培养板中接种1×104hAECs。每组有3 个复孔。将孔板置于37 ℃,5%CO2培养箱,每2 天更换一次培养基(含10%FBS的DMEM/F12培养基),诱导21d后行后续实验,见图1。
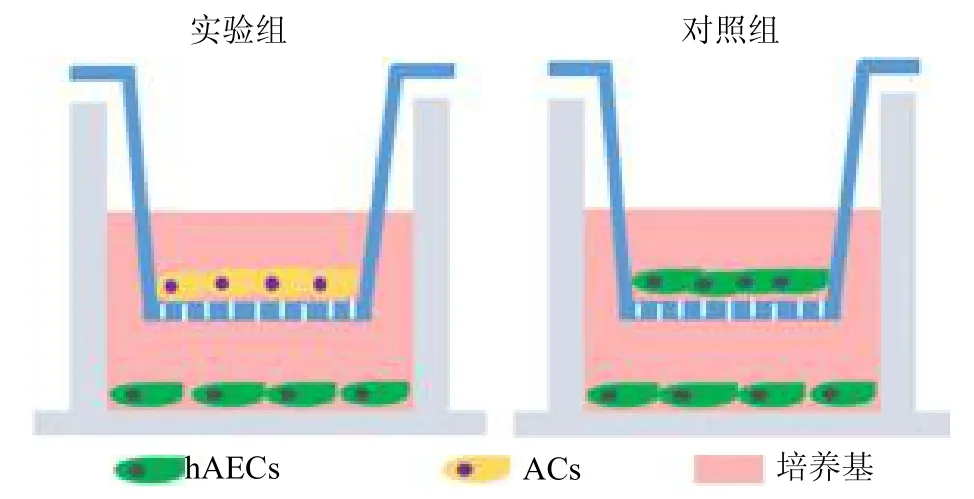
图1 hAECs 与ACs 共培养系统
1.6 甲苯胺蓝染色 将1.5 中所述的hAECs 共培养21 d 后,弃去培养基,PBS 洗涤3 次,40 g/L 多聚甲醛固定10min。PBS 洗涤3 次,0.1%甲苯胺蓝工作液常温染色30min。弃去染料,蒸馏水冲洗干净,镜下观察。1.7 免疫组化染色 将1.5 中所述的hAECs共培养21 d 后,制作细胞爬片,40 g/L 多聚甲醛固定30 min后,PBS 清洗3 次,每次5 min;3%的H2O2避光室温封闭30 min;蒸馏水洗3 次;封闭,置于湿盒;滴加适当浓度(1∶100)的一抗,4 ℃过夜;37 ℃复温30 min,PBS 洗3 次,每次5 min;滴加生物素化二抗(1∶200),置于湿盒,37 ℃孵育30 min。滴加辣根过氧化物酶,孵育40 min。PBS 洗3 次,每次5 min;DAB显色,苏木精复染;体积分数1%盐酸乙醇分色数秒,乙醇梯度脱水,封片,镜下观察。
1.8 Western-bolt 检测软骨细胞标志物 将1.5 中所述的hAECs 共培养21 d 后,弃培养基,用4 ℃预冷的PBS漂洗后,用Trizol 法提取蛋白质,经定量后取60g蛋白质,进行SDS-聚丙烯酰胺凝胶电泳,转膜,显影。COL1、COL2、AGGRECAN 和SOX9 一抗工作浓度为l∶500,GAPDH 一抗工作浓度为1∶1 000,4℃孵育过夜。滴加二抗山羊抗鼠IgG(1∶1 000),室温孵育2 h。加入A、B 液(ECL 系统)后化学发光,使用Quantity One 分析软件(BIO-RAD公司,美国)进行蛋白条带的定量分析,AU(area density)代表条带的面积×荧光强度,以各种蛋白/GAPDH 的AU 比值代表各自蛋白的相对含量。
1.9 RT-qPCR检测软骨细胞标志物 将1.5 中所述的hAECs 共培养21 d 后,弃培养基。用4 ℃预冷的PBS漂洗后,依次加入RNA提取液、三氯甲烷、异丙醇及75%乙醇等,提取总RNA,并测量总RNA的纯度和浓度。按照逆转录反应体系进行逆转录,使用GAPDH 作为内参进行PCR 扩增,95 ℃,预变性10 min,95 ℃15 s,60 ℃60 s 循环40 次,60 ℃→95 ℃,每15 s升温0.3 ℃制作熔解曲线。采用2-CT法计算ACs标志物COL1、COL2、AGGRECAN 和SOX9 mRNA的相对表达量,引物序列见表1。
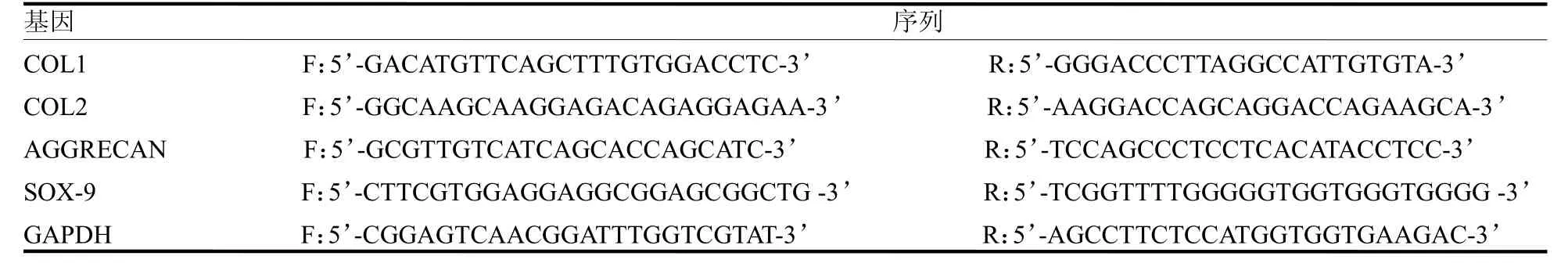
表1 PCR 引物序列
1.10 统计方法 使用SPSS 25.0软件进行统计分析。数据以均数±标准差表示,两组比较使用Student’s t检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 hAECs的形态学观察和鉴定 接种后2 ~3 d,细胞黏附在壁上,原代细胞(P0)呈现散在细胞团生长,具有很强的折射率,第3 代细胞(P3)hAECs呈现典型铺路石样的上皮细胞形态,见图2a;免疫荧光染色显示CK19 强表达,Vimentin 弱表达,见图2b。流式细胞术检测hAECs 表面标志物的表达,结果显示CD73、CD90、CD105、CD29 和SSEA-4 呈阳性,CD34、CD45 和HLA-DR 呈阴性,见图2c。

图2 hAECs 鉴定
2.2 共培养后hAECs 形态学观察、免疫组化和甲苯胺蓝染色 诱导共培养21 d 后,对照组hAECs 无明显变化,依然呈现典型的铺路石样改变;而实验组中的细胞则处于软骨形成分化阶段,呈现散在三角形或多角形形态。免疫组化和甲苯胺蓝染色显示COL2 和AGGRECAN出现大量表达,而对照组无表达,见图3。2.3 共培养后hAECs 中软骨细胞特异性蛋白相对表达量 实验组软骨细胞特异性蛋白COL2、COL1、AGGRECAN和SOX9 表达量均明显高于对照组(均P <0.05),见图4。
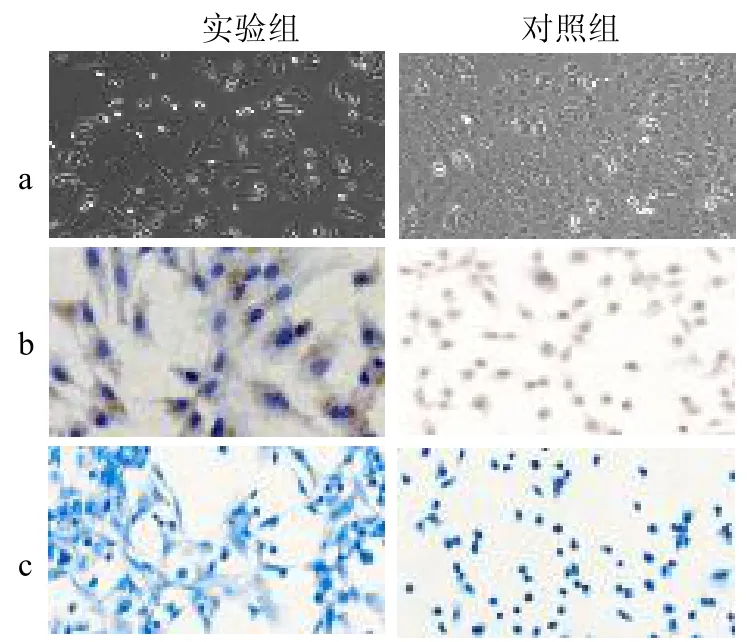
图3 共培养后hAECs 分化鉴定
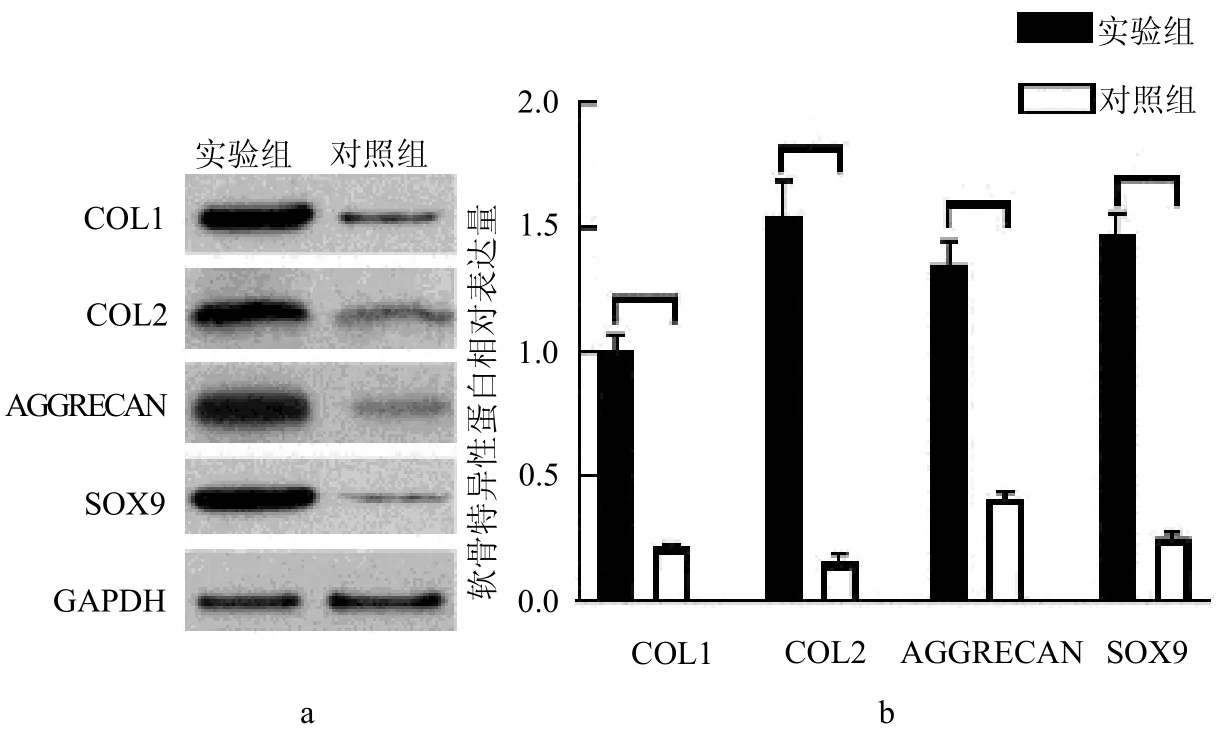
图4 Western-bolt 检测共培养后hAECs 软骨特异性蛋白COL1、COL2、AGGRECAN 和SOX9 的表达情况
2.4 共培养后hAECs 中软骨细胞特异性mRNA 相对表达量 实验组中软骨细胞COL1 mRNA、COL2 mRNA、AGGRECAN mRNA 和SOX9 mRNA 表达量均明显高于对照组(均P <0.05),见图5。
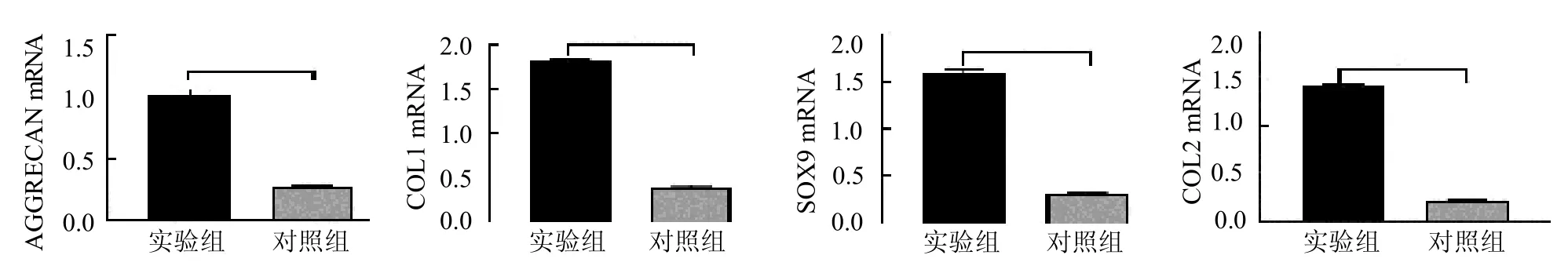
图5 RT-qPCR 检测共培养后hAECs 中COL2 mRNA、COL1 mRNA、AGGRECAN mRNA 和SOX9 mRNA 的表达情况
3 讨论
关节软骨组织本身可以在一定程度上再生,包括软骨细胞、软骨基质和弹性纤维,但再生过程缓慢[9]。有研究证明hAECs 可在特定环境下向结膜上皮细胞、肝细胞样细胞、多巴胺能神经元、角膜上皮细胞和腺泡细胞等分化[10];另一方面,hAECs 来源广泛,分离培养方法相对简单,体外培养性状稳定,适合进行体外实验及临床实验研究。
本实验应用酶裂解法分离出hAECs,分离方法简单易行,体外培养的hAECs具有较强的增生能力,多次体外培养传代后增生能力和分化潜能也不会发生明显的改变。本实验提取的hAECs 呈现典型铺路石样的上皮细胞形态,免疫荧光染色显示CK19 强表达,Vimentin 弱表达。流式细胞术检测hAECs 表面标志物的表达,结果显示CD73、CD90、CD105、CD29 和SSEA-4 呈阳性,CD34、CD45 和HLA-DR呈阴性,与以前的研究结果一致[11]。
本研究初步探讨了ACs 通过transwell 小室相隔与hAECs 共同培养,诱导hAECs 分化为ACs 的可能性。本研究选择第3 代hAECs 和ACs 进行下一步共培养,因为传至第3 代的上皮细胞具有更快的增殖速率和更好的生存力,适合于诱导分化实验。结果表明共培养21 d 时hAECs 呈现ACs 典型的三角形或多角形的形态,免疫组化和甲苯胺蓝染色提示实验组COL2 和AGGRECAN 表达相对于对照组明显增高,Western-bolt 和RT-qPCR 分析显示实验组COL1、COL2、AGGRECAN和SOX9 相对于对照组明显增高。本研究用于hAECs 和ACs 共培养的培养基是适合ACs 生长的特殊培养基,但对照组没有发现明显的变化,这表明hAECs 的软骨转化不是培养基引起的,很可能在共培养过程中分泌了一些诱导hAECs分化的物质,它们提供的微环境可以促进hAECs的分化。本研究对进一步优化体外诱导hAECs 向ACs 具有重要意义,并为相关实验提供了研究模型。
本研究为软骨组织工程研究提供了新的细胞来源;然而,仍需要进一步深入研究,如定向调控影响hAECs 向软骨细胞诱导分化的各种因素,探究hAECs 修复软骨组织的机制的基础上结合支架材料、细胞因子等,保持促进与抑制定向分化维持动态平衡以及细胞移植的安全性、可行性和组织工程潜在的免疫原性等问题。因此,需要进一步深入研究,建立一套标准的干细胞治疗体系,以期能更好的应用于临床。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王康:实验设计、实验操作、统计分析、论文撰写;智晓东:实验指导、数据整理;张玉强、张文景:细胞培养、实验检测;王伟:研究指导、论文修改、经费支持
