云南省马铃薯孢囊线虫种类鉴定*
2023-08-03邓春菊杨毅娟杨艳梅李永青胡先奇
邓春菊,李 艳,杨毅娟,杨艳梅,陈 敏,李永青,胡先奇
(1.云南农业大学 植物保护学院,省部共建云南生物资源保护与利用国家重点实验室,云南 昆明 650201;2.云南省昭通市植保植检站,云南 昭通 657500)
马铃薯(Solanum tuberosumL.)作为中国主要的粮食作物,在云南省的种植面积和产量均居中国前4 名[1]。马铃薯在整个生长过程中极易受到各种有害生物的影响,包括马铃薯孢囊线虫(potato cyst nematode,PCN)。PCN 是国际公认的危险性检疫性有害生物(病原物),最具侵入性与经济破坏性,如果不加以严格管控,一旦传入发生为害能使产量损失高达80%[2-3],其常见种类有马铃薯金线虫(Globodera rostochiensis)和马铃薯白线虫(G.pallida)。2020 年,马铃薯金线虫被中国列为植物检疫性生物[4]。马铃薯受到PCN 为害后,地上部无明显的识别症状[5],但根系被损伤,使植株根系对水分和营养物质的吸收能力降低,后续地上部表现为生长势弱,出现矮化和黄化等症状,与缺水、缺肥和营养不良等表现的症状相似[6]。马铃薯孢囊线虫起源于南美洲安第斯山脉,与马铃薯协同进化[7],在19 世纪“爱尔兰饥荒”时期随着抗晚疫病育种材料的引进传入欧洲[8],之后被扩散至其他地区,现已广泛分布于欧洲、亚洲、非洲、大洋洲和美洲大陆以及与中国毗邻的国家(如俄罗斯、日本和塔吉克斯坦等)[5]。由于马铃薯金线虫和白线虫在形态学上没有太大差异,鉴定时不易区分,为了准确鉴定这2 个不同的种,通常采用形态学方法鉴别和分子生物学方法辅助鉴定,如免疫酶联法(enzyme linked immunosorbent assay,ELASA)[9]、限制性片段长度多态性扩增(restriction fragment length polymorphism,RFLP)[10]和特征序列扩增(sequence characterized amplified regions,SCAR)技术[11]等。
2021 年,本课题组在马铃薯田间有害生物调查时发现部分种植地的马铃薯植株表现生长势弱,矮化、黄化和萎蔫症状,开花期马铃薯根系着生球形孢囊,为确定马铃薯上孢囊线虫的种类,随即采集罹病马铃薯根际土壤和根系带回实验室进行分离和鉴定,以期为制定马铃薯孢囊线虫病的防治措施提供依据。
1 材料与方法
1.1 供试材料
2021 年在云南省昭通市昭阳区马铃薯种植地采集马铃薯根际土壤样品33 份。采取土样时,去除表土层,采集 10~15 cm 根际土壤样品带回实验室,土样在常温下晾干后用浮选法分离孢囊。在其中1 份土样中分离获得孢囊,命名为GR-1,即为供试线虫。
LB (Luria-Bertani)液体培养基:酵母提取物5 g、胰蛋白胨10 g、NaCl 10 g,加去离子水800 mL,用去离子水定容至1 L,备用。
LB-氨苄青霉素固体培养基:将 LB 液体培养基加入适量琼脂,121 ℃高压灭菌 25 min,待温度降至50 ℃以下,加入100 mg/mL 氨苄青霉素1 000 μL,倒入培养皿中凝固后备用。
试剂:琼脂糖、蛋白酶K、10×PCR Buffer(Mg2+,Plus)、2×TaqPCR Master Mix、DL2000 plus DNA Marker、DL2000 DNA Marker、DNA 凝胶回收试剂盒、GoldenviewTM核酸染料和氨苄青霉素购自北京全式金生物技术有限公司;pMDTM18-T 载体和大肠杆菌(Escherichia coli) DH5α 感受态细胞购自宝日医生物技术(北京)有限公司。引物均由北京擎科生物科技有限公司(昆明)合成。
仪器:XTL-2 400 解剖镜 (上海精密仪器仪表有限公司),Axio Vert.A1 倒置显微镜 (德国Carl Zeiss 公 司),DYCZ-24D 电泳仪和WD-9402A PCR 仪(北京六一仪器厂),LG2020 型凝胶成像系统 (杭州朗基科学仪器有限公司),ZEISS sigma 300 扫描电镜 (德 国Carl Zeiss 公 司),Quorum pp3010t 冷冻传输系统 (英国Quorum 技术有限公司)。
1.2 形态鉴定
1.2.1 孢囊形态
将饱满的线虫孢囊置于盛有蒸馏水的培养皿内浸泡 24 h;在解剖镜下,用毛笔尖挑取浸泡过的孢囊置于载玻片上,将泥土刷净,用光学显微镜进行拍照测量;用解剖刀切下孢囊末端,用发丝针仔细清除附着在孢囊内侧的内含物,将阴门锥的边缘修整齐,挑到甘油中透明;将透明后的阴门锥移至载玻片上,制作永久玻片,用光学显微镜进行观察和拍照。形态测量方法参考SUBBOTIN 等[12]的方法。
1.2.2 2 龄幼虫形态
将分离出的孢囊用解剖刀剖开,在体视显微镜下挑取孢囊中的2 龄幼虫;将2 龄幼虫吸至载玻片上的水滴中,热杀死后用4%的福尔马林(V40%甲醛∶V蒸馏水=1∶9)固定线虫,观察、拍照并测量。形态测量方法参考SUBBOTIN 等[12]的方法。
1.2.3 孢囊和2 龄幼虫的超微结构
将挑出的孢囊和2 龄幼虫放入1 mL 离心管,加入ddH2O 500 mL 冲洗4 次;将样品用冷冻胶水固定于样品托上,插入温度低于130 K (-143.15 ℃)的过冷液氮雪泥中快速冷冻固定;在真空条件下,将样品转移到扫描电镜样品舱端口制样舱的冷台上,进行超微结构的观察[13]。
1.3 分子生物学鉴定
1.3.1 线虫DNA 提取
单个孢囊DNA 的提取参考SUBBOTIN 等[14]的方法。将单个孢囊放入含有ddH2O 10 μL 的0.2 mL 离心管中,加入10×PCR 缓冲液7 μL 和600 ng/mL 蛋白酶K 3 μL,用液氮速冻研磨2次;将离心管置于PCR 仪器中先65 ℃恒温1 h,再95 ℃恒温10 min。
1.3.2 28S rDNA-D2/D3 区扩增
引物为D2A (5′-ACAAGTACCGTGAGGGAAAGTTG-3′)和D3B (5′-TCGGAAGGAACCAGCTACTA-3′)[15]。反应体系25.0 μL,包括ddH2O 8.5 μL,2×TaqPCR Master Mix 12.5 μL,上、下游引物各1.0 μL,线虫DNA 2.0 μL。反应条件:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,40 个循环,72 ℃保温10 min。扩增反应结束后,取反应产物5 μL,用添加核酸染料制备的1.5%琼脂糖凝胶进行电泳检测,在凝胶成像系统中观察并拍照。
1.3.3 细胞色素氧化酶c 亚基Ⅰ(cox1)区扩增
引物为JB3 (5′-TTTTTTGGGCATCCTGAGGTTTAT-3′)和JB5 (5′-AGCACCTAAACTTAAAACATAATGAAAATG-3′)[16]。反应体系同1.3.2 节。反应条件:94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,40 个循环,72 ℃保温10 min。扩增反应结束后,取反应产物5 μL,用添加核酸染料制备的1.5%琼脂糖凝胶进行电泳检测,在凝胶成像系统中观察并拍照。
1.3.4 种特异性检测
参考EPPO PM 7/40 (5)[17]特异引物:ITS5 (5′-GGAAGTAAAAGTCGTAACAAGG-3′)和PITSr3(5′-AGCGCAGACATGCCGCAA-3′)或PITSp4 (5′-ACAACAGCAATCGTCGAG-3′)进行PCR 扩增。反应体系同1.3.2 节。反应条件:94 ℃预变性4 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸2 min,40 个循环,72 ℃保温10 min。扩增反应结束后,取反应产物5 μL,用添加核酸染料制备的1.5%琼脂糖凝胶进行电泳检测,在凝胶成像系统中观察并拍照。
1.3.5 D2/D3 区和cox1 区PCR 产物回收、连接、转化及测序
用DNA 凝胶回收试剂盒回收线虫28S 序列和cox1 序列的PCR 扩增产物,将回收产物与pMDTM18-T 载体连接,连接产物转化至大肠杆菌DH5α 感受态细胞中,涂布于LB-氨苄青霉素固体培养基上,挑取单克隆进行 PCR 鉴定,获得阳性克隆后委托生工生物工程(上海)股份有限公司测序。
1.3.6 D2/D3 区和cox1 区系统发育树构建
将测序得到的序列在数据库中进行BLAST比对,下载相似度较高的序列。在Phylosuite 1.22软件上进行对比优化,再利用Phylosuite 1.22 中的ModelFinder 进行数据集连接,划分最佳方案和确定DNA 进化最佳模型(28S r DNA D2-D3 和mt DNA-cox1 区域的最佳拟合)。以鹿角唇线虫属的Cervidellus alutus(GenBank 登录号:AF331911.1)和根结线虫属的北方根结线虫(Meloidogyne hapla,GenBank 登录号:KU517171.1)分别作为28S序列和cox1 序列的外群,采用贝叶斯推理法(Bayesian inference,BI)建立系统发育树,采样频率为20 000 次。
2 结果与分析
2.1 田间症状观察
采样地块马铃薯植株长势较弱,呈现矮化和黄化等缺水症状,出现发病中心团;开花期将马铃薯根系拔出后,发现根系上粘有肉眼可见的乳白色、金黄色和棕色球形颗粒(图1)。

图1 马铃薯金线虫田间为害的地上部(a)和地下部(b)症状Fig.1 Field symptoms aboveground part (a) and underground part (b) of Globodera rostochiensis
2.2 形态鉴定
2.2.1 雌虫及孢囊的形态特征
分离出的孢囊符合马铃薯孢囊线虫的特征。雌虫为白色,近球形,颈部突出,角质层逐渐变成金黄色(图2a~b)。雌成虫死后逐渐转变为棕色,光滑圆润,形成近似球形的孢囊,颈部突出(图2c~d)。无终锥卵呈椭圆形,白色卵粒包裹在孢囊内(图2e),每个孢囊约有200~1 000 个卵粒;阴门锥为单环膜孔型,膜孔呈圆形,肛门上方有1 个明显的“ V ”形标记(图2f);肛门开口比阴门小,位于距离最近的外阴边缘之间。角质层表面呈锯齿状突起,有明显的褶皱。

图2 马铃薯金线虫GR-1 群体雌虫及孢囊形状Fig.2 Females and cysts of G.rostochiensis of GR-1 population
对GR-1 群体的30 个孢囊和阴门锥样本进行测量,结果(表1)显示:孢囊膜孔直径为11.71~15.35 μm,阴门到肛门的距离为50.481~81.77 μm,Granek’s 比值 (肛门到最近的阴门桥距离/会阴区直径)为4.31~5.33,体宽为592.74~748.36 μm,体长(含颈)为659.85~763.15 μm。

表1 GR-1 群体与国内外报道的马铃薯金线虫孢囊和阴门锥形态数据Tab.1 The cysts morphological data of GR-1 population and other domestic and foreign studies reported
2.2.2 2 龄幼虫的形态特征
2 龄幼虫呈蠕虫状(图3a~b),热杀死后身体僵直;角质层有环纹,侧区有4 条明显的侧线,虫体两端的侧线有3 条。头部圆形,与身体稍微分离,头部骨架化较强,口针粗壮,基部较杆部粗,口针基部球侧部较钝,呈球形(图3c~d);尾部在肛门后面逐渐变细,成为1 个精细的圆点,最末端有1 个透明区域(图3e~f)。

图3 马铃薯金线虫GR-1 群体的2 龄幼虫Fig.3 The second stage juveniles of G.rostochiensis of GR-1
对GR-1 群体的40 个2 龄幼虫样本进行测量,结果(表2)显示:体长437.30~493.12 μm,尾长46.31~56.79 μm,透明尾长22.23~26.62 μm,口针长21.00~22.19 μm。

表2 GR-1 群体与国内外报道的马铃薯金线虫2 龄幼虫形态数据Tab.2 The second stage juveniles morphological data of GR-1 population and other domestic and foreign studies reported
2.3 分子鉴定
2.3.1 PCR 产物电泳检测结果
GR-1 群体用马铃薯金线虫特异引物ITS5 和PITSr3 扩增出的片段约为430 bp,而用白线虫特异引物ITS5 和PITSp4 扩增后无条带(图4);用线虫通用引物D2A 和D3B、JB3 和JB5 扩增后,片段大小约为780 和450 bp (图5)。

图4 GR-1 群体特征区域马铃薯白线虫与马铃薯金线虫特异引物PCR 扩增结果Fig.4 PCR results of specific primers of G.pallida and G.rostochiensis of specific region of GR-1

图5 GR-1 群体28S rDNA-D2/D3 区和mtDNA-cox1 区PCR 扩增结果Fig.5 PCR results of the 28S rDNA D2/D3 and mtDNA-cox1 regions of GR-1
2.3.2 PCR 产物测序及序列分析
样本GR-1 28S DNA-D2/D3 区序列的PCR 产物为784 bp,BLAST 比对结果显示:样本的D2/D3区序列与马铃薯金线虫(登录号为MZ057600.1、MZ570260.1、MK534182.1、KJ409625.1、KJ4096-31.1 和MZ057596.1)相似,相似度为99.11%~100.00%。样本GR-1 mtDNA-cox1 序列的产物为447 bp,BLAST 比对结果显示:样本cox1 区序列与马铃薯金线虫(登录号为MF773722.1、MH399-817.1、MH399817.1、MH399815.1、MT240262.1和MN095979.1)相似,相似度为99.28%~99.33%。
2.3.3 系统发育分析
系统发育树结果显示:以28S rDNA-D2/D3区序列和mtDNA-cox1 区序列构建的发育树结果基本一致。GR-1 群体样本28S rDNA-D2/D3 序列以100%的支持率与GenBank 中的马铃薯金线虫(登录号为KJ409625.1、KJ409631.1、KU297661.1和MZ570260.1)聚为1 个分支(图6)。GR-1 群体样本mtDNA-cox1 序列以100%的支持率与Gen-Bank 中的马铃薯金线虫(登录号为MT240262.1、MZ570875.1、MH399817.1、MN095981.1 和MF773-722.1)聚为1 个分支(图7)。
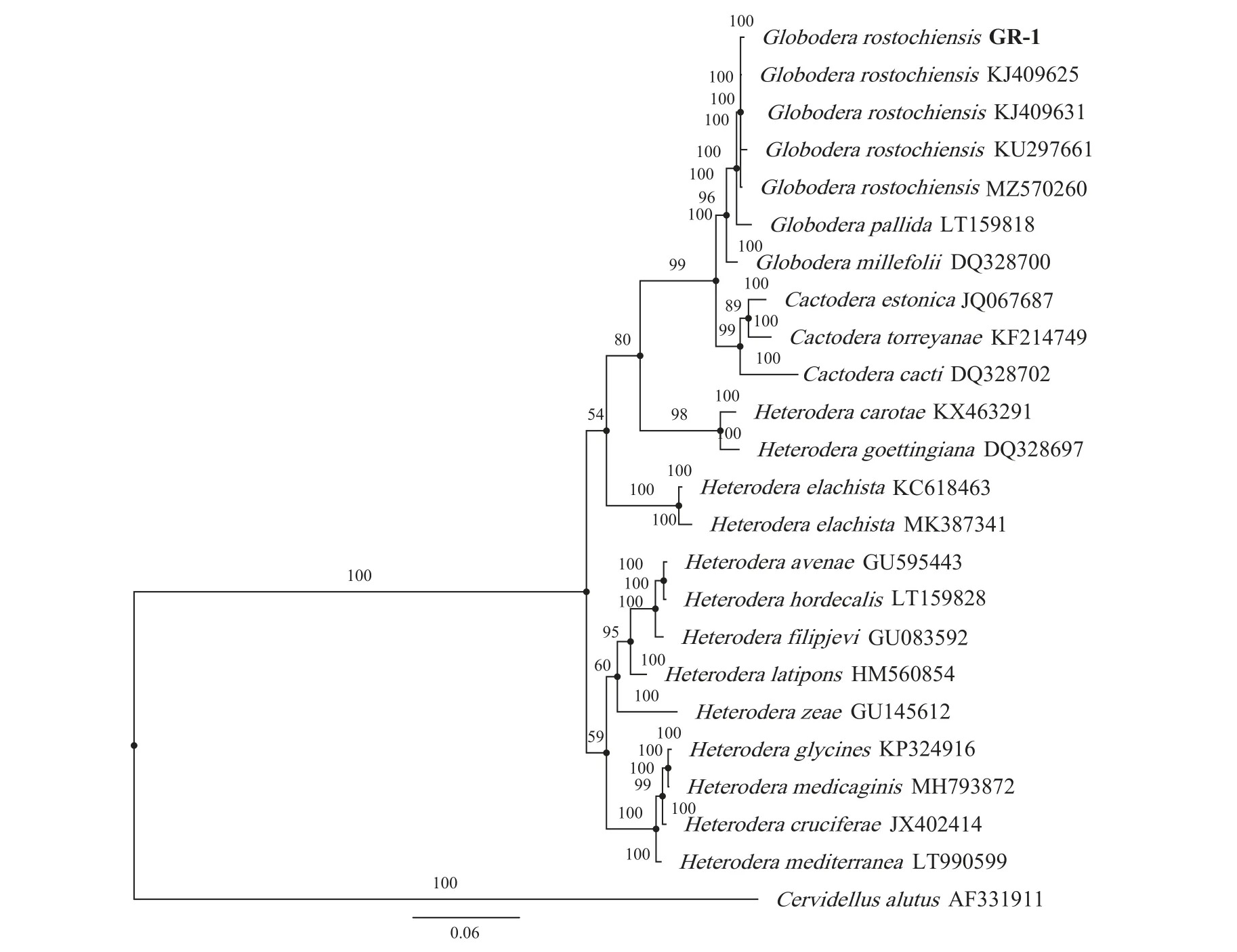
图6 GR-1 群体28S rDNA-D2/D3 区域系统发育树Fig.6 Phylogenetic tree of 28S rDNA-D2/D3 fragment GR-1 population

图7 GR-1 群体mtDNA-cox1 片段系统发育树Fig.7 Phylogenetic tree of mtDNA-cox1 fragment of GR-1 population
3 讨论
根据孢囊线虫的孢囊形状、Granek’s 比值、2 龄幼虫体长和口针长等,对在云南省马铃薯产区部分种植地发现的马铃薯孢囊线虫种群GR-1进行形态学鉴定。将GR-1 群体的形态数据与国内报道[18]的马铃薯金线虫群体形态数据进行比较,发现本研究测量的孢囊和2 龄幼虫数据与之基本一致;将GR-1 群体的形态数据与国外孢囊形态数据进行比较发现:与塞尔比亚种群[19]相比,GR-1 群体的膜孔直径[(13.39±1.20) μm)]小于塞尔比亚种群[(22.83±4.62) μm)],但Granek’s比值(4.87±0.65)大于塞尔比亚种群(1.94±0.49);与葡萄牙种群[20]相比,群体GR-1 的体宽[(659.17±39.38) μm]和体长(含颈长)[(706.16±36.21) μm]略大于葡萄牙种群[分别为(474.09±93.57) μm 和584.984 μm],但膜孔直径小于葡萄牙种群[(25.13±6.70) μm];与伊朗种群[21]相比,群体GR-1 的Granek’s 比值略大于伊朗种群(3.27±0.61),但膜孔直径略小于伊朗种群[(15.24±1.92) μm];其余数据仅有微小差异。群体GR-1 的2 龄幼虫形态数据与国外报道[18-21]的形态数据大致相同。
本研究利用线虫通用引物扩增了线虫28S rDNA/D2/D3 区和mtDNA-cox1 区片段,BLAST比对分析发现2 个区域序列与GenBank 中已报道的马铃薯金线虫序列相似度分别为99.11%~100.00%和99.28%~99.33%,并基于2 个区域序列建立系统发育树,结果表明:2 个序列均与GenBank 中的马铃薯金线虫序列聚为1 支。根据EPPO PM 7/40 (5)[17]发布的标准,马铃薯金线虫特异引物ITS5/PITSr3 PCR 扩增条带为434 bp,马铃薯白线虫特异引物ITS5/PITSp4 PCR 扩增条带为256 bp。本研究的特异片段扩增结果与前人报道的马铃薯金线虫片段大小一致,而针对马铃薯白线虫设计的引物未扩增出片段。2022 年,国内首次报道了在四川省和云南省出现马铃薯金线虫[18],暂无马铃薯白线虫及混合种群的报道。
云南省马铃薯年均种植面积50 万hm2,鲜薯产量800 万t,种植面积和产量居全国第4 位,是国内马铃薯种植大省[1]。马铃薯金线虫为害可使马铃薯严重减产,但其在土壤和植株为害的症状不明显,且其孢囊结构具有强抗逆性,给病害的发现和防治带来困难。马铃薯金线虫是中国重要的入境检疫性有害生物之一[5],该线虫已在贵州、云南和四川等地发生[22],应采取严格的检疫措施严防其扩散和曼延,在已经发生的种植地应结合种植习惯、生态环境和品种等多因素开展发生为害规律及防治技术研究,为有效控制马铃薯金线虫病提供理论依据和技术支撑。
4 结论
本研究样本符合马铃薯金线虫的特征,确定在云南省马铃薯产区部分种植地发现的马铃薯孢囊线虫为马铃薯金线虫。该线虫为世界性植物检疫线虫,应采取严格的检疫措施避免该线虫进一步扩散蔓延。
