安罗替尼联合常规化疗对非小细胞肺癌患者血清VEGF及无进展生存期的影响
2023-08-03王伟
王 伟
(滨州市第二人民医院呼吸与危重症医学科,山东 滨州 256803)
肺癌是恶性肿瘤,可分为小细胞癌、非小细胞肺 癌(NSCLC),其 中NSCLC 的 占 比 可 达80%[1]。NSCLC 早期无特异性症状,患者大多是在出现咳血、胸痛等严重症状时就诊,但此时病情已经进展至中晚期,无法实施手术治疗。化疗是NSCLC 的主要治疗方法,能有效杀灭肿瘤细胞,预防肿瘤持续侵袭或转移,从而延长患者的生存时间[2]。但NSCLC 恶性程度高,患者免疫力及抵抗力差,并伴有其他器质性病变,常规化疗较难阻止肿瘤进展,难以获得理想效果。近年来,靶向治疗药物的应用以不良反应少、安全性高等优点逐渐成为肿瘤治疗的研究热点[3]。安罗替尼为小分子靶向药物,主要活性成分是盐酸安罗替尼,能通过抑制肿瘤细胞中的生长因子来抑制肿瘤细胞的转移或扩散[4]。本研究选取2021 年1 月至2022 年1月我院收治的40 例NSCLC 患者,通过分组对照来探究安罗替尼联合常规化疗对治疗效果的影响。现报道如下。
1 资料与方法
1.1 一般资料
选取2021 年1 月至2022 年1 月我院收治的40例NSCLC 患者,按随机数字表法分为对照组和观察组,各20 例。本研究经医学伦理委员会审核通过。观察组:男12 例,女8 例;年龄51 ~77 岁,平均年龄(63.56±4.50)岁;病程1 ~6 年,平均病程(3.22±1.43)年;分期:7 例Ⅲb 期,13 例Ⅳ期;癌症类型:10 例腺癌,7 例鳞癌,3 例其他类型。对照 组:男11 例,女9 例;年 龄50 ~78 岁,平 均年龄(62.01±4.83)岁;病程1 ~5 年,平均病程(3.15±1.30)年;分期:8 例Ⅲb 期,12 例Ⅳ期;癌症类型:11 例腺癌,7 例鳞癌,2 例其他类型。两组的一般资料相比,差异无统计学意义(P>0.05)。
1.2 入选标准
纳入标准:符合《中华医学会肺癌临床诊疗指南(2018 版)》[5]中的相关诊断标准;经病理活检确诊,有可测量的靶病灶;临床资料完整;患者及家属均签订知情同意书。排除标准:存在其他恶性肿瘤;存在凝血功能障碍;存在免疫系统缺陷;对研究药物过敏。
1.3 方法
对照组进行常规化疗(长春瑞滨+ 吉西他滨联合化疗):先静脉注射盐酸吉西他滨(北京协和药厂有限公司生产,国药准字H20103523,规格:2 g)1000 mg/m2,注射时间为30 min ;再注射长春瑞滨(江苏豪森药业集团有限公司生产,国药准字H20041150,规格:20 mg)25 mg/m2,注射时间为15 ~20 min。治疗3 周为1 个疗程,持续治疗3 个疗程。在上述基础上,观察组每日早餐前口服安罗替尼(正大天晴药业集团股份有限公司生产,国药准字H20180004,规格:12 mg)12 mg,1 次/d,1 个疗程为3 周,前两周用药,第三周暂停治疗;1 个疗程后调整用药剂量为10 mg/d,持续治疗3 个疗程。
1.4 观察指标
(1)临床疗效:根据实体瘤疗效标准评价临床疗效。完全缓解:肿瘤病灶完全消失,并持续≥4周;部分缓解:病灶缩小≥30%,持续≥4 周;稳定:病灶缩小<30% 或增大<20%;进展:病灶增大≥20% 或出现新病灶。总有效率= 完全缓解率+ 部分缓解率+ 稳定率。(2)血清血管内皮生长因子(VEGF):治疗前、治疗3 个疗程后采集3 mL空腹血,离心获得血清后,以酶联免疫吸附法测定VEGF。(3)肿瘤标志物:治疗前、治疗3 个疗程后,使用放射免疫法测定血清癌胚抗原(CEA)、糖类抗原125(CA125)、细胞角质蛋白19 片段抗原21-1(CYFRA21-1)。(4)血清学指标:治疗前后以酶联免疫吸附法测定神经元特异性烯醇化酶(NSE)、转化生长因子-β1(TGF-β1)与基质金属蛋白酶-2(MMP-2)的水平。(5)不良反应:记录化疗期间腹泻、红细胞减少、恶心呕吐等不良反应的发生情况。(6)无进展生存期:记录两组治疗3 个疗程后的无进展生存期。
1.5 统计学方法
采用SPSS 20.0 分析数据,计量资料用均数±标准差(±s)表示,采用t检验,计数资料用百分比(%)表示,采用χ² 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效
观察组的总有效率高于对照组,差异有统计学意义(P<0.05)。见表1。
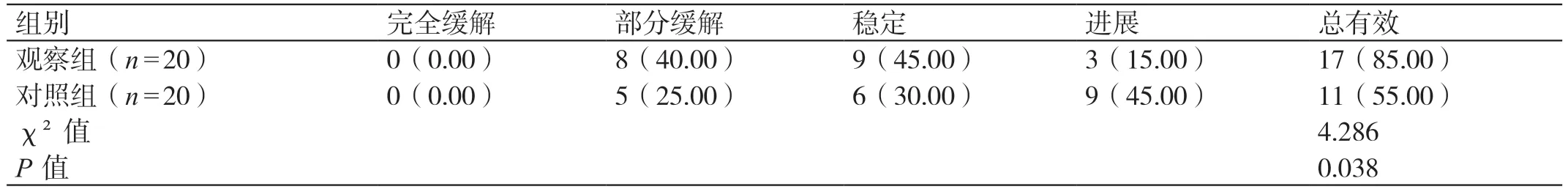
表1 两组临床疗效的对比[例(%)]
2.2 血清VEGF、肿瘤标志物
治疗前两组的血清VEGF、CEA、CA125及CYFRA21-1 水平相比,差异无统计学意义(P>0.05);治 疗 后 两 组 的 血 清VEGF、CEA、CA125 及CYFRA21-1 水平均低于治疗前,且观察组均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组血清VEGF、肿瘤标志物的对比(± s)
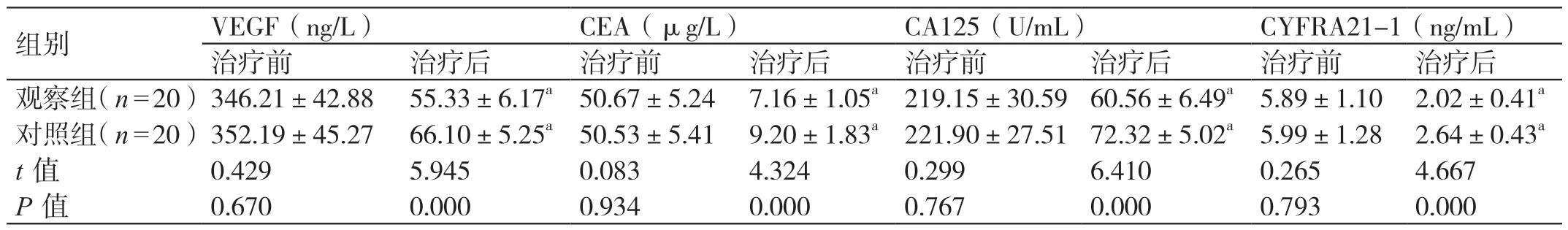
表2 两组血清VEGF、肿瘤标志物的对比(± s)
注:a 与本组治疗前相比,P <0.05。
组别 VEGF(ng/L)CEA(μg/L)CA125(U/mL)CYFRA21-1(ng/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=20)346.21±42.88 55.33±6.17a 50.67±5.24 7.16±1.05a 219.15±30.59 60.56±6.49a 5.89±1.10 2.02±0.41a对照组(n=20)352.19±45.27 66.10±5.25a 50.53±5.41 9.20±1.83a 221.90±27.51 72.32±5.02a 5.99±1.28 2.64±0.43a t 值 0.429 5.945 0.083 4.324 0.299 6.410 0.265 4.667 P 值 0.670 0.000 0.934 0.000 0.767 0.000 0.793 0.000
2.3 血清学指标
治疗前两组的血清NSE、TGF-β1、MMP-2 水平相比,差异无统计学意义(P>0.05);治疗后两组的血清NSE、TGF-β1、MMP-2 水平均低于治疗前,且观察组均低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组血清学指标的对比(± s)
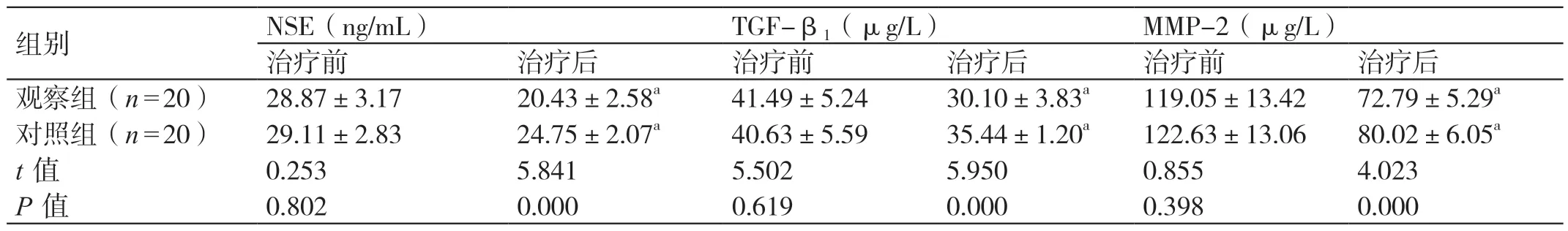
表3 两组血清学指标的对比(± s)
注:a 与本组治疗前相比,P <0.05。
组别 NSE(ng/mL)TGF-β1(μg/L)MMP-2(μg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=20)28.87±3.17 20.43±2.58a 41.49±5.24 30.10±3.83a 119.05±13.42 72.79±5.29a对照组(n=20)29.11±2.83 24.75±2.07a 40.63±5.59 35.44±1.20a 122.63±13.06 80.02±6.05a t 值 0.253 5.841 5.502 5.950 0.855 4.023 P 值 0.802 0.000 0.619 0.000 0.398 0.000
2.4 不良反应
两组的各项不良反应发生率相比,差异无统计学意义(P>0.05)。见表4。
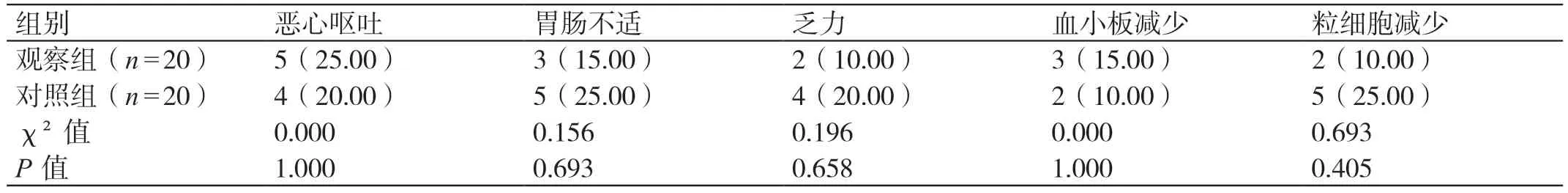
表4 两组不良反应的对比[例(%)]
2.5 无进展生存期
观察组的无进展生存期为(126.84±26.33)d,对照组的无进展生存期为(84.22±18.79)d ;两组的无进展生存期相比,差异有统计学意义(t=5.892,P=0.000)。
3 讨论
NSCLC 起源于支气管黏膜、肺泡上皮等组织,发病原因比较复杂,可能与长期吸烟、环境污染、遗传等多种因素的综合作用有关,近年来其发病率呈升高趋势[6]。NSCLC 的侵袭性强、根治难度较大,且多数NSCLC 患者就诊时处于中晚期,病情复杂,治疗难度更大。手术虽为NSCLC 的首选治疗方案,但中晚期NSCLC 患者的机体耐受能力差,难以承受手术带来的创伤,整体预后不理想,故多选择化疗来杀灭肿瘤细胞,改善预后。有研究[7]指出,中晚期NSCLC 的肿瘤转移及增殖途径较多,进行常规化疗难以获得理想的肿瘤进展抑制效果,因此需调整、优化化疗方案。肿瘤的增殖及转移与新生血管关系密切,VEGF 会加速新生血管形成,诱导肿瘤形成及转移;CEA、CA125、CYFRA21-1 是常用肿瘤标志物,癌症发生后,体内的肿瘤标志物水平呈高表达。NSE 为烯醇化酶的同工酶,大量存在于肿瘤组织中;MMP-2 为基质金属蛋白酶,当机体细胞发生恶性病变时,其会通过降解机体细胞外基质中的胶原蛋白来加快肿瘤细胞的转移;TGF-β1是一种由免疫细胞产生的多肽,对NSCLC 肿瘤上皮间质转化有调节作用,可促进肿瘤的转移与浸润。本研究显示,观察组的总有效率高于对照组,血清VEGF、CEA、CA125、CYFRA21-1、NSE、TGF-β1、MMP-2 水 平 均 低 于对照组,无进展生存期长于对照组,且两组的不良反应发生率相比无统计学差异。表明安罗替尼联合常规化疗在NSCLC 治疗中的应用价值较高。庞宏涛等[8]的研究显示,安罗替尼联合化疗治疗晚期NSCLC 的临床疗效显著,能改善患者的血清VEGF 水平,抑制肿瘤进展,延长患者的无进展生存期,且安全性较高,这与本研究的结果基本一致。安罗替尼是小分子、多靶点抗肿瘤药,给药后能对肿瘤细胞增殖相关的激酶进行强效抑制,降低VEGF 水平,阻止内皮细胞迁移,抑制管腔形成,从而达到抑制肿瘤的目的[9-10]。安罗替尼还能通过干扰肿瘤细胞增殖有关通路的激活,影响肿瘤迁移、侵袭过程,并能诱发肿瘤细胞凋亡,进而可增强相关疗效,抑制病情进展,延长患者的无进展生存期[11-12]。此外,安罗替尼可针对性地抑制肿瘤相关基因的高表达,对正常组织细胞的影响较小,毒副作用小,故安全性较高。
综上所述,安罗替尼联合常规化疗能够提高NSCLC 患者的治疗效果,改善其血清学指标,降低其肿瘤标志物水平,延长其无进展生存期,且安全性较高。但本次研究存在一定的不足之处,如样本来源单一、观察时间短、观察指标有限等,故安罗替尼联合常规化疗在NSCLC 治疗中的具体应用效果还需通过进一步的研究加以验证。
