WT1在不同类型骨髓增殖性疾病病人中的表达及临床意义
2023-08-02胡忠利杨艳丽胡忠亭
胡忠利,杨艳丽,胡忠亭
肾母细胞瘤肿瘤基因(Wilms′ tumor gene,WT1)最早被认为是肿瘤抑制基因[1],其表达水平与肿瘤密切相关。它位于11号染色体短臂的第3个带[2]中,其编码的mRNA通过两个可变剪接形成4个异构体[3],发生剪接的对应位置分别位于外显子9和10之间以及外显子5上。骨髓增殖性疾病(myeloproliferative neoplasm,MPN)是一种伴有异常克隆性增生的血液病[4],发生于造血干细胞或祖细胞,以一种或多种外周血细胞增多为主要临床特征,常伴有肝脾肿大、血栓形成、出血倾向及髓外造血[5]。MPN主要包括慢性粒细胞白血病(chronic myelogenous leukemia, CML)、真性红细胞增多症(polycythemia vera,PV)、原发性血小板增多症(essential thrombocythemia,ET)、骨髓纤维化(myelo fibrosis,MF)等。其中CML发生在早期祖细胞上,主要涉及髓系,外周血不成熟粒细胞显著增多,95%病人骨髓中可以发现Ph染色体,即特征性t(9;22)(p34;q11)染色体移位,和/或bcr/abl融合基因阳性[6]。本研究采用RQ-PCR检测56例MPN病人骨髓细胞WT1基因的表达,研究WT1基因在亚型不同的MPN中的相对表达量的差异及其差异的特征性总结与临床的相关性分析。
1 资料与方法
1.1 一般资料 所有MPN病人均选自蚌埠医学院第一附属医院血液科,住院时间为2020-2021年;其中男36例,女20例;中位年龄45岁。其中CML 25例,其余MPN 31例中PV 15例,ET 12例,MF 4例。56例MPN病人白细胞数值为(1.5~200.27)× 109/L ,血小板数值为(3~558)×109/L。对病人常见体征、血常规和骨髓行详细检查和诊断。病人符合目前国内白血病的分型标准[7]。MPN基因的定性检测及P210基因与WT1基因的定量检测,均采用 EDTA 抗凝备用。
1.2 检验方法
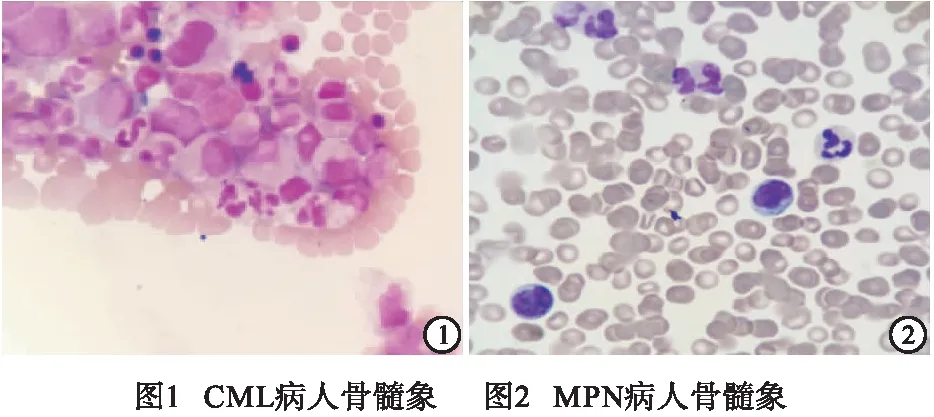
1.2.1 骨髓细胞学检查 于骼后上棘抽取骨髓液,制作骨髓涂片,加入瑞氏染色+缓冲液1∶2染色,借助显微镜对于细胞的数量及外形进行观察和记录。镜下数500个有核细胞,依据FAB形态学诊断标准进行分型。CML病人可见骨髓增生极度活跃,嗜酸细胞嗜碱细胞比例显著升高。MPN可见骨髓增生活跃,粒系增生活跃,血小板散在及中大簇多见,显示增多(见图1~2)。
1.2.2 基因检测WT1的检测:通过TRIzol提取物完成细胞的总RNA提取,在-80 ℃的温度下储存以用作备用。解冻上述 TRIzol溶解后得到的白细胞,解冻完成后,需要用三氯甲烷、异丙醇、DEPC-H2O+75%乙醇处理,并在DEPC-H2O中溶解至适当浓度。制备RNA样品并在MX3000型PCR仪器上扩增。同时做内参基因ABL绝对拷贝数定量检测,WT1表达量=WT1绝对拷贝数/ABL绝对拷贝数×104。
MPN基因检测:通过DNA提取试剂盒进行DNA提取以制备DNA样品,其在MX3000型PCR仪器上扩增。检测突变体非受体酪氨酸激酶基因的突变(JAK2V167F)、血小板生成素受体(MPL)突变、钙网蛋白(CARL)突变(L367fsX46、K385fsX47),同时室内对照野生型作为内参。
P210基因检测:同WT1基因步骤相同制备RNA样品,并在MX3000型PCR仪上扩增。同时做内参基因ABL绝对拷贝数定量检测,P210表达量=P210绝对拷贝数/ABL绝对拷贝数。
1.2.3 染色体核型检测 采用骨髓细胞短期培养法制片,热变性姬姆萨R显带,平均分析中期细胞数15~20个,染色体核型分析根据《人类细胞遗传学国际命名体制(ISCN1995》的规定进行。检查结果见图3、4。
1.2.4 根据CML病情进展分组 根据血液病诊疗标准,CML慢性期(CML-CR):骨髓与外周血原始细胞比例<10%;CML加速期(CML-AP ):外周血或骨髓中原始细胞10%~<20%,或外周血嗜碱细胞值≥20%;CML急变期(CML-BP):骨髓或外周血原始细胞≥20%。
1.3 统计学方法 采用χ2检验、方差分析及独立样本t检验和q检验。
2 结果
2.1 各类型MPN病人WT1的表达特征 各类型MPN病人中WT1基因的阳性率存在差异,MPN病人中共有PV 15例,ET 12例,MF 4例,CML 25例。由于各非CML的MPN组WT1的表达率较低,故合并为一组(非CML组)进行比较。结果显示,CML组WT1阳性率与非CML组比较差异有统计学意义(P<0.01),CML组的WT1阳性病例中WT1数值与非CML组WT1阳性病例比较差异亦有统计学意义(P<0.01)(见表1)。

表1 不同亚型MPN病人WT1的表达比较
2.2 不同基因类型的MPN病人WT1的表达差异 本研究中MPN病人共有6种基因型表达,其中JAK2V167F+基因型26例,L367fsX46+基因型3例,MPL+基因型1例,K385fsX47+基因型1例,P210+基因型24例,P230+基因型1例。由于非P210+MPN的基因型中WT1阳性表达率较低,故合并为一组(非P210+组)进行比较。结果显示,P210+组的WT1阳性率高于非P210+组(P<0.01),P210+组WT1阳性病例的WT1数值与非P210+组WT1阳性病例比较亦差异有统计学意义(P<0.01)(见表2)。

表2 不同基因类型的MPN病人中的WT1表达
2.3 CML病人WT1及P210的表达量与病程进展的关系WT1和P210基因在CML疾病进程的不同阶段表达差异均有统计学意义(P<0.01)(见表3),WT1的数值随着CML进入加速期而明显升高,部分缓解时WT1的数值则明显下降。

表3 WT1表达与CML病程发展之间的关系
3 讨论
MPN是由于细胞的恶性发展而诱发疾病[8],是一类克隆性异常增生的血液肿瘤[9]。美国SEER数据库中,PV、ET、MF的发病率分别为10.9/100 万、9.6/100万和 3.1/100 万,中位发病年龄分别为65、68和70岁[10],中位生存时间分别为15、18和4.4年[11]。JAK2、MPL 和 CALR作为 MPN 的驱动基因,通过激活 JAKSTAT 信号通路,导致骨髓细胞异常增殖[12]。
既往研究[13]显示,100例MPN病人中,大约有30例可发展为急性髓系白血病(AML),这些病人往往预后不良,有些病人甚至可能进展为难治性AML。MPN的确切发病机制已在世界范围内被探索,一些学者认为该疾病可能是由DNA甲基化引起的,导致肿瘤抑制基因沉默,并且认为JAK2V167F基因的突变和MPN的发生有一定的有关性[14]。另外,在25%~35%的ET和MF病人中检测到CARL基因的体细胞突变[15],而MPL突变也存在与少数ET和MF的病人中。这些突变的发现极大地方便了对MPN的诊断。上述3种基因的突变导致JAK/STAT信号的异常活化和分化细胞的自主成长,因此它们被认为是“DRIVER”基因突变。
JAK是一类非受体型酪氨酸激酶[16],作用于细胞因子的信号转导中。JAK2基因V16F突变是近年来MPN发病机制研究中的重要发现,其从根本上揭示了BCR-ABL阴性MPN的致病机制[17]。目前,JAK2V16F基因突变已成为MPN的诊断性标志,除难治性贫血伴环状铁粒幼细胞和ET中发现高比率JAK2AV16F突变,其他恶性血液病很少发现此突变[18]。JAK2结合促红细胞生成素、粒细胞集落刺激因子和促血小板生成素等细胞因子受体使JAK相关的激酶激活[19],导致下游JAK-STAT激酶信号转导通路异常活化,其他信号转导通路(RAS/MAPK、PI3K/AKT)也被异常激活,共同参与调节造血细胞的增殖和分化[20]。MPL是JAK2的一个同源受体,MPLW515突变导致MPL跨膜近膜结合部位的色氨酸被亮氨酸/赖氨酸替换。MPL突变可存在于少数的ET和MF病人中[21],MPL突变的细胞可呈现与JAK2突变类似的效应。CARL基因突变定位在染色体19p13.2,包含9个外显子,编码钙网织蛋白,且发现突变位点均发生在第九号外显子上[22]。 CML是MPN的一种常见类型,病人多慢性起病,病程进展缓慢,而CML的分期与外周血或骨髓原始细胞百分比有关[23],随着病程的进展原始细胞的比例已相应增加,这对判断疾病的进展及预后有一定价值。
随着血液病诊断技术的发展,血液病的诊断早已不再局限于骨髓细胞学,基因检测已成为新的参考。新诊断病人的诊断不仅限于白血病的分类,而是更多地关注预后和药物治疗相关的指标[24]。以WT1基因作为代表,该基因可以抑制造血细胞的增殖,阻碍基因的分化转录,同阶段调整细胞凋亡水平[25]。WT1基因与造血细胞的增殖、分化及凋亡有关,WT1基因可以促进造血干细胞增殖和阻碍其分化,其检测分析是评估血液系统恶性疾病重要的风险指标之一[26]。在对WT1基因相对表达量的分析中发现,随着疾病的进展WT1的表达量也增加,表现出明显的阶段性,因此我们推测,WT1阳性率与CML病人的原始细胞成正相关,且随着原始细胞比例的增加WT1的阳性表达率及相对表达量已增加,而在正常成熟血细胞中几乎不表达。说明WT1基因在调节造血干细胞的增殖、分化中发挥重要作用[27]。WT1基因有可能是JAK2信号途径的下游基因之一。WT1蛋白梭基末端为指蛋白结构域,具有较强的转录调控作用,可以增强或抑制特异靶基因的表达,其靶基因主要与细胞生长、代谢、分化及凋亡等有关。在血液系统肿瘤尤其是急性白血病中,WT1基因呈高表达,WT1基因表达水平的高低与白血病的预后呈负相关,可能主要发挥癌基因的作用[28]。国外研究[29]表明,JAK2V617F 纯合突变的细胞株HEL和UKE-1,WT1呈阳性表达;在HEL和UKE-1细胞株培养过程中加入JAK2抑制剂后,WT1表达水平明显下降[30];表明WT1表达水平的高低与 JAK2的活性相关。以往的报道[31]亦证实,WT1基因在MPN中表达较正常对照组阳性率升高(41.7)。本研究发现,CML组WT1阳性率与非CML组比较差异有统计学意义,且P210+组的WT1阳性率高于非P210+组,P210+组WT1阳性病例的WT1数值与非P210+组WT1阳性病例比较差异亦有统计学意义。
此外在本研究中发现在CML的不同疾病进展阶段WT1均有不同程度的表达,加速期及急变期的WT1表达水平明显高于部分缓解期。WT1表达量与病人的P210的表达量成正相关,且随着病程的进展而发生变化,表现出明显的阶段性,这表明WT1基因的表达随 CML 的临床进展而表达逐渐增加。进展期病人WT1的表达量相对较高,这对病人的诊治及预后评估有一定临床意义。
综上,WT1基因在CML中的表达有一定的特异性,随着病情的进展而变化,并与P210基因的表达水平相关。未来在临床中WT1基因可与P210基因一起作为CML病人诊断的有效指标,用于临床上CML的判断及了解预后。
