工艺流程和实验综合中的洗涤问题归纳总结
2023-08-02尉言勋
尉言勋


洗涤问题是工艺流程题和实验综合题中的高频考点,要解决好此类问题,我们需要思考以下四个问题,洗涤的目的是什么?如何选择洗涤剂?怎么洗涤?怎样证明是否洗涤干净?针对这四个问题,老师可以引导学生追根寻源和归纳总结。
一、知识归纳
1.洗涤的目的
洗涤的目的一般都是为了使产品纯度更高且不损耗产品。若产品为固体,洗涤沉淀的目的是除去固体表面的可溶性杂质,得到更纯净的产品;若产品为液体,洗涤的目的是通过洗涤过滤所得残渣,把将吸附在固体表面的产品尽可能洗出来,使其脱离固体表面,防止溶液中的产品损耗,进而提高产品产率。若滤渣表面有对环境有害的物质,如重金属离子CN-,则通过对残渣洗涤,可以除去有害物质,防止污染环境。
2.洗涤剂的选择
选择合适的洗涤剂是洗涤操作的关键,高中阶段常用的洗涤剂主要有:冰水、热水、饱和溶液、有机溶剂(無水乙醇)等。
(1)相似相溶的经验规则
相似相溶原理是指由于极性分子之间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。若溶质与溶剂极性相似,则溶质溶解度较大;若溶质与溶剂极性相差较大,则溶质溶解度较小。比如:强极性物质HCl(共价化合物)、KF(离子化合物)在强极性溶剂(水)中溶解度大,而在弱极性的有机溶剂(如苯、丙酮、四氯化碳)中溶解度较小;弱极性的物质卤素单质、大部分有机物在水中溶解度较小,而在有机溶剂中溶解度较大。
从微观结构角度,结合相似相溶原理有利于理解物质的物理、化学特性。比如:必修一中学习氨气的物理性质时,氨气极易溶于水(体积比1:700),原因是什么呢?我们可以从结构的角度解释,因为氨气和水均为极性分子,根据相似相溶原理,极性分子易溶于极性分子。低级(含碳个数少)醇、羧酸的极性大,在水中溶解度大,高级(碳原子数多)醇、羧酸的极性变弱,在水中溶解度变小。
(2)分子极性与分子结构
①根据化学键极性的向量和是否等于零。
a.只含非极性键的分子一定是非极性分子。
b.含有极性键的多原子分子,如果分子中各个键的极性的向量和等于零(空间对称),则为非极性分子,如CO 2、BF 3、CH 4等;否则为极性分子(空间不对称),如HCN、H 2O、NH 3、CH 3Cl等。
②判断AB n型分子极性的经验规律
a.若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
b.若中心原子A有孤电子对,则为极性分子。如NH 3、PH 3均有1对孤对电子,可推测NH 3、PH 3均为极性分子;若中心原子A无孤电子对,则为非极性分子,如CH 4、SiCl 4均无孤对电子,可推测CH 4、SiCl 4均为非极性分子。
【规律方法】 分子极性判断的方法
(3)洗涤剂的选择依据
根据溶质、溶剂的极性特点,选择恰当的洗涤剂。①若产品是强极性物质,则选择弱极性的溶剂清洗,如:实验室利用Fe(OH) 3、H 2C 2O 4和K 2C 2O 4制备三草酸合铁(Ⅲ)酸钾,K 3[Fe(C 2O 4) 3]·3H 2O属于极性物质,易溶于水,难溶于弱极性的有机溶剂,则用无水酒精洗涤晶体表面,可除去杂质水分,并能够减小溶解的损失。②若产品是弱极性物质,此时可以选择强极性的溶剂清洗,如:实验室以环己醇为原料制取己二酸,杂质主要为无机物,己二酸极性较弱,微溶于冷水,易溶于热水和乙醇,则可选择冷水洗涤晶体表面杂质,不能用热水、乙醇等洗涤。
(4)常用的洗涤剂
①蒸馏水:主要适用于产物不溶于水,通过洗涤除去沉淀吸附的可溶性杂质。
②冷水:除去沉淀的可溶性杂质,降低沉淀在水中的溶解度而减少沉淀损失。
③饱和溶液:a.减小沉淀的溶解损失,如AgCl的沉淀溶解平衡为AgCl(s)
Ag+(aq)+Cl-(aq),增大c(Cl-)可使平衡逆向移动,所以用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失;b.气体的除杂,如SO 2中混有HCl,可通入饱和的NaHSO 3溶液,除去混有的HCl气体,再通过浓硫酸除去水蒸气。
④有机溶剂(酒精、丙酮等):适用于易溶于水的固体,能溶解一些不溶于水的物质(如油脂、蜡、树脂、橡胶、染料等),既减少了固体溶解,又利用有机溶剂的挥发性,除去固体表面的水分,在溶解过程中,溶质与溶剂的性质均无改变,且产品易干燥。
3.洗涤方式
洗涤固液两相的操作是先过滤再洗涤,洗涤方式有常压洗涤和减压洗涤。
【答题模板】 注洗涤液(沿玻璃棒向漏斗中注入洗涤液) →浸没(使洗涤液完全浸没沉淀或晶体) →重复(待洗涤液流尽后,重复操作2~3次) 。
常压洗涤的方式:向过滤器(漏斗)中加入洗涤剂(如蒸馏水),浸没沉淀,静止待水自然留下后,再重复操作2~3次。抽滤洗涤的方式:在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失。另外,还要注意抽滤不适用于过滤胶体沉淀或颗粒太小的沉淀,因为胶体沉淀在快速过滤时易透过滤纸,沉淀颗粒太小容易在滤纸上形成一层密实沉淀,使溶液不易透过。
4.洗涤效果
如果可溶性杂质的水溶液有颜色,可以通过直接观察最后一次洗涤液是否有颜色进行判断,如果无色,说明已经洗涤干净,反之,则没有洗涤干净;对于含Na+、K+的可溶性杂质可以通过焰色反应来鉴别,从而判断是否洗涤干净;对于用物理方法无法判断的,可以通过化学方法来判断。一般叙述步骤如下图所示:
可先分析洗涤液中的“特征离子”,再找相应的特征试剂检验。题目中经常考查SO2- 4和Cl-的检验,如2021全国乙卷(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在SO2- 4来判断。检测的方法是取少量洗出液于试管中,加入盐酸酸化的BaCl 2溶液,若无白色沉淀生成,则已经洗涤干净。
二、典例解析
1.工艺流程题中的考查
【例1】 (2023·广东惠州·三模节选)目前新能源技术被不断利用,高铁电池技术就是科研机构着力研究的一个方向。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K 2FeO 4),K 2FeO 4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO 3) 3制得Na 2FeO 4:3NaClO+2Fe(NO 3) 3+10NaOH=2Na 2FeO 4+3NaCl+6NaNO 3+5H 2O
Ⅱ.Na 2FeO 4与KOH反应生成K 2FeO 4,主要的生产流程如下:
④“提纯”K 2FeO 4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液。
A.H 2O
B.CH 3COONa、异丙醇
C.NH 4Cl、异丙醇
D.Fe(NO 3) 3、异丙醇
【解析】 ④K 2FeO 4在水溶液中易发生反应:4FeO2- 4+10H 2O═4Fe(OH) 3+8OH-+3O 2↑,所以应选用碱性非水溶剂,CH 3COONa显碱性
,抑制水解,异丙醇易挥发,所以B选项正确。
【答案】 B
【例2】 (2023·广东广州一模节选)铋的化合物在电催化和光催化领域都有广泛应用。一种从含铋矿渣(主要成分是CuBi 2O 4、CuO、Fe 2O 3、Al 2O 3、SiO 2等)中提取高纯Bi 2S 3的工艺如下:
已知:
①乙酰胺(CH 3CONH 2)有臭味、有毒,熔点为82 .3℃,沸点为221℃,可溶于水。
②常温下,K sp Bi OH 3 =4 .0×10-31,BiOCl+H 2OBi3++2OH-+Cl- K=1 .6×10-31。
③该工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(3)“洗涤”时先用水洗,再用稀硫酸洗涤。用稀硫酸洗涤的目的是为了除去滤饼中的 (填化学式)杂质。
【解析】 (3)加入NaOH溶液,调节pH=2 .5,滤饼中含有BiOCl和Fe(OH) 3,用稀硫酸洗涤的目的是为了除去滤饼中的Fe(OH) 3。
【答案】 (3) Fe(OH) 3
2.实验综合题中的考查
【例3】 (2022·重庆高考解析)研究小组以无水甲苯为溶剂,PCl 5(易水解)和NaN 3为反应物制备米球状红磷。该红磷可提高钠离子电池的性能。
(2)纳米球状红磷的制备装置如图2所示(搅拌和加热装置略)。
①在Ar气保护下,反应物在A装置中混匀后转入B装置,于280℃加熱12小时,反应物完全反应。其化学反应方程式为 。用Ar气赶走空气的目的是 。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是 和 。
【解析】 (2)①根据题意可知,反应物为PCl 5和NaN 3,产物为P,根据化合价的变化规律可知化学方程式为2PCl 5+10NaN 3=2P+15N 2↑+10NaCl;由于PCl 5易水解,故用Ar赶走空气的目的是防止PCl 5遇空气中的水蒸气而发生水解;②根据反应可知,得到的产物上沾有甲苯和NaCl,所以用乙醇洗去甲苯,用水洗去NaCl。
【答案】 (2)①2PCl 5+10NaN 3=2P+15N 2↑+10NaCl;防止PCl 5遇空气中的水蒸气而发生水解;②甲苯;NaCl。
【例4】 (2023·安徽芜湖·高三统考节选)六氨合氯化镁(MgCl 2 ·6NH 3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl 2 ·6NH 3为原料在实验室制备MgCl 2 ·6NH 3,并测定所得产品中氨的含量。
I.制备MgCl 2 ·6NH 3
i.首先制备无水MgCl 2,实验装置如图(加热及夹持装置略去):
已知:SOCl 2熔点-105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
ii.制备MgCl 2·6NH 3
将NH 3通入无水MgCl 2的乙醇溶液中,充分反应后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
(4)生成MgCl 2 ·6NH 3的反应需在冰水浴中进行,其原因为 。
(5)洗涤产品时,应选择的洗涤剂为 (填选项标号)。
A.冰浓氨水
B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液
D.氨气饱和的乙二醇溶液
【解析】 (4)因为反应物NH 3为易溶水气体,同时溶水后也易挥发,在冰水浴中进行反应可减少氨气的挥发;另外产物MgCl 2 ·6NH 3易溶于水,温度低时也有利于其析出晶体;
(5)由表中数据可知,MgCl 2 ·6NH 3在甲醇和乙二醇中均难溶,但乙二醇的沸点较高,不易挥发,洗涤后在晶体表面有残留,因此应选甲醇洗涤,同时为防止洗涤过程中产物分解导致损失,应在甲醇溶液中通入氨气减少MgCl 2 ·6NH 3损失,因此洗涤液用C。
【答案】 (4)减少NH 3的挥发;降低MgCl 2 ·6NH 3溶解度,有利于其结晶析出;(5)C。
【跟踪练习】
1.(2023·重庆模拟)一维结构氧化钇(Y 2O 3)在光学和陶瓷等领域有重要用途。研究小组制备该Y 2O 3的实验过程如图所示。
(3)洗涤时,先用蒸馏水后用乙醇的目的是 。
【解析】 (3)乙醇可以和水互溶,先用蒸馏水洗涤后留下的水分,可以通过酒精洗涤去除;
【答案】 (3)先用蒸馏水洗涤后留下的水分,可以通过酒精洗涤去除。
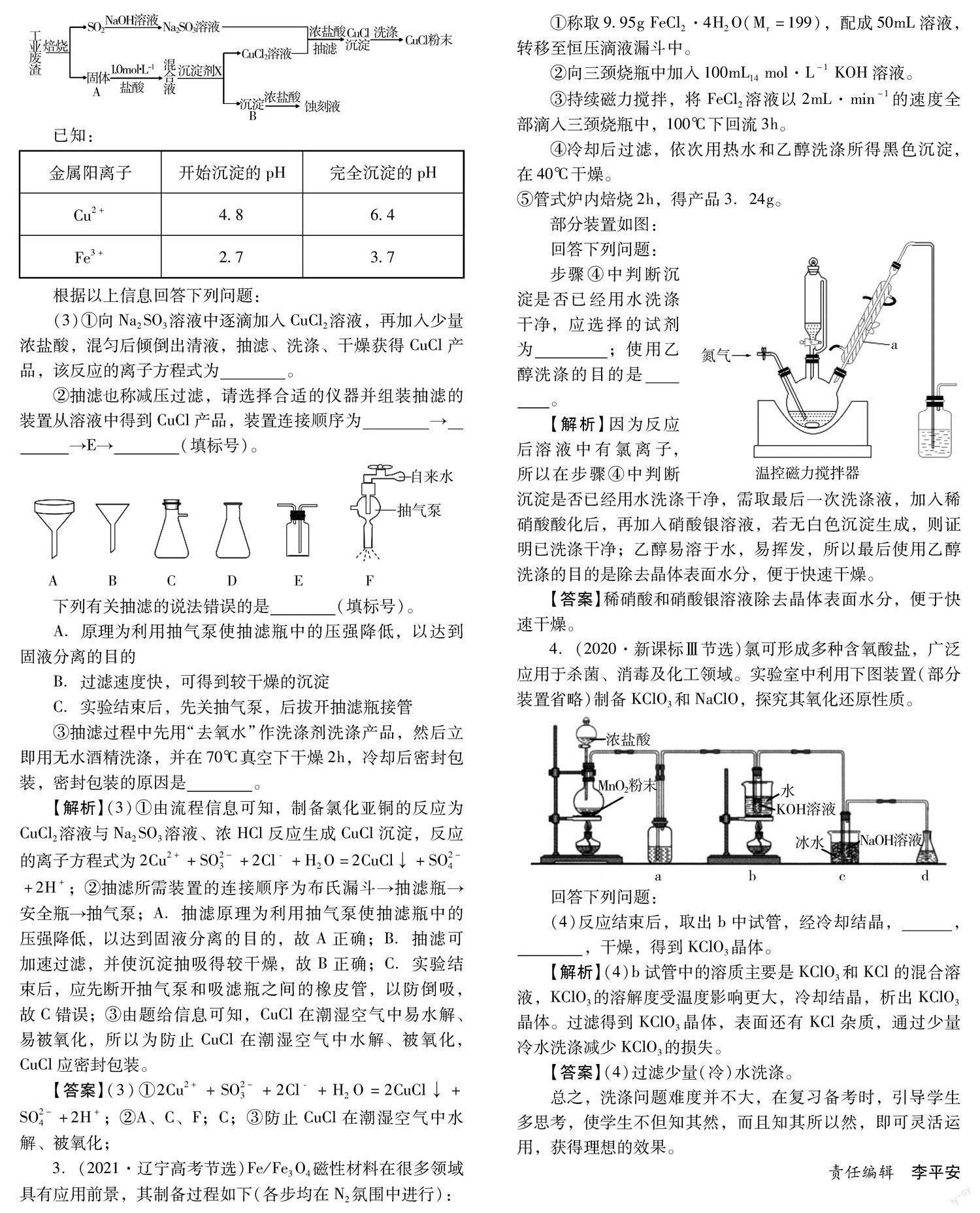
2.(2023·河北邯郸一模)氯化亚铜(化学式可表示为CuCl)常用作有机合成工业中的催化剂,微溶于水、不溶于乙醇,在潮湿空气中易水解、易被氧化。某学习小组用工业废渣(主要成分为Cu 2S和Fe 2O 3)制取CuCl并同时得到电路板蚀刻液,实验步骤如图:
已知:
根据以上信息回答下列问题:
(3)①向Na 2SO 3溶液中逐滴加入CuCl 2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为 。
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为 → →E→ (填标号)。
下列有关抽滤的说法错误的是 (填标号)。
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是 。
【解析】 (3)①由流程信息可知,制备氯化亚铜的反应为CuCl 2溶液与Na 2SO 3溶液、浓HCl反应生成CuCl沉淀,反应的离子方程式为2Cu2++SO2- 3+2Cl﹣+H 2O=2CuCl↓+SO2- 4+2H+;②抽滤所需装置的连接顺序为布氏漏斗→抽滤瓶→安全瓶→抽气泵;A.抽滤原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的,故A正確;B.抽滤可加速过滤,并使沉淀抽吸得较干燥,故B正确;C.实验结束后,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸,故C错误;③由题给信息可知,CuCl在潮湿空气中易水解、易被氧化,所以为防止CuCl在潮湿空气中水解、被氧化,CuCl应密封包装。
【答案】 (3)①2Cu2++SO2- 3+2Cl﹣+H 2O=2CuCl↓+SO2- 4+2H+;②A、C、F;C;③防止CuCl在潮湿空气中水解、被氧化;
3.(2021·辽宁高考节选)Fe/Fe 3O 4磁性材料在很多领域具有应用前景,其制备过程如下(各步均在N 2氛围中进行):
①称取9 .95g FeCl 2·4H 2O(M r=199),配成50mL溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入100mL 14 mol·L-1 KOH溶液。
③持续磁力搅拌,将FeCl 2溶液以2mL·min-1的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在40℃干燥。⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:
回答下列问题:
步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为 ;使用乙醇洗涤的目的是 。
【解析】 因为反应后溶液中有氯离子,所以在步骤④中判断沉淀是否已经用水洗涤干净,需取最后一次洗涤液,加入稀硝酸酸化后,再加入硝酸银溶液,若无白色沉淀生成,则证明已洗涤干净;乙醇易溶于水,易挥发,所以最后使用乙醇洗涤的目的是除去晶体表面水分,便于快速干燥。
【答案】 稀硝酸和硝酸银溶液除去晶体表面水分,便于快速干燥。
4.(2020·新课标Ⅲ节选)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO 3和NaClO,探究其氧化还原性质。
回答下列问题:
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO 3晶体。
【解析】 (4)b试管中的溶质主要是KClO 3和KCl的混合溶液,KClO 3的溶解度受温度影响更大,冷却结晶,析出KClO 3晶体。过滤得到KClO 3晶体,表面还有KCl杂质,通过少量冷水洗涤减少KClO 3的损失。
【答案】 (4)过滤少量(冷)水洗涤。
总之,洗涤问题难度并不大,在复习备考时,引导学生多思考,使学生不但知其然,而且知其所以然,即可灵活运用,获得理想的效果。
责任编辑 李平安
