控制变量法高考考题分析
2023-08-02区燕君
区燕君

控制变量是科学研究的重要方法,新人教版必修教材明确给出了变量控制的方法引导:只改变其中的某一个因素,控制其他因素不变,把多因素变成单因素问题再进行研究。《普通高中化学课程标准(2017年版2020年修订)》学业要求是能根据不同类型实验的特点,设计并实施实验,能运用变量控制的方法初步探究反应的规律。
近几年的高考常在不同类型的试题中考察学生控制变量思想,帮助学生提高归纳推理的能力和发展学生化学核心素养。下面结合典型高考试题进行分类讨论。
一、在数据设计中的应用
探究实验时,如果变量超过两种因素,一般采用表格表征。通过表格设计,从数据变化中寻找变量,用化学知识分析和解决问题,考察学生的探究能力。
【例1】 (2022·广东卷节选) 食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25℃时,HAc的 K a=1 .75×10-5=10-4 .76。某小组研究25℃下HAc电离平衡的影响因素。
提出假设 稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。
设计方案并完成实验 用浓度均为0 .1mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
①根据表中信息,补充数据:a= ,b= 。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡 (填”正”或”逆”)向移动;结合表中数据,给出判断理由: 。
③由實验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。
实验结论 假设成立。
【解析】 ①实验VII的溶液中 n (NaAc): n (HAc)=3 : 4, V (HAc)=4 .00mL,因此 V (NaAc) =3 .00mL,即a=3 .00;控制溶液总体积相同,其目的是保持HAc和NaAc混合后浓度倍数保持不变,由实验Ⅰ可知,V 总=40 .00mL,因此 V (H 2O)=40 .00mL-4 .00mL-3 .00mL =33 .00mL,即b=33 .00;②分析实验Ⅰ和Ⅱ,保持 c (NaAc)为0,控制 c (HAc)减少,实验Ⅰ的溶液pH=2 .86,实验Ⅱ溶液的 c (HAc)为实验I的 1 10 ,稀释过程中,若不考虑电离平衡移动,则实验Ⅱ所得溶液的pH=2 .86+1=3 .86,但实验Ⅱ溶液的pH=3 .36<3 .86,说明稀释过程中,溶液中 n (H+)增大,即电离平衡正向移动。
【答案】 3 .00 33 .00 正 实验Ⅱ相比于实验Ⅰ,醋酸溶液稀释了10倍,但溶液的pH增大值小于1。
【考点分析】 实验探究教学模式包括“提出假设、设计方案、实施验证、得出结论”,表格设计在实验探究中是常见的表征方法,体现控制变量的思想。高考试题用表格设计考查学生数据分析能力,体现试题的巧妙性。
二、在计算中的应用
指数关系能反映变量间的联系与规律,具有精确性和严密性等特点。确定影响因素,选择相关数据代入公式,深刻理解数据之间的强联系。
【例2】 (2022·辽宁卷节选) 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:
N 2(g)+3H 2(g)
2NH 3(g) ΔH=-92 .4 kJ·mol-1
ΔS=-200 J·K-1·mol-1
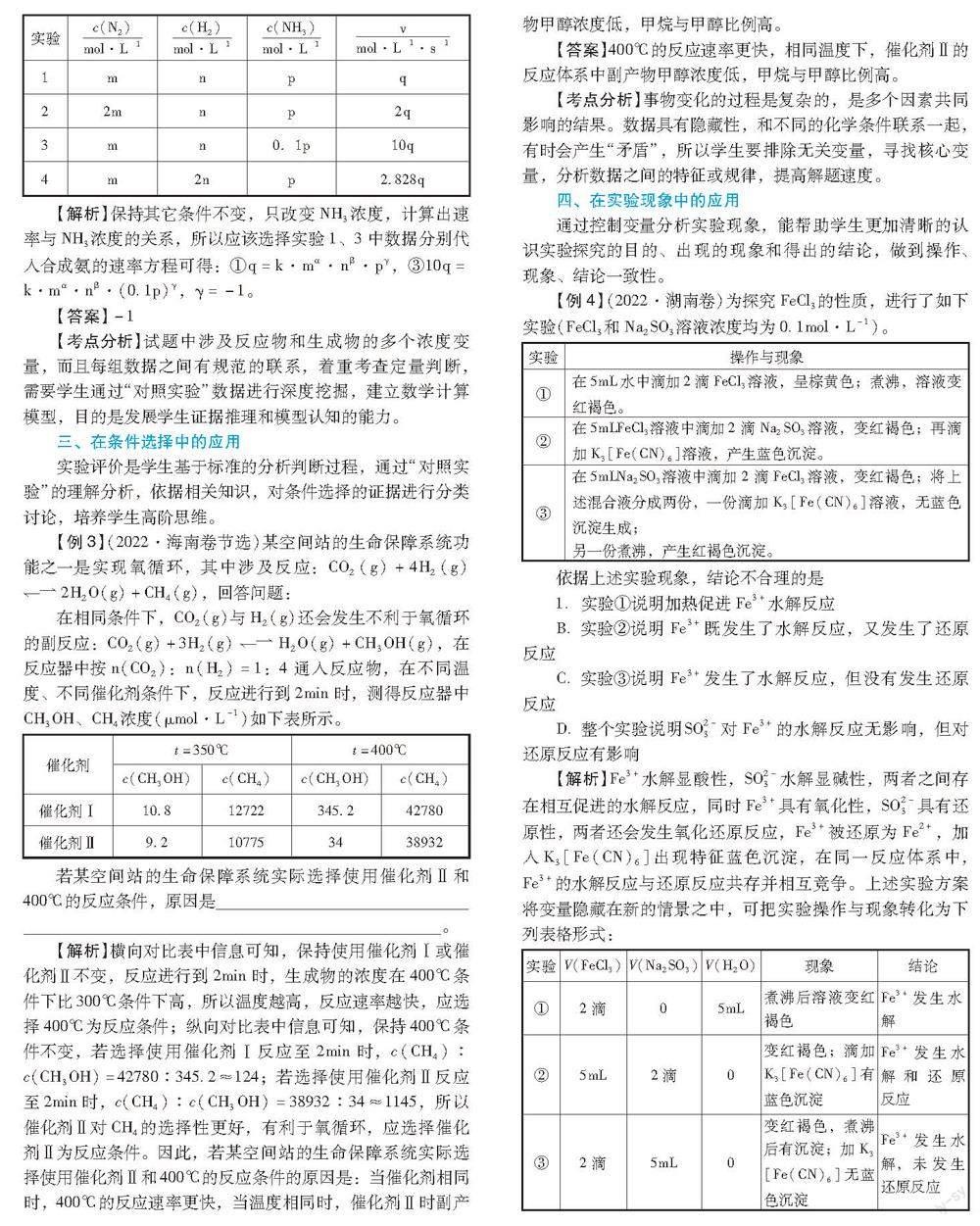
某合成氨速率方程为: v = kc α(N 2)· c β(H 2)· c γ(NH 3),根据表中数据,γ= ;
【解析】 保持其它条件不变,只改变NH 3浓度,计算出速率与NH 3浓度的关系,所以应该选择实验1、3中数据分别代入合成氨的速率方程可得:①q=k·mα·nβ·pγ,③10q=k·mα·nβ·(0 .1p)γ,γ=-1。
【答案】 -1
【考点分析】 试题中涉及反应物和生成物的多个浓度变量,而且每组数据之间有规范的联系,着重考查定量判断,需要学生通过“对照实验”数据进行深度挖掘,建立数学计算模型,目的是发展学生证据推理和模型认知的能力。
三、在条件选择中的应用
实验评价是学生基于标准的分析判断过程,通过“对照实验”的理解分析,依据相关知识,对条件选择的证据进行分类讨论,培养学生高阶思维。
【例3】 (2022·海南卷节选) 某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:CO 2(g)+4H 2(g)
2H 2O(g)+CH 4(g),回答问题:
在相同条件下,CO 2(g)与H 2(g)还会发生不利于氧循环的副反应:CO 2(g)+3H 2(g) H 2O(g)+CH 3OH(g),在反应器中按n(CO 2):n(H 2)=1:4通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中CH 3OH、CH 4浓度(μmol·L-1)如下表所示。
若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是
。
【解析】 横向对比表中信息可知,保持使用催化剂Ⅰ或催化剂Ⅱ不变,反应进行到2min时,生成物的浓度在400℃条件下比300℃条件下高,所以温度越高,反应速率越快,应选择400℃为反应条件;纵向对比表中信息可知,保持400℃条件不变,若选择使用催化剂Ⅰ反应至2min时, c (CH 4) : c (CH 3OH)=42780 : 345 .2≈124;若选择使用催化剂Ⅱ反应至2min时, c (CH 4) : c (CH 3OH)=38932 : 34≈1145,所以催化剂Ⅱ对CH 4的选择性更好,有利于氧循环,应选择催化剂Ⅱ为反应条件。因此,若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件的原因是:当催化剂相同时,400℃的反应速率更快,当温度相同时,催化剂Ⅱ时副产物甲醇浓度低,甲烷与甲醇比例高。
【答案】 400℃的反应速率更快,相同温度下,催化剂Ⅱ的反应体系中副产物甲醇浓度低,甲烷与甲醇比例高。
【考点分析】 事物变化的过程是复杂的,是多个因素共同影响的结果。数据具有隐藏性,和不同的化学条件联系一起,有时會产生“矛盾”,所以学生要排除无关变量,寻找核心变量,分析数据之间的特征或规律,提高解题速度。
四、在实验现象中的应用
通过控制变量分析实验现象,能帮助学生更加清晰的认识实验探究的目的、出现的现象和得出的结论,做到操作、现象、结论一致性。
【例4】 (2022·湖南卷) 为探究FeCl 3的性质,进行了如下实验(FeCl 3和Na 2SO 3溶液浓度均为0 .1mol·L-1)。
依据上述实验现象,结论不合理的是
1.实验①说明加热促进Fe3+水解反应
B. 实验②说明Fe3+既发生了水解反应,又发生了还原反应
C. 实验③说明Fe3+发生了水解反应,但没有发生还原反应
D. 整个实验说明SO2- 3对Fe3+的水解反应无影响,但对还原反应有影响
【解析】 Fe3+水解显酸性,SO2- 3水解显碱性,两者之间存在相互促进的水解反应,同时Fe3+具有氧化性,SO2- 3具有还原性,两者还会发生氧化还原反应,Fe3+被还原为Fe2+,加入K 3[Fe(CN) 6]出现特征蓝色沉淀,在同一反应体系中,Fe3+的水解反应与还原反应共存并相互竞争。上述实验方案将变量隐藏在新的情景之中,可把实验操作与现象转化为下列表格形式:
混合后V 总=5mL,实验①为对照实验,对比实验①和③,少量FeCl 3加入Na 2SO 3时发生水解反应,说明SO2- 3促进Fe3+的水解反应;分析实验②和③,过量FeCl 3才能继续与Na 2SO 3发生还原反应,说明Fe3+的水解反应速率比还原反应快,所以D选项错误。
【答案】 D
【考点分析】 高考实验试题基于实验现象描述进行命制,要求学生能运用对比分析的方法,即控制变量的思想对异常现象进行解释。现象中的“变红褐色或红褐色沉淀”和“蓝色沉淀”就构成了对比思考的基点,决定了因素的主次,反映了科学思维的特质。
五、在曲线分析中的应用
曲线分析是高考中常见的题型,需转换曲线和一般数据之间关系,从隐藏的变量中简化曲线,通过连环推理的方式,巧妙的完成题目分析。
【例5】 (2022·山东卷) 工业上以SrSO 4(s)为原料生产SrCO 3(s),对其工艺条件进行研究。现有含SrCO 3(s)的0 .1mol·L-1、1 .0mol·L-1 Na 2CO 3溶液,含SrSO 4(s)的0 .1mol·L-1、1 .0mol·L-1 Na 2SO 4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是( )
A.反应SrSO 4(s)+CO2- 3
SrCO 3(s)+SO2- 4的平衡常数K= K sp(SrSO 4) K sp(SrCO 3)
B.a = -6.5
C.曲线④代表含SrCO 3(s)的1 .0mol·L-1溶液的变化曲线
D.对含SrCO 3(s)且Na 2SO 4和Na 2CO 3初始浓度均为1 .0mol·L-1的混合溶液,pH≥7 .7时才发生沉淀转化
【解析】 先分析①②曲线:硫酸是强酸,当溶液pH变化时, c (SO2- 4)浓度几乎不变,则含硫酸锶固体的硫酸钠溶液中 c (Sr2+)的浓度几乎不变,保持pH相同时,溶液中 c (SO2- 4)越大, c (Sr2+)越小,所以曲线①代表含硫酸锶固体的0 .1mol·L-1硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1mol·L-1硫酸钠溶液的变化曲线;再分析曲线③④:碳酸是弱酸,当溶液pH减小,溶液中 c (CO2- 3)减小,则 c (Sr2+)增大,保持pH相同时,0 .1mol·L-1碳酸钠溶液中 c (CO2- 3)小于1mol·L-1碳酸钠溶液,则曲线③表示含碳酸锶固体的0 .1mol·L-1碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1mol·L-1碳酸钠溶液的变化曲线。A正确,
SrSO 4(s)+CO2- 3
SrCO 3(s)+SO2- 4的平衡常数K= c (SO2- 4) c (CO2- 3) = c (SO2- 4) c (Sr2+) c (CO2- 3) c (Sr2+) = K sp(SrSO 4) K sp(SrCO 3) ;B正确,根据曲线①数据得 K sp(SrSO 4)= 10-5 .5 ×0 .1=10-6 .5,由于温度不变,溶度积不变,当溶液pH为7 .7时, c (Sr2+)= K sp(SrSO 4) c (SO2- 4) = 10-6 .5 1 =10-6 .5mol·L,则a为-6 .5;根据上述曲线分析,C正确;D错误,曲线②、④代表含1mol·L-1硫酸钠溶液和碳酸钠的变化曲线,曲线②和④的交点pH=6 .9,当pH>6 .9时能发生沉淀转化。
【答案】 D
【考点分析】 课程标准要求学生掌握定量研究方法,其中坐标曲线就是科学研究常用的数据表征方法。从隐蔽曲线中解读试题的难度系数较大,应控制其它条件不变,只改变其中一个因素,从实验曲线中挖掘数据规律,发展学生归纳推理的能力。
控制变量法是解决化学问题的有效途径之一,不仅能帮助学生分析问题和寻找答案,还能引导学生形成研究物质变化规律的高阶思维,使理论和实践紧密结合。在此背景下,复习控制变量法可以采取以下几点策略:
(一)基于真实情境认识控制变量法
可以运用教材的实验或生产生活中的真实案例,通过对比方法,分析实验中的自变量、因变量和不变量,帮助学生充分理解控制变量法的基本概念和作用。
(二)通过实验设计建构思维模型
引导学生合作探讨并完成实验设计,在实验过程中建构控制变量的思维模型:明确研究目的→寻找自变量→控制单一变量→分析因变量(现象)→得出结论。
(三)运用控制变量法解决实际问题
在教学中将控制变量法作为一种科学方法,充分发挥学生的主观能动性,帮助学生在变量控制分析过程中实现从现象到本质地认识物质及其变化规律,解决实际化学问题。
总的来说,利用控制变量法分析实验,有助于形成化学学科思维,分析实验目的、设计实验方案,根据实验现象得出实验结论,有层次地帮助学生理解实验的本质。有助于提高教学效果,帮助学生快速解题,在各类实验试题中,引导学生将多因素问题变为单因素问题,把复杂问题简单化,使学生高效应对不同试题。有助于落实化学核心素养的培养,在实验教学过程中,学生掌握基础知识和基本技能,还通过控制变量法锻炼学生的必备实验能力,培养学生实验探究与创新意识、证据推理与模型认知的素养,促进学生的全面发展。
责任编辑 李平安
