miR-146b-5p靶向E3泛素蛋白连接酶促进高糖诱导的小鼠腹膜间皮细胞上皮间质转化
2023-08-02李嘉嘉王笑薇
吴 锦,李嘉嘉,王笑薇,王 娟
腹膜透析是临床治疗终末期肾脏疾病的常用方法,但长期透析会引起腹膜纤维化,致使患者退出治疗[1]。高糖刺激导致的腹膜间皮细胞外基质沉积,是腹膜纤维化的病理变化之一[2]。腹膜间皮细胞上皮间质转化(epithelial-to-mesenchymal transition,EMT)是腹膜纤维化的早期机制,有效抑制腹膜间皮细胞EMT对维持腹膜透析极为重要[3]。研究[4]表明,E3泛素蛋白连接酶(E3 ubiquitin-protein ligase,ZNRF3)能够抑制鼻咽癌细胞EMT过程,调控相关蛋白的表达,在其迁移和侵袭中发挥重要作用。
miRNA是长度约为22个核苷酸的非编码RNA,能靶向mRNA调控基因表达,参与多种病理生理过程。Pellegrini et al[5]证明miR-146b-5p在肾损伤和纤维化进展的不同阶段呈差异表达。同时,miR-146b-5p能靶向ZNRF3促进骨肉瘤细胞浸润和转移,并增强其耐药性[6]。但miR-146b-5p与ZNRF3在腹膜纤维化中的作用和机制尚不清楚。因此,该研究通过高糖诱导构建小鼠腹膜纤维化动物和细胞模型,探讨miR-146b-5p对其EMT进程的影响及其机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级6周龄C57BL/6J小鼠12只,体质量约20 g,购自湖南斯莱克景达实验动物有限公司,在22~26 ℃、50%~60%的相对湿度,人工光照明暗各12 h环境下饲养。实验动物使用许可证号:SYXK(鄂)2018-0104。
1.1.2主要试剂和仪器 戊巴比妥钠盐、葡萄糖购自Sigma公司;4.25%腹膜透析液购自成都青山利康公司;脂多糖(lipopolysaccharide,LPS)购自阿拉丁公司;胎牛血清购自Gibco公司;青链霉素混合液、CCK-8、RIPA(强)组织细胞快速裂解液和BCA蛋白浓度测定试剂盒、DAB浓缩型试剂盒、封闭山羊血清购自Solarbio公司;PVDF转移膜和化学发光试剂购自Millipore公司;苏木精购自雷根生物公司;兔抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(PAB46194)、兔抗上皮钙黏蛋白(epithelial cadherin,E-cadherin)抗体(PAB33542)、兔抗波形蛋白(Vimentin)抗体(PAB40605)和兔抗N-钙黏蛋白(N-cadherin)抗体(PAB33543)购自Bioswamp公司;兔抗ZNRF3抗体(NBP3-03924)购自Novus公司;兔抗I型胶原(type I collagen,COL I)抗体(ab87913)购自Abcam公司;MaxVision二抗(KIT-5020)购自迈新公司;TRIzol购自Ambion公司;双荧光素酶报告基因检测试剂盒购自碧云天公司;Transwell小室购自Corning公司;Matrigel胶购自BD公司。全自动化学发光分析仪(型号:Tanon-5200)购自上海天能公司;酶标仪(型号:MK3)购自芬兰雷勃公司;PCR仪(型号:GE48527)购自杭州柏恒公司。
1.2 实验方法
1.2.1模型构建及分组处理 12只C57BL/6小鼠随机分为对照组和模型组,每组6只。参考文献[7]方法构建腹膜纤维化小鼠模型,模型组小鼠腹腔注射4.25%葡萄糖透析液,每天100 ml/kg,持续4周,腹腔注射LPS,每天0.1 mg/kg,持续1周。对照组小鼠腹腔注射等量生理盐水。造模结束后采用1%戊巴比妥钠腹腔注射麻醉,取腹膜组织保存备用。Masson染色观察腹膜组织胶原纤维变化,免疫组化检测α-SMA和COL I表达,Western blot检测腹膜组织E-cadherin、α-SMA和COL I蛋白表达验证模型是否构建成功。
1.2.2免疫组化检测 取对照组和模型组小鼠腹膜组织按常规步骤脱水浸蜡包埋,冷冻后切片,贴附于载玻片上烤片1 h。二甲苯浸泡,梯度乙醇溶液浸泡,1 mmol/L的Tris-EDTA缓冲溶液中高压修复18 min,置于3%H2O2中湿盒孵育10 min,10%山羊血清湿盒孵育30 min,滴加α-SMA和COL I一抗(1 ∶50),湿盒孵育,4 ℃过夜,滴加 maxvision二抗,37 ℃孵育60 min。DAB和苏木精染色,乙醇溶液浸泡脱水,二甲苯中透明,中性树胶封片,显微镜拍照。
1.2.3qRT-PCR检测 TRIzol提取腹膜组织样本总RNA,反转录合成cDNA后进行PCR扩增。扩增体系:SYBR FAST qPCR Master Mix 10 μl,上游引物0.5 μl,下游引物0.5 μl,cDNA模板1 μl,ddH2O 8 μl。反应程序为:95 ℃ 3 min;95 ℃ 5 s;56 ℃ 10 s;72 ℃ 25 s;共40个循环。引物序列见表1,由武汉天一华煜基因科技有限公司合成。反应结束后获取CT值,采用2-ΔΔCT法进行统计分析。
1.2.4小鼠腹膜间皮细胞原代分离 参考文献[8]方法,无菌环境下取上述对照组小鼠大网膜,PBS漂洗3次,用含0.25%胰蛋白酶的PBS消化25 min后弃去消化液,加入含100 U/ml的青链霉素及15%胎牛血清的完全培养基终止消化,15 min后移入离心管,4 ℃下800 r/min离心5 min。弃上清液,用完全培养液重悬细胞,置于37 ℃、5% CO2培养箱培养,72 h后换液,然后每2~3 d换液1次。
1.2.5CCK-8检测 收集上述小鼠腹膜间皮细胞于96孔板,调整细胞悬液浓度为3×103个/孔,每孔100 μl,培养使细胞贴壁。将细胞分为对照组和不同浓度葡萄糖处理组(分别用含1%、2%、4%、6%、8%、10%葡萄糖的培养基培养细胞),培养24 h。取出细胞培养板,每孔加10 μl CCK-8溶液,培养4 h。450 nm处酶标仪检测各孔吸光度值,选择与对照组相比,增殖率下降最显著的最低葡糖糖浓度用于后续的造模实验。
1.2.6双荧光素酶报告基因检测 根据ZNRF3-3′ UTR野生型基因序列(5′-3′)为:GCTAGCGTGTGCTTGGGGTTCCGAGGTGTGGGATTGAGTTCTCTGCTTT-GTTTTTTTTTAAGATATTGTATGTCTAGA,ZNRF3-3′ UTR突变型对其进行定点突变,将ZNRF3-3′ UTR中碱基AGTTCTC突变为GACCAGA。构建含有miR-146b-5p结合位点的ZNRF3-3′ UTR野生型及突变型报告基因载体,进行酶切回收,连接目的基因片段与线性化载体,提取质粒DNA,测序。在小鼠腹膜间皮细胞中转染miR-146b-5p mimic,然后分别转染野生型及突变型报告基因载体;另一组细胞转染mimic-NC质粒,再分别转染ZNRF3-3′ UTR野生型及突变型载体,24 h按双荧光素酶报告基因检测试剂盒说明书进行实验操作。
1.2.7细胞分组与处理 将小鼠腹膜间皮细胞分为5组:对照组、模型组、mimic-NC组、miR-146b-5p-mimic组和miR-146b-5p-inhibitor组。将正常培养的小鼠腹膜间皮细胞作为对照组,模型组用含6%葡萄糖的培养基培养24 h。构建miR-146b-5p-mimic NC质粒、mimic质粒、inhibitor质粒,分别转染小鼠腹膜间皮细胞纤维化模型,24 h后收集各组细胞,进行后续实验。
1.2.8Western blot检测 收集各组约1×106个细胞,加裂解液裂解细胞,12 000 r/min离心10 min,取上清液。BCA法进行蛋白定量。通过SDS-PSGE电泳分离,将蛋白转移至PVDF膜上,5%脱脂奶粉封闭过夜,加一抗(E-cadherin、ZNRF3、Vimentin、N-cadherin,1 ∶1 000)室温孵育1 h,洗膜,加HRP标记的二抗(1 ∶20 000)室温孵育1 h,洗膜,ECL发光液显影,TANON GIS软件读取相关条带灰度值。
1.2.9Transwell小室检测 细胞迁移实验:调整细胞悬液浓度为1×102/L,取0.5 ml接种至Transwell小室内。下层24孔板加0.75 ml含10%胎牛血清的DMEM/F12培养液,培养24 h,弃去培养基,PBS清洗,每孔加4%甲醛室温固定20 min。PBS洗涤,加0.5%结晶紫溶液染色30 min,用棉签擦去Transwell小室内未迁移的细胞,置于200×显微镜下观察,计数每个视野中的细胞数。
细胞侵袭实验:接种前在小室中铺80 μl Matrigel胶,37 ℃培养箱放置30 min。其余实验步骤同细胞迁移实验操作。
1.3 统计学处理用SPSS 20.0软件进行统计学分析。计量资料以均数±标准差表示。两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 模型鉴定如图1A所示,对照组小鼠腹膜组织薄,呈连续分布;模型组小鼠腹膜组织明显增厚,胶原纤维明显增多。如图1B所示,模型组中,主要集中于腹膜组织中血管的管壁的α-SMA和间皮基质中的COL I阳性表达明显增多。
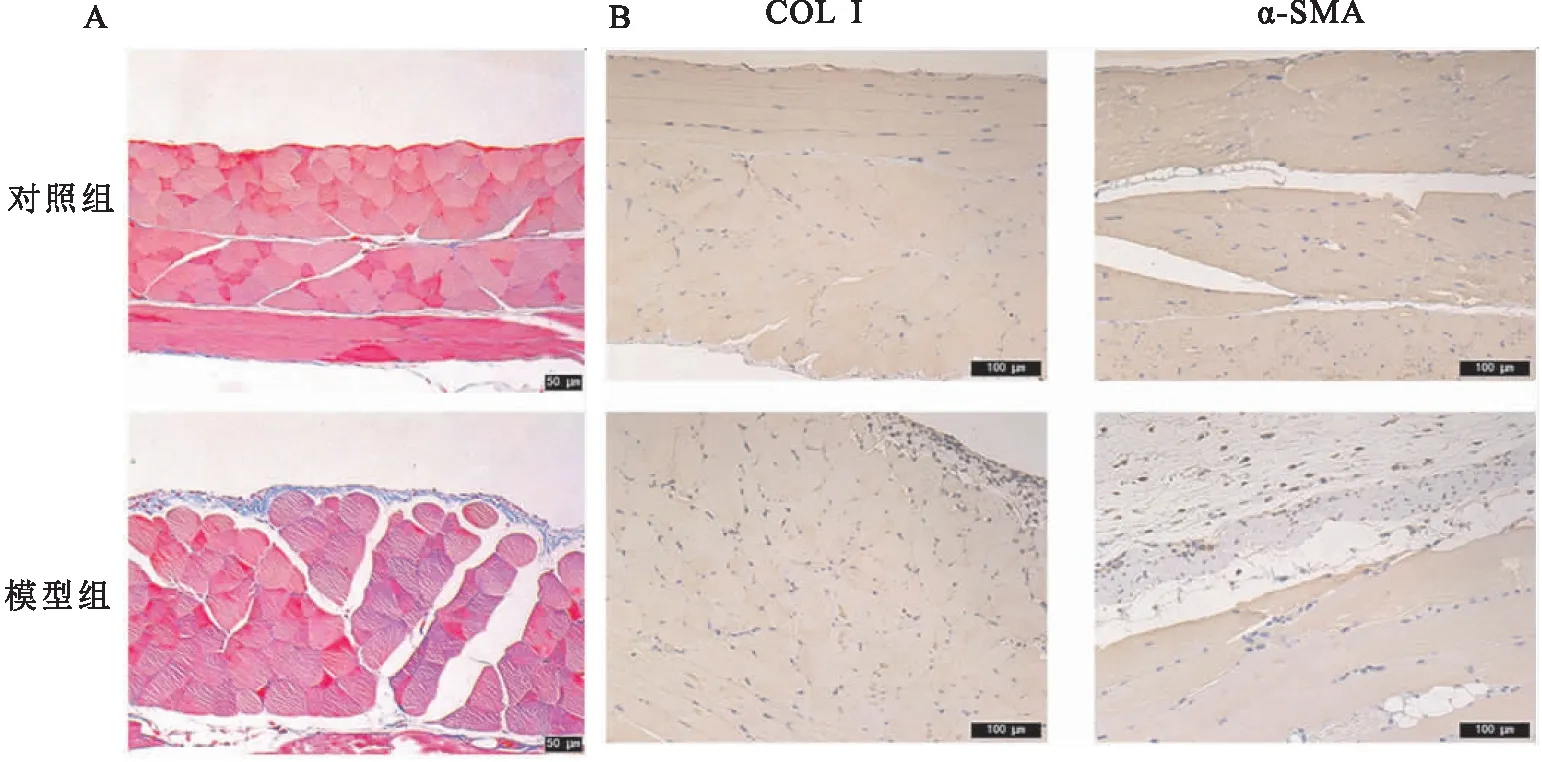
图1 腹膜纤维化小鼠模型鉴定A:腹膜组织Masson染色 ×200;B:腹膜组织COL I和α-SMA免疫组化染色 ×200
2.2 腹膜纤维化小鼠模型中miR-146b-5p、ZNRF、COL I及α-SMA表达如图2A所示,与对照组相比,模型组小鼠腹膜组织中E-cadherin表达降低(F=286.63),COL I(F=390.47)及α-SMA(F=663.10)表达升高(P<0.05)。如图2B所示,与对照组相比,模型组小鼠腹膜组织中miR-146b-5p表达升高(F=405.66,P<0.05),ZNRF3表达降低(F=625.33,P<0.05)。

图2 miR-146b-5p和ZNRF3在腹膜纤维化小鼠模型中的表达
2.3 miR-146b-5p靶向负调控ZNRF3表达如图3A所示,miR-146b-5p与ZNRF3存在结合位点。如图3B所示,与mimic-NC组相比,miR-146b-5p mimic可降低ZNRF3野生型3′-UTR荧光素酶活性(F=279.53,P<0.05),而ZNRF3突变型3′-UTR荧光素酶活性无变化(P>0.05)。如图3C所示,与对照组相比,模型组和mimic-NC组ZNRF3表达降低。与mimic-NC组相比,转染miR-146b-5p mimic的小鼠腹膜间皮细胞中ZNRF3表达降低,转染miR-146b-5p inhibitor的小鼠腹膜间皮细胞中ZNRF3表达升高。
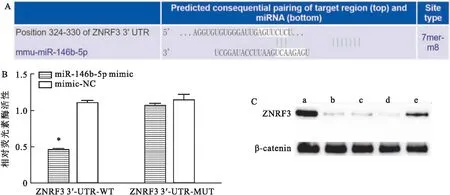
图3 miR-146b-5p靶向负调控ZNRF3表达
2.4 高糖诱导小鼠腹膜间皮细胞纤维化并抑制ZNRF3表达如图4A所示,与对照组相比,不同浓度(1%、2%、4%、6%、8%、10%)葡萄糖处理的小鼠腹膜间皮细胞增殖活性降低(F=446.47,P<0.05),且呈剂量依赖性,其中含6%的葡萄糖培养液处理后,细胞增殖活力下降17.17%,因此,选择6%的葡萄糖进行后续实验。如图4B、4C所示,E-cadherin和ZNRF3表达也降低(F=220.72、246.33,P<0.05)。
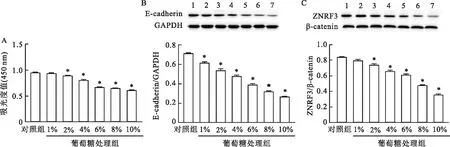
图4 高糖诱导小鼠腹膜间皮细胞纤维化并抑制ZNRF3表达
2.5 过表达miR-146b-5p促进小鼠腹膜间皮细胞迁移和侵袭如图5所示,与对照组相比,模型组与mimic-NC组小鼠腹膜间皮细胞迁移和侵袭能力增强(P<0.05)。与mimic-NC组相比,转染miR-146b-5p-mimic的小鼠腹膜间皮细胞迁移和侵袭能力增强(P<0.05),转染miR-146b-5p-inhibitor的小鼠腹膜间皮细胞迁移和侵袭能力下降(P<0.05)。

图5 过表达miR-146b-5p促进小鼠腹膜间皮细胞迁移和侵袭
2.6 过表达miR-146b-5p对EMT相关蛋白表达的影响如图6所示,与对照组相比,模型组与mimic-NC组E-cadherin表达降低(F=714.62,P<0.05),Vimentin和N-cadherin表达升高(F=639.34、572.69,P<0.05)。模型组与mimic-NC组E-cadherin、Vimentin和N-cadherin的表达无显著差异(P>0.05)。与mimic-NC组相比,miR-146b-5p-mimic组小鼠腹膜间皮细胞E-cadherin表达降低(F=714.62,P<0.05),Vimentin和N-cadherin表达升高(F=639.34、572.69,P<0.05),miR-146b-5p-inhibitor组小鼠腹膜间皮细胞E-cadherin表达升高(F=714.62,P<0.05),Vimentin和N-cadherin表达降低(F=639.34、572.69,P<0.05)。

图6 过表达miR-146b-5p对EMT相关蛋白表达的影响
3 讨论
腹膜透析作为终末期肾功能衰竭患者的替代疗法,在世界范围内发展迅速,然而,进行性腹膜纤维化是长期腹膜透析患者无法避免的问题。miRNA在抑制腹膜透析相关腹膜纤维化的进展中起关键作用。He et al[9]研究认为,与正常对照组大鼠相比,腹膜透析组大鼠miR-15a-5p表达水平降低,血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)表达水平升高,miR-15a-5p可通过靶向VEGFR参与腹膜透析相关腹膜纤维化的EMT过程。Li et al[10]研究表明,腹膜透析患者miR-302c水平下调,且miR-302c的表达与EMT相关因子的表达呈负相关。接受慢性高糖腹膜透析液输注的小鼠具有腹膜纤维化的典型特征,并且α-SMA和COL Ⅰ的表达更高[11]。本研究构建的腹膜纤维化小鼠模型中小鼠腹膜组织明显增厚,胶原纤维明显增多,α-SMA和COL Ⅰ的表达较正常腹膜组织升高,miR-146b-5p表达也升高。这提示腹膜纤维化小鼠模型成功构建,且其miR-146b-5p表达较正常小鼠发生变化。同时,通过采用不同浓度葡萄糖诱导小鼠腹膜间皮细胞,构建体外纤维化模型,进一步探讨miR-146b-5p在腹膜透析相关腹膜纤维化中的作用。
EMT是导致腹膜纤维化的关键过程,其特点是破坏细胞极性和黏附能力以获得间充质特征,如迁移和侵袭能力,在EMT过程中,上皮钙黏附蛋白E-cadherin下调,而间充质标志物N-cadherin和Vimentin上调[12]。本研究中,模型组小鼠腹膜组织和腹膜间皮细胞中E-cadherin表达均降低,上调miR-146b-5p表达后,高糖诱导的小鼠腹膜间皮细胞迁移和侵袭能力增强,增殖活性下降,E-cadherin表达再次降低,Vimentin和N-cadherin表达升高,而抑制miR-146b-5p表达后,细胞迁移和侵袭能力下降,E-cadherin表达升高,Vimentin和N-cadherin表达下降,这表明miR-146b-5p促进高糖诱导的小鼠腹膜间皮细胞EMT进程。
ZNRF3是E3泛素连接酶家族成员,在多种癌细胞中下调,通过调控Wnt/β-catenin通路抑制细胞生长、侵袭并诱导细胞凋亡[13]。张钰欣 等[14]利用葛根素上调miR-490的表达,降低ZNRF3的表达,调控细胞中EMT相关蛋白表达,抑制非小细胞肺癌的生长、侵袭和迁移。本研究中通过TargetScan预测网站和双荧光素酶报告基因检测,发现miR-146b-5p与ZNRF3存在结合位点,ZNRF3是miR-146b-5p的靶基因之一。在甲状腺癌相关研究中,miR-146b被证明在癌组织中高表达,并能通过靶向作用于ZNRF3参与癌细胞EMT进程,促进其迁移和侵袭[15]。本研究中,高糖诱导降低了小鼠腹膜间皮细胞ZNRF3的表达,将miR-146b-5p mimic转染至小鼠腹膜间皮细胞后,ZNRF3的表达下调,而miR-146b-5p表达受到抑制时,ZNRF3的表达上调,这提示miR-146b-5p靶向负调控ZNRF3的表达,进而调控小鼠腹膜间皮细胞EMT过程。
综上所述,本研究显示miR-146b-5p可靶向ZNRF3基因促进高糖诱导的小鼠腹膜间皮细胞EMT进程。尽管其机制需要进一步的探索,但miR-146b-5p可作为预防腹膜透析相关腹膜纤维化的作用靶点。
