半滑舌鳎体表溃疡症细菌性病原的分离鉴定及组织病理学研究
2023-08-01吴雅婷汪笑宇汤青平武尊高浩峰何学欣杨张磊贾旭颖邵蓬
吴雅婷, 汪笑宇, 汤青平, 武尊, 高浩峰, 何学欣,杨张磊, 贾旭颖, 邵蓬*
(1.天津农学院水产学院,天津市水产生态及养殖重点实验室,天津 300384;2.天津市水产研究所,天津 300221)
半滑舌鳎(Cynoglossus semilaevisGunther), 国内俗称“牛舌头”“鳎目”, 主要分布在我国的黄海和渤海海域, 体型大、生长快、经济价值高,已成为我国北方沿海地区重要的海水养殖经济鱼类[1]。随着养殖规模不断扩大,各种疾病也随之发生,其中皮肤溃疡病给天津地区半滑舌鳎的养殖产业发展造成了严重的经济损失[2]。半滑舌鳎的体表溃疡症大多与弧菌病有关,包括哈维氏弧菌(Vibrio harveyi) 、鳗弧菌(V.anguillarum)、需钠弧菌(V.natriegens)、溶藻弧菌(V.alginolyticus)、灿烂弧菌(V.splendidus)、副溶血弧菌(V.parahaemolyticus)、轮虫弧菌(V.rotiferianus)、创伤弧菌(V.vulnificus)、杀鲑弧菌(V.salmonicida)、海利斯顿氏菌(V.pelagius)、美人鱼弧菌(V.damsela)、奥氏弧菌(V.ordalii)、费氏弧菌(V.fischeri)以及最小弧菌(V.mimicus)等[3-4]。其中,哈维氏弧菌导致的水产动物死亡已经引起广泛关注。陈政强等[2]从体表溃疡的半滑舌鳎体内分离出轮虫弧菌和哈维氏弧菌;许悦等[5]从体表溃疡的石斑鱼体内分离出9株菌,经鉴定全部为哈维氏弧菌。
哈维氏弧菌(ATCC 14126T)最早从死片脚类动物中分离出来,并于1935年命名为Achromobacter harveyi[6],分类到发光杆菌属,之后又被分到贝内克氏菌属。贝内克氏菌属被废除后最终被分到弧菌属[7]。哈维氏弧菌是最常见的1种海洋弧菌,可能与海洋动物的肠道菌群有关[8],可以感染很多海洋鱼类或无脊椎动物[9]。该病具有死亡率高、流行性强且分布广的特点[10],对海水鱼类的危害极大。病鱼的症状主要表现为腹水,肠道外翻,肾脏及脾脏充血,体表鳞片脱落、溃疡,严重时溃疡处不断扩大形成溃烂,病鱼停止摄食,最终死亡[1]。
本研究对某养殖场患病半滑舌鳎进行了临床诊断、病原菌分离、人工感染、药敏分析以及病理组织切片分析,以期为科学防治由该菌导致的半滑舌鳎疾病提供参考依据。
1 材料及方法
1.1 患病鱼的临床检查
患病鱼体取自天津某半滑舌鳎养殖场,体表观察后取患病鱼的鳃丝及体表黏液制成水浸片于显微镜(DM750,Leica)下观察有无寄生虫和真菌感染,将病鱼解剖进一步观察鱼体肠道、肝脏及脾脏等内部器官的症状。
1.2 病原菌的分离与培养
在无菌条件下分别从病鱼的肝脏、肾脏、脾脏等处取样并接种于2216E和TCBS培养基(青岛海博生物技术有限公司),28 ℃培养24 h。根据菌落形态分为不同种菌株,挑取单菌落进行纯化培养。纯化后的菌株转入液体培养基中加20%甘油,放于冰箱-80 ℃保存。
1.3 人工感染试验及LD50测定
健康半滑舌鳎取自天津市滨海新区某半滑舌鳎养殖公司,体长为18~24 cm,体质量35~45 g。根据养殖场养殖条件(水温26 ℃,盐度20)于循环水中暂养1周,早晚各投喂1次并进行池底吸污,1周后开始攻毒试验。试验共设置5个处理组,4个试验组和1个对照组,每组10尾鱼。试验前将-80 ℃甘油保存的菌株放室温下复苏,经2216E平板活化、纯化,选择生长良好的单菌落接种到BHI液体培养基(青岛海博生物技术有限公司),28 ℃震荡培养24 h,待菌体生长是指数生长期时,12 000 r·min-1离心5 min收集菌体,采用麦氏比浊法[11]将菌悬液稀释为4个水平,依次为1.0×104、1.0×105、1.0×106、1.0×107CFU·mL-1。,每尾鱼采用腹腔注射法进行感染,注射量均为0.2 mL,对照组注射等量生理盐水,观察7 d内鱼的死亡情况并记录,用Bliss法测定试验鱼7 d的半数致死剂量[12]。
1.4 革兰氏染色及生理生化鉴定
在2216E培养基上取单个菌落置于载玻片上进行革兰氏染色,光学显微镜下观察细菌形态并拍摄记录。依据说明书,使用API 20NE试剂盒(法国梅里埃生物中国有限公司)对生理生化鉴定, 依据《伯杰氏细菌学鉴定手册》[13]选取标准菌进行比对。
1.5 16S rRNA扩增
用灭菌接种环挑取单菌落悬浮于100 μL无菌去离子水中,100 ℃水浴10 min, 12 000 r· min-1离心10 min, 取2 μL上清液进行PCR扩增。PCR反应体系:TaqDNA聚合酶25 μL、10 μmol·L-1的上下游引物各1.5 μL(表1)、灭菌双蒸水20 μL、DNA模板2 μL。PCR反应程序∶95 ℃预变性3 min;98 ℃变性10 s,55 ℃复性15 s,72 ℃延伸10 s,30个循环;72 ℃温育5 min。用1%琼脂凝胶电泳对扩增产物进行检测,将特异性条带切胶回收后送至三博远志公司测序。
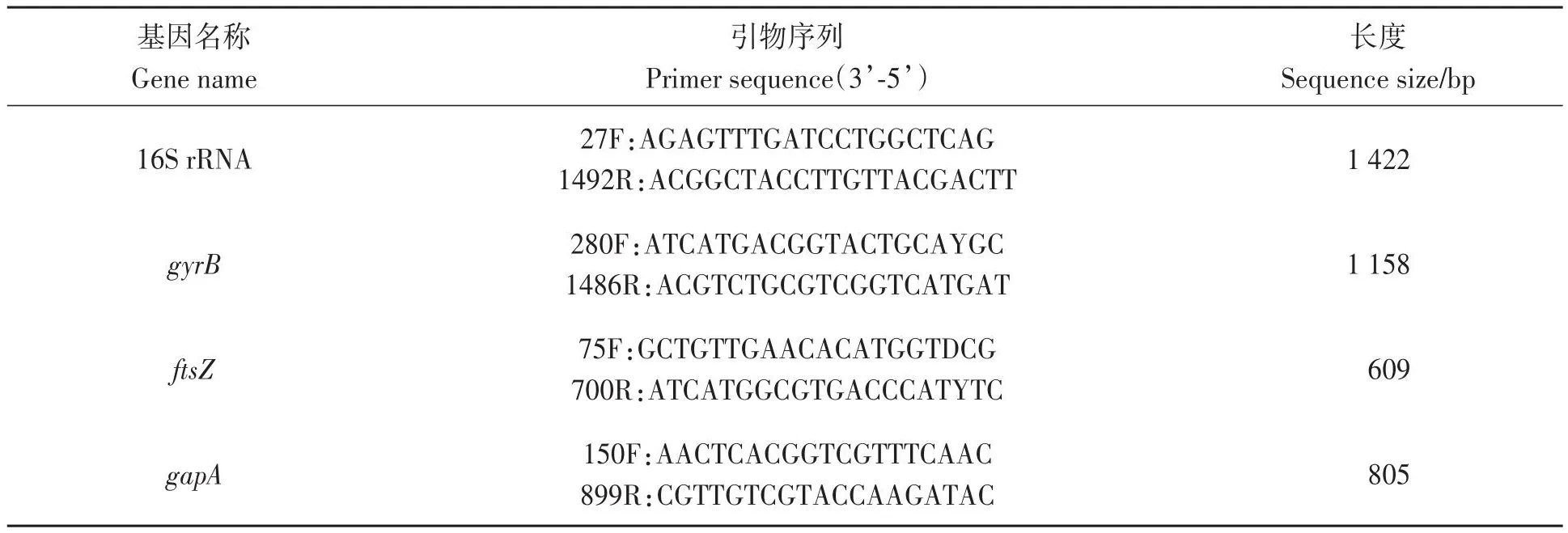
表1 引物序列Table 1 Primer sequences
16S rRNA及gyrB、ftsZ、gapA序列通过NCBI的Blast (http://www.ncbi.nlm.nih.gov/Blast/)进行检索,用 MEGA 7.0 软件建树后进行序列同源性分析。
1.6 病理组织切片
取病鱼的皮肤、肠道、肾脏及脾脏等病变明显的组织用4%多聚甲醛固定的组织器官进行修剪、脱水、透明、石蜡包埋、修蜡、切片等操作,切好的蜡片进行贴片并干燥后,进行HE染色,使用二甲苯封片[14]。对病理切片进行镜检分析。
1.7 药敏试验
采用琼脂纸片扩散法(K-B)对病原菌进行药敏试验[12]。用琼脂培养基对病菌进行复苏后制成菌悬液,用无菌棉签蘸取菌液涂布于BHI固体培养基,然后贴上药敏纸片(购自温州市康泰生物科技有限公司),每个平板贴6片。24 ℃培养24 h,测量抑菌圈的直径,根据说明书对药敏试验结果敏感性进行判定。
2 结果与分析
2.1 患病鱼临床症状表现
患病鱼出现游动缓慢、离群、停止摄食、鱼体消瘦、体色暗沉等现象;病鱼身体四周出现轻微充血现象,病鱼腹部轻微肿胀溃疡,并伴随鳞片脱落(图1A、B),部分病鱼肠道脱出肛门并伴随大量肠道腹水(图1C);解剖后可见肠道空乏无食物并伴有大量腹水、肾脏、脾脏出现肿大充血现象(图1D、E);部分病鱼出现肝脏暗红出血症状(图1F)。

图1 患病半滑舌鳎临床症状Fig.1 Clinical symptoms of ill half smooth tongue sole
2.2 病原菌分离及人工感染结果分析
从病鱼的脾脏和肾脏分离出2株优势菌株,分别命名为8-0634、8-0635。细菌的培养结果显示,这2株菌均在2216E培养基上生长,为白色不透明菌落;菌株8-0635在TCBS培养基上生长为黄色、不透明且边缘完整的圆形菌落(图2);菌株8-0634在TCBS培养基上不生长。

图2 菌株8-0635在TCBS上生长Fig.2 Growth of strain 8-0635 on TCBS media
对2株优势菌分别进行人工感染试验,发现只有菌株8-0635感染鱼后能引起鱼类死亡,感染8-0635的半滑舌鳎1周内的死亡情况如表2所示,其半数致死剂量LD50为3.7×105CFU·mL-1。这与之前的患病鱼症状相似,因此对这株优势菌进行鉴定。
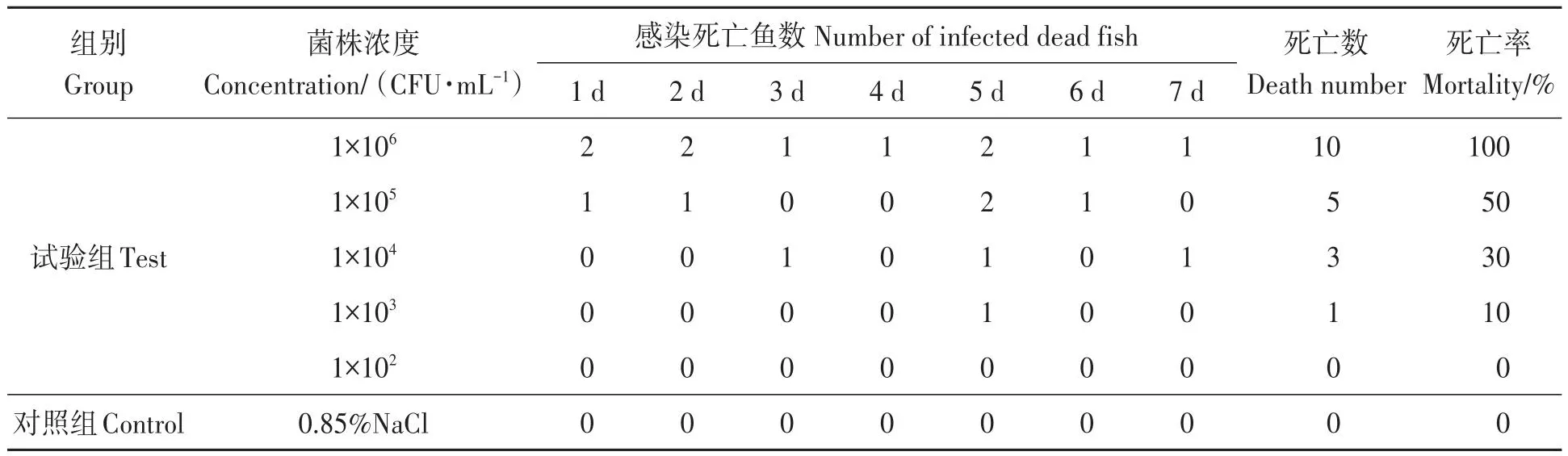
表2 半滑舌鳎人工回归感染结果Table 2 Results of artificial regression infection of Cynoglossus semilaevis
2.3 革兰氏染色及生理生化鉴定结果
菌株8-0635在2216E上生长表现为白色不透明的圆形菌落,边缘光滑。经革兰氏染色后在镜下观察为短杆状细菌,两端钝圆,菌体大小为1~4 μm(图3)。
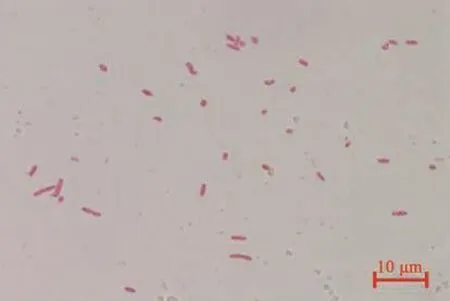
图3 菌株8-0635革兰氏染色Fig.3 Gram staining of strain 8-0635
对菌株8-0635分别进行了8.5‰和20.0‰NaCl下的生理生化试验,结果(表3)显示与哈维氏弧菌最为接近,依据《伯杰氏细菌学鉴定手册》[13]选取了3株哈维氏弧菌的标准菌株与优势菌株8-0635进行比对,结果显示菌株8-0635虽然与标准菌株的生理生化结果近似,但仍有差异。

表3 菌株8-0635的主要生理生化指标检测结果Table 3 Test results of main physiological and biochemical indexes of strain 8-0635
2.4 分子鉴定结果分析
对菌株8-0635进行了分子鉴定,测序结果与其他9株菌构建系统发育树,发现菌株8-0635与8种菌株的序列同源性均较低(图4),无法区分该菌株。在此基础之上,将16S rRNA和3个保守基因(gyrB、ftsZ、gapA)的片段与原菌株基因序列构建系统发育树进行比对,发现菌株8-0635与V.harveyi的同源性较高(图5),故判断菌株8-0635为哈维氏弧菌。

图4 菌株8-0635的16S rRNA系统发育树Fig.4 16S rRNA phylogenetic tree of strain 8-0635

图5 菌株8-0635的多位点系统发育树Fig.5 Multi-site phylogenetic tree of strain 8-0635
2.5 病理组织切片分析
依次取发病的半滑舌鳎的肾脏、脾脏、性腺及肠道切片观察。肾脏组织的结构模糊,其细胞排列不整齐,与哈维氏弧菌感染症状一致[15]。肾小管上皮受损严重,表现为上皮脱落,细胞裂解死亡(图6A);脾脏出血严重,血管破裂,血细胞渗出(图6B);病鱼的前中后肠均有严重病变,表现为肠黏膜受损脱落,充血严重,伴有血管破损,血液渗出(图6C)。肌肉受损,表现为肌纤维断裂(图6D)。各组织中均有明显炎细胞浸润现象。
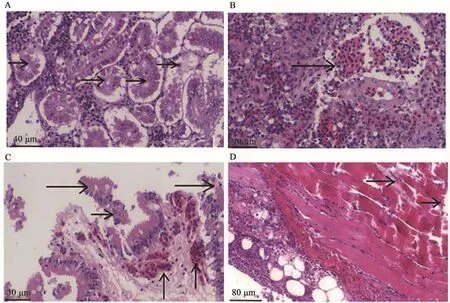
图6 病理组织切片观察Fig.6 Observation of pathological sections
2.6 药敏试验结果分析
通过对42种抗菌药物药敏试验结果(表4)显示,菌株8-0635对头孢哌酮、氟苯尼考、氯霉素、氨苄西林等16种药物高度敏感;对红霉素、克拉霉素、替卡西林、恩诺沙星、卡那霉素等9种药物中度敏感;对土霉素、四环素、萘啶酸、万古霉素、链霉素等17种药物不敏感。

表4 菌株8-0635的药敏试验结果Table 4 Drug sensitivity test results of strain 8-0635
3 讨论
本研究生理生化鉴定结果与Schleifer[7]方法略有不同,很难确定病原菌种类。结合16S rRNA及系统发育树对菌株8-0635进行了分析,发现菌株8-0635与NCBI上所选取的标准菌株同源性较低。由此可见,随着弧菌的进化和发展,单纯的16S rRNA与生理生化鉴定方法已经无法满足弧菌的准确鉴定,本研究引入了管家基因[16]进行多位点测序(multilocus sequence analysis)。Wan等[17]通过16S rRNA和3种管家基因gyrB、ftsZ、gapA准确地鉴定出了哈维氏弧菌,因此通过保守的蛋白质编码基因(16S rRNA、gyrB、ftsZ、gapA)能可靠地检测和鉴定这些物种。经多位点测序的方法重新建立的系统发育树显示,菌株8-0635与哈维氏弧菌的同源性较高,故可鉴定菌株8-0635为哈维氏弧菌。
皮肤溃疡病也被称为皮肤溃烂病,是水产养殖动物的常见病,给水产养殖业造成了严重的经济损失[18]。崔婧等[4]研究表明,哈维氏弧菌易感染红鳍笛鲷、珍珠龙胆等,不仅可引起感染对象鳞片脱落、皮肤坏死、肌肉溃烂等严重病灶,而且还会引起病鱼的肝脏、脾脏、头肾等多种内脏器官充血、产生白斑等病变;张凤萍等[19]研究表明,鮸鱼感染哈维氏弧菌会表现出厌食、游动迟缓、尾柄和胸鳍基部呈出血性溃疡。Liu等[20]研究表明,感染哈维氏弧菌的军曹鱼会出现肠胃炎等症状。与上述研究一致,本文患病鱼体表现为体表皮肤溃烂出血、腹水、眼球突出,食欲不振等症状,最终停止摄食导致死亡,经鉴定从半滑舌鳎肾脏中分离出的哈维氏弧菌是主要的致病菌,人工感染试验得出半数致死量LD50为3.7×105CFU·mL-1,与徐晓丽等[1]从半滑舌鳎所分离菌的半数致死量(LD50)为7.15×105CFU·mL-1相比较高,可能是不同菌株的毒力不同导致。对感染哈维氏弧菌的半滑舌鳎的肌肉、脾脏、肾脏和肠道的组织切片进行观察,可见各组织间均有大量的炎细胞浸润,肌肉表现为肌纤维断裂,脾脏有血细胞渗出现象,肾脏病变严重表现为肾小管空腔消失,肾小管上皮受损,细胞裂解死亡;肠道表现为肠黏膜受损脱落,血管破裂,血细胞流入间质。
感染哈维氏弧菌的鱼类疾病多爆发于每年的5—10月,易发生在养殖密度较高、水温较高的鱼类之间,多种不同生长时期的鱼类都可发病[4]。研究表明,弧菌病多是通过肌肉受损感染[21],但由于哈维氏弧菌的致病机制尚不清楚,还没有有效的方法来控制其传播[22]。目前哈维弧菌的防治方法主要有抗生素、中草药、生物防治和免疫防治等[10]。此外,也可以利用微生物制剂、群感效应等手段对其进行防治[23]。随着我国水产养殖业的不断发展,弧菌病在水体中扩散加上我国水产养殖业给药合理性的欠缺,抗生素的滥用导致了不同地区来源的哈维氏弧菌具有丰富的耐药谱[24]。本研究中半滑舌鳎感染哈维氏弧菌的药敏试验显示,其对头孢噻吩、头孢唑酮、阿莫西林、庆大霉素、氟苯尼考等药物敏感,为该地区哈维氏弧菌的防治提供了参考。
