大肠杆菌O157∶H7生物被膜状态下基因表达分析
2023-08-01马蓝彭晴徐小轻杨硕张宇微田丹丹施琳波石波乔宇
马蓝, 彭晴, 徐小轻, 杨硕, 张宇微, 田丹丹, 施琳波, 石波, 乔宇
(中国农业科学院饲料研究所,北京100081)
细菌生物被膜是细菌受到环境压力如营养缺乏、低pH或抗菌物质存在时,黏附在非生物或生物基质表面,分泌大量由多糖、蛋白质、脂类、核酸等组成的胞外多聚物将菌体包裹在其中而形成的膜状物[1]。据统计,80%以上的细菌感染都与生物被膜的形成有关[2]。生物被膜对细菌有保护作用,使细菌免受抗生素以及宿主防御系统的攻击。持留菌是对抗生素耐受的细胞亚群[3],生物被膜中存在少部分持留菌也会引起抗生素的失效[4]。分泌生物被膜的致病菌对抗生素的耐受性可以提高10~1 000倍,且对宿主免疫防御的抗性也增强数倍[5],致使许多细菌感染难以得到控制,严重威胁食品安全和人类健康。
细菌生物被膜的形成过程是细菌从浮游状态向多细胞聚集的微生物群落状态转变的过程。在营养充足的液体培养基中,细菌以单细胞浮游状态生存;当营养耗尽时,细菌生长进入静止期,鞭毛驱动的运动和趋化力帮助细菌细胞选择最有利的生态位,黏附在基质表面形成生物被膜[6]。细菌最初通过细胞表面结构(如菌毛、鞭毛、卷曲纤维和表面蛋白)黏附到生物或非生物基质表面,移动性减弱进而以表面附着的形式发生细胞分裂,与胞外大分子形成微菌落并最终形成成熟的生物被膜[7]。黏附是生物被膜形成的关键步骤,细菌能同时表达多种黏附素,黏附素聚集在细丝状的菌毛细胞器上。不同黏附素赋予细菌表面不同的特性,以识别不同的生物(组织、细胞等)或非生物基质(玻璃、塑料等)表面。表面附着的细菌微菌落扩展成高度组织的群体结构受多因素影响,涉及细胞间的群体感应、细菌运动性(朝营养丰富的区域移动)以及物质能量代谢(适应多细胞共生方式、产生次级代谢产物)等多种生理代谢活动的改变[8]。
不同细菌形成生物被膜的机制各不相同,通常取决于环境条件和特定的菌株属性[4]。了解细菌在生物被膜状态下特异表达的基因对于揭示细菌在不同环境中生物被膜形成的分子机制至关重要。肠出血性大肠杆菌(enterohemorrhagicEscherichia coli, EHEC)是人畜共患的病原菌,引发出血性结肠炎、溶血性尿毒症和血栓性血小板减少性紫癜等多种疾病[9]。大肠杆菌作为模式生物,虽然已经有很多研究报道了其生物被膜形成的分子机制,大肠杆菌O157∶H7为食源性致病菌,还未对该菌在生物被膜状态下基因特异表达的研究。本研究以大肠杆菌O157∶H7为试验菌株,研究其在生物被膜状态和浮游状态2种条件下基因表达的差异,通过转录组测序(RNA-seq)以及GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes)富集分析,确定生物被膜形成的关键基因和代谢通路,为进一步研究生物被膜形成的分子调控和病原菌生物被膜的防治提供数据基础。
1 材料与方法
1.1 菌种
大肠杆菌(Escherchia coli)O157∶H7(CICC 10907)购自中国工业微生物菌种保藏管理中心。
1.2 菌体培养
将保存在-80 ℃的大肠杆菌O157∶H7于胰酪大豆胨(tryticase soy broth, TSB,海博生物技术有限公司)固体平板上划线,37 ℃培养24 h,挑取单菌落接种于3 mL TSB培养基中培养12 h;再用新鲜的TSB培养基将菌液浓度调至106CFU·mL-1,按1 mL·孔-1加入聚苯乙烯材质的24孔细胞培养板(无锡耐思生命科技股份有限公司,型号702001)中,浮游状态(planktonic, PLA)的菌体于37 ℃、100 r·min-1条件下振荡培养12 h;生物被膜状态(biofilm, BIO)的菌体于37 ℃静置培养24 h。
1.3 大肠杆菌生物被膜的荧光显微镜观察
吖啶橙荧光染料(北京索莱宝科技有限公司)可嵌入双链DNA的双链碱基对,能结合到细菌生物被膜的eDNA上,用于细菌生物被膜的定性定量分析[10]。将培养的菌液加入24孔细胞培养板中,将灭菌的矩形盖玻片(1 cm×1 cm)斜插入24孔板中,大肠杆菌分别在浮游状态和生物被膜形成状态下培养,培养完成后,取出盖玻片,用PBS缓冲液小心清洗,盖玻片上的生物被膜用0.01%吖啶橙溶液染色5 min[11],荧光显微镜(LSM 700,德国蔡司公司)观察2种生长模式下生物被膜的形成。
1.4 RNA-Seq测序分析
1.4.1 样品准备 按1.2的方法培养菌体,菌液经8 000 r·min-1离心10 min后,用无菌PBS缓冲液清洗菌体3遍,立即用液氮速冻,放置-80 ℃冰箱,用于RNA-Seq分析,每组设置3个生物学重复,分别命名为PLA_1、PLA_2、PLA_3和BIO_1、BIO_2、BIO_3。
1.4.2 建库测序 采用天根生化科技有限公司的细菌试剂盒DP 430提取大肠杆菌总RNA,去除Total RNA中的核糖体RNA,获得mRNA。将得到的mRNA随机打断成短片段,采用纽英伦生物技术有限公司的RNA超快速定向文库制备试剂盒——Illumina,按照链特异性建库的方式建库。文库构建完成后,稀释文库至1.5 ng·μL-1,把不同文库按照有效浓度及目标下机数据量的需求pooling后进行Illumina测序。
1.4.3 差异表达基因比较分析 用DESeq 2软件分析在不同条件下转录组的差异表达,找出不同样本间存在的差异表达基因(differentially expressed genes,DEGs),计算log2(FoldChange)及其校正后的统计检验(Padj值)。本研究以|log2(FoldChange)|≥1、Padj≤0.05作为筛选差异表达基因的阈值。
1.4.4 差异表达基因聚类分析 通过聚类分析发现基因或样本间未知的生物学联系和差异。使用R软件包中的Pheatmap软件对差异基因进行聚类分析,确定不同生长模式下大肠杆菌转录本的表达模式。
1.4.5 差异表达基因的GO和KEGG富集分析用Cluster Profiler软件对差异基因集进行GO功能富集分析和KEGG通路富集分析。应用超几何分布计算差异表达基因显著富集的GO功能条目和KEGG通路,均以Padj≤0.05作为显著性富集的阈值。
2 结果与分析
2.1 大肠杆菌O157∶H7在浮游状态和生物被膜状态下的生物被膜形成情况
生物被膜中营养物质的扩散速度较慢,形成了细胞代谢不活跃的细菌群落,与细菌生长静止期的细胞代谢类似[4]。参考Schembri等[8]的研究结果,将浮游状态的大肠杆菌O157∶H7在37 ℃振荡培养12 h,菌体OD600nm为1.3时收集细胞,此时细菌处于生长的静止期;而生物被膜状态的大肠杆菌O157∶H7在37 ℃静置培养,通气量较浮游状态小,生长速率降低,24 h后形成稳定的生物被膜,此时处于生物被膜形成初期。
2种状态下的大肠杆菌O157∶H7经吖啶橙染色后,用荧光显微镜观察(40×),结果如图1所示。浮游状态的大肠杆菌O157∶H7呈单个细菌形态,未观察到胞外生物被膜结构(图1A);静置培养后的大肠杆菌O157∶H7胞外呈现大量不规则结构,形成明显的生物被膜(图1B)。由此可见,在本试验的培养条件下,大肠杆菌在浮游状态下不产生生物被膜,而在静置培养状态下产生大量的生物被膜。

图1 不同状态下的大肠杆菌O157∶H7生物被膜Fig.1 E.coli O157∶H7 biofilm during different growth states
2.2 转录组数据分析
2.2.1 数据质控 由表1可知,样品的GC含量为52.73%~52.94%;将有效数据和参考基因组比对,比对率均达到93.57%以上,且Q20和Q30均大于94%。综上所述,转录组测序质控良好,有效数据质量合格,适合于后续分析。
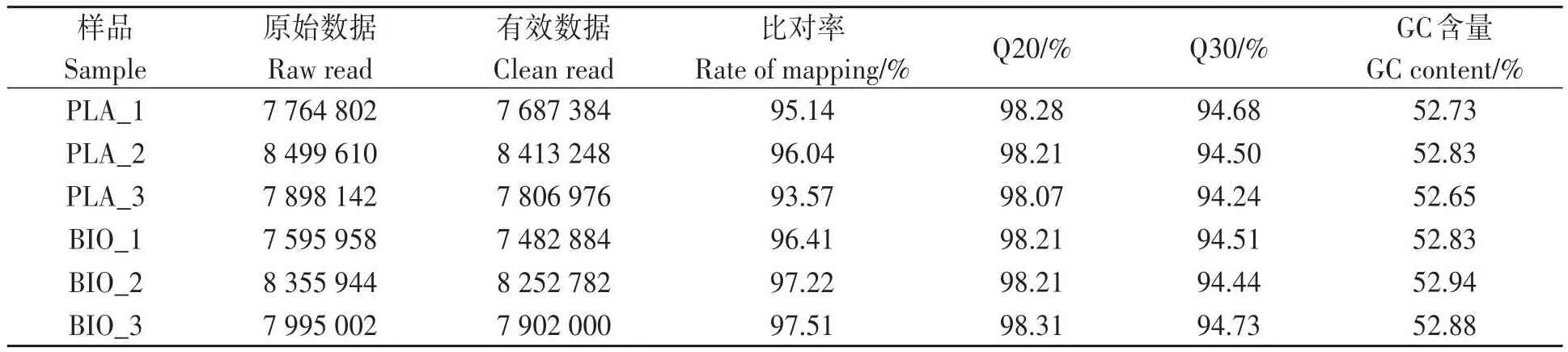
表1 RNA-Seq数据统计Table 1 RNA-Seq data statistics
2.2.2 基因差异表达分析 与浮游状态相比,大肠杆菌O157∶H7在生物被膜形成状态下检测到1 652个显著的差异表达基因(DEGs),3 642个无差异表达的基因。上调表达基因821个,占全基因比例15.51%;下调表达基因831个,占15.70%(图2)。

图2 大肠杆菌O157∶H7在浮游状态和生物被膜形成状态下差异表达基因火山图Fig.2 Volcano map of DEGs in E.coli O157∶H7 during planktonic growth state and biofilm growth state
2.2.3 差异基因的聚类分析 基于显著差异表达基因进行聚类分析,结果(图3)显示,生物被膜形成状态的大肠杆菌聚为一类,浮游状态的大肠杆菌聚为另一类,即不同状态的大肠杆菌差异较大,呈现出2种不同的生长模式;而同一状态下的3个生物学重复间相似性较高。

图3 大肠杆菌O157∶H7在浮游状态和生物被膜形成状态下差异表达基因聚类分析Fig.3 Cluster analysis of DEGs in E.coli O157∶H7 during planktonic growth state and biofilm growth state
2.2.4 GO功能注释及富集分析 为明确大肠杆菌O157∶H7在浮游状态和生物被膜形成状态下差异基因的生物学功能,对显著差异表达基因进行GO功能注释和富集分析,1 652个显著差异基因中有448个被注释到GO功能,其中260个与生物过程(biological process,BP)有关;29个与细胞组成(cellular component,CC)有关;159个与分子功能(molecular function,MF)有关。表2列出了前30个富集的GO功能注释,包括29条BP途径和1条CC途径。大肠杆菌O157∶H7在生物被膜形成状态下富集的GO功能条目涉及细菌运动、物质转运、物质代谢等生物过程,除谷氨酸代谢、硫代谢和多生物过程外,其他GO功能条目中的上调基因数量均高于下调基因数量。移动并黏附至基质表面是大肠杆菌生物被膜形成的初始关键步骤[12],生物被膜状态下,上调的GO途径中与细菌运动相关的有7个,其运动方式以鞭毛驱动为主;生物被膜状态下的细菌与浮游生长的静止期生理状态相似,会产生次级代谢产物[4],但生物被膜状态的细菌还需合成生物被膜的组分,包括胞外多糖、蛋白质、脂类、核酸等物质,因此与单糖及碳水化合物合成和代谢、氨基酸及蛋白质合成和代谢、核酸合成和代谢等途径有关的基因表达上调;合成物质转运至胞外需要膜转运子,因此与膜离子转运过程相关的基因表达上调;细胞的氧化还原途径参与细胞的呼吸作用,其相关基因在生物被膜状态下表达发生变化。本试验还发现,在生物被膜状态下的大肠杆菌O157∶H7硫化合物代谢过程上调,很多研究也发现了这一现象,但具体机制尚不清楚[13]。
2.2.5 KEGG富集分析 利用KEGG数据库对显著差异基因进行代谢通路分析,结果(图4)显示,上调的DEGs共注释到73条通路中,有8条具有显著性差异,包括与细菌运动相关的代谢通路是细菌趋化性(bacterial chemotaxis)和鞭毛装配(flagellar assembly),与细菌氧化还原反应相关的代谢路径是氧化磷酸化(oxidative phosphorylation),与生物大分子合成相关的代谢路径是碳代谢(carbon metabolism)、嘧啶代谢(pyrimidine metabolism)、叶酸及一碳代谢(onecarbon pool by folate)和半胱氨酸及甲硫氨酸代谢(cysteine and methionine metabolism),与生物被膜合成调控相关的是双组分系统(two-component system);表达下调的DEGs共注释到60条通路,有4条具有显著性差异。生物被膜状态下,ABC转运系统(ABC transporters)基因下调,离子型跨膜转运系统基因上调,即细菌的膜转运过程由耗能的ABC转运转变为离子型跨膜转运;赖氨酸降解(lysine degradation)、精氨酸和脯氨酸代谢(arginine and proline metabolism)和不同环境中的微生物代谢(microbial metabolism in diverse environments)相关基因下调,以适应生物被膜状态下的营养及合成生物大分子的需要。

图4 大肠杆菌O157:H7在浮游状态和生物被膜形成状态下差异表达基因KEGG富集分析Fig.4 KEGG enrichment analysis of DEGs in E.coli O157:H7 during planktonic growth state and biofilm growth state
2.2.6 差异表达基因分类及注释 将大肠杆菌在生物被膜形成状态和浮游状态下表达水平发生改变的基因参照KEGG网站进行分类和功能说明,结果如表3所示。

表3 大肠杆菌O157:H7浮游状态和生物被膜形成状态表达水平发生改变的基因Table 3DEGs in E.coli O157:H7during planktonic growth state and biofilmgrowthstate
趋化性是细菌调控并对外界环境做出反应的感受系统之一,细菌利用复杂有序的趋化系统趋向有利条件,增加对环境的适应性。生物被膜形成过程伴随着细菌趋化性的增加。KEGG途径富集的细菌趋化性基因共15个,基因表达水平均为上调,包括趋化受体基因mglB、tar、tap、aer以及趋化信号转导基因cheA、cheR、cheW、cheY、cheB(表3)。趋化反应通过处于细胞两极的受体复合体和随机分布于细胞四周或埋于细胞膜中的鞭毛-马达复合体调节甲基趋化受体蛋白(methylaccepting chemotaxis proteins, MCPs)感知刺激物(或环境)信号,信号通过组氨酸激酶CheA和CheY传递给鞭毛马达。CheA可发生自身磷酸化,并将高能磷酸基团传递给CheA的同源应答调控分子CheY,磷酸化的CheY与鞭毛马达蛋白结合,调节鞭毛的旋转方向。磷酸化的CheA同时调节甲基酯酶CheB的磷酸化,磷酸化的CheB和甲基转移酶CheR分别调节MCPs的去甲基化和甲基化,使细菌适应环境,做出运动改变[14-15]。
具有运动性的细菌可以通过趋化过程感知环境,移向更利于其生长的基质表面,细菌的运动主要由鞭毛驱动。2种状态下,与鞭毛组装有关的差异基因共26个,在生物被膜形成阶段表达水平上调的基因共23个,包括基底蛋白基因(fliA、fliG、fliS)、棒状蛋白基因(flgB、flgC、flgD、flgE、flgF、flgG、flgK、flgL)、丝状帽盖基因(fliD、fliT)、开关基因(motA、motB)和调节基因(motA、flgM、flgN、rpoD、flhC)。生物被膜状态下菌体鞭毛运动性增强,是其趋化作用的结果,磷酸化的CheY能与鞭毛马达相互作用,增加鞭毛旋转方向逆转的频率,导致菌体的翻滚,从而游动方向发生改变[14]。
双组分系统是由组氨酸和天门冬氨酸磷酸化组成的信号系统,是原核细胞中重要的表达调控系统,是细菌感受和应答外界信号的基础,也是调控生物膜主要因素。双组分调控系统中差异表达基因共80个,其中上调表达基因56个,下调表达基因24个。上调基因主要为感应碳源、氮源、磷源及金属离子含量变化的调控基因phoP/phoQ、narP/narQ、glnA/glnL、rcsF、basR、maeA和感应环境因素,如渗透压、蛋白折叠错误的调控基因envZ/ompF、rstB、cpxA等。在生物被膜形成过程中,营养物质缺乏以及环境压力胁迫致使细菌多个感应环境因素的双组分调控蛋白表达上调,这些基因的上调是细菌响应环境压力,从浮游状态转变为生物被膜状态的信号分子。
细胞膜将细胞和亚细胞成分与外界环境隔离开,细胞生存需要特异的分子物质选择性地穿过膜成分。物质穿越细胞膜的运动通过转运体的特化膜蛋白实现。ABC转运体是转运体蛋白中最主要的种类之一,能够通过ATP的结合与水解实现多种底物穿越细胞膜[16]。大肠杆菌O157∶H7在2种生长状态下,ABC转运系统中差异表达基因共62个,其中在生物被膜状态下上调表达基因16个,下调表达基因46个。下调基因编码的转运子包括运输小分子和有机物(ugpE、gpB、ysT、potF、araH)、金属离子和维生素B12(fepD、fhuB)和磷酸和氨基酸(pstS、phnC、artP、gltK)等(表3)。一方面可能是在生物被膜状态下,有机物、金属离子和维生素等物质运输减少;另一方面可能是细胞为了节省能量,下调耗能的ABC转运系统,以适应生物被膜状态下细胞的能量需要。
生物被膜的形成伴随物质代谢途径的改变,处于生物被膜状态下的大肠杆菌O157∶H7在碳代谢、氮代谢、氨基酸代谢、核酸代谢、脂肪酸代谢以及能量产生途径都发生了变化(表3)。在形成生物被膜过程中,菌体由于趋化运动移向基质表面,并以聚集方式生长,分泌胞外多聚物直至成熟生物被膜的形成,每个步骤都涉及物质代谢和能量代谢,细胞内的代谢流也朝着适应多细胞共生方式、产生次级代谢产物如胞外多糖、蛋白质、脂质和核酸等方向转变。
3 讨论
生物被膜使细菌能够有效抵御不良环境及抗菌药物的渗透,并加强细菌内部间的信息交流、代谢交换和基因传递等[17],使细菌耐药性增强[18],但是目前对于生物被膜的形成机理和分子调控机制研究仍不够深入。解析致病菌生物被膜形成的关键基因及调控通路,为防治致病菌生物被膜形成提供了新的思路。
生物被膜内表层菌易于获得营养,代谢活跃;而内层菌缺乏氧气、营养物质,代谢处于休眠状态,因此生物被膜内细菌具有异质性[19]。Schembri等[8]研究表明,浮游细菌在对数生长期、稳定期以及在生物被膜形成初期和后期,基因表达都存在差异,一些基因的表达与特定的生长阶段相关。因此,本研究比较了大肠杆菌O157∶H7处于稳定期的浮游态和处于生物被膜形成初期2个特定阶段的基因表达差异,但整个浮游状态和生物被膜形成状态需进一步研究。
本研究在2种不同状态下的大肠杆菌中共检测到1 652个存在显著差异的表达基因,占全部基因的31.21%,而Schembri等[8]报道大肠杆菌K-12在生物被膜阶段差异表达的基因仅占13.55%,这可能是两者的试验方法和统计方式不同造成。在生物被膜形成初期,很多基因瞬时表达在细菌从浮游状态向生物被膜形成状态发挥作用;而在生物被膜成熟阶段,这些基因的表达水平不再上升,甚至在生物被膜形成后期表达的基因数量少于前期[7]。Whiteley等[20]研究表明,形成生物被膜6 d后的铜绿假单胞菌与浮游细菌态间的差异表达基因约1%。
细菌从浮游状态到固体表面黏附转变通常与细胞表面结构如鞭毛、菌毛、卷曲纤维、胞外多糖和表面蛋白相关[21]。不同株系的大肠杆菌参与生物被膜形成的表面结构不同,调控生物被膜形成的信号分子及信号传导途径可能也存在差别。大肠杆菌K-12表面结构Ag43的编码基因flu在生物被膜阶段表达上调[8]。而本试验未发现flu基因表达水平在大肠杆菌O157∶H7生物被膜中发生变化。Hancock等[22]发现,引起尿路感染的大肠杆菌83972和大肠杆菌VR50在生物被膜形成过程中未检测到flu基因表达变化,但VR50的Ⅰ型菌毛编码基因fimBDFGH下调2.2~9.3倍。细菌趋化性是指有运动能力的细菌对胞外物质含量改变作出的反应,使细菌趋向有益刺激、逃避有害刺激的定向运动[23],主要由鞭毛驱动[24]。趋化性在生物膜的形成过程中发挥重要作用[25-26]。细菌通过趋化作用感知环境中的营养物质,通过鞭毛、菌毛黏附在基质表面,使细菌沿着基质表面生长和定植,最终形成生物被膜。本研究发现,生物被膜状态下细菌趋化性基因和鞭毛组装相关基因的表达水平均上调。
细菌生物被膜形成是个复杂的过程,涉及多种营养物质及环境因子的调控。双组分系统(two-component system, TCS)是细菌感应外界复杂环境,并将其转换为信号分子传递给细胞的信号传导系统[27],是细菌中信号转导的最普遍形式。典型的TCS由位于跨膜区作为传感器的组氨酸蛋白激酶(histidine kinase, HK)和相应的位于细胞质的反应调节蛋白(response regulator, RR)组成,其可以感应外界环境变化,如养分、渗透压等,通过双组分蛋白的磷酸化和去磷酸化调节细胞信号传导途径,从而调控细菌的生理代谢、压力应激等过程[28-29]。研究表明,双组分系统参与生物被膜形成的调控,envZ/ompR识别渗透压变化信号,rscC/rcsD/rcsB激活荚膜异多糖酸的生物合成,cheA/cheY/cheB控制鞭毛运动旋转的方向,qseC/qseB将群体感应与运动、生物被膜发育和毒性联系起来[30]。Schembri等[8]发现大肠杆菌K-12生物被膜状态下群体感应密度信号luxS和全局调控因子rpoS上调。本研究发现,大肠杆菌O157∶H7在生物被膜形成状态下,envZ/ompF和cheA/cheY/cheB基因显著上调,感应营养物质和环境因子变化的多个双组分调控基因表达上调,但与群体感应相关调控因子luxS及全局性调控因子rpoS未发现显著的上调。
细菌的趋化、转运和代谢之间有内在联系[31]。细菌生物被膜的形成伴随着一系列的物质和能量代谢改变。分析大肠杆菌K-12生物被膜和浮游态静止期的基因表达差异,发现氨基酸生物合成、辅因子生物合成、糖代谢、能量代谢、核酸生物合成和代谢、转录修饰和转运蛋白等代谢途径在生物被膜阶段发生变化[8]。本研究发现,生物被膜和浮游态间发生改变的代谢途径主要有碳代谢、氮代谢、核酸代谢、氨基酸代谢、脂肪酸代谢和能量产生等,与前人结果存在差异,这可能是由于所用的材料、培养基及形成生物被膜时黏附的基质不同。黏附基质、生长条件等的差异导致大肠杆菌可能具有不同的生物被膜形成机制。
本研究发现,大肠杆菌O157∶H7在生物被膜形成状态下,其趋化性、双组分系统及物质运输等代谢通路的基因表达发生了显著变化,推测大肠杆菌O157∶H7生物被膜的形成可能与这些途径密切相关。因此,干扰大肠杆菌O157∶H7运动、失活细菌双组分调控蛋白或抑制相关的物质能量代谢,有望成为抑制大肠杆菌O157∶H7生物被膜形成的重要途径。
