辅酶Q10对模拟急进高原环境大鼠的抗疲劳作用及机制
2023-08-01李宝义张猛柏杉杉马骏巩家媛高锋华安华英宁畅文谢瑶路子佳苏允琦闫聪睿刘鹏宇魏汉琪蒋兴伟于群
李宝义,张猛,柏杉杉,马骏,巩家媛,高锋华,安华英,宁畅文,谢瑶,路子佳,苏允琦,5,闫聪睿,刘鹏宇,魏汉琪,6,蒋兴伟,于群
(1.军事科学院军事医学研究院卫生勤务与血液研究所,北京 100850;2.战略支援部队兴城特勤疗养中心,辽宁 兴城 125105;3.中国人民解放军66081部队,河北 张家口 075400;4.北京东方红航天生物技术股份有限公司,北京 100043;5.中国人民解放军31692部队,吉林 吉林 132000;6.中国人民解放军77546部队,西藏 拉萨 850000)
近年来,随着西部开发、军事行动、旅游休假等活动的开展,人们的急性高海拔暴露越来越频繁。相关研究表明,海拔3500 和4500 m 的劳动效率分别比平原地区下降12.61%和18.78%[1]。机体适应高原环境需要数天甚至数周时间,在急进高原环境的早期(几天内)容易发生严重并发症[2]。人员疲劳作业能力下降和急进高原机体的病理生理改变均影响人员正常工作和生活,限制高原活动的顺利开展。
急进高海拔暴露加重低氧血症,机体氧供不足,行动受限;同时,呼吸肌代谢反射调节血液重分配,引起肌肉供血减少[3-4]。神经系统氧分压下降,神经递质转换和突触传递减少,离子通道和离子泵活动减弱,神经肌肉接头传导异常[5-6],这些病理生理改变均可加重作业疲劳。
线粒体呼吸产生ATP 并消耗O2,伴有活性氧(reactive oxide species,ROS)的产生和清除。随着作业强度增加,ROS 产量增加、清除减少。ROS主要通过氧化Na+-K+泵,导致骨骼肌细胞内外Na+和K+浓度失衡,影响细胞膜兴奋性,抑制肌质网Ca2+释放和肌原纤维对Ca2+敏感性,从而导致肌肉疲劳[7]。此外,ROS 激活Ⅳ类肌肉传入神经纤维,并直接抑制运动神经元[8]。文献报道,ROS增加可导致疲劳,用超氧化物歧化酶(superoxide dismutase,SOD)注射预处理离体大鼠胫骨前肌,可降低传入神经兴奋传导频率,进而显著改善疲劳。线粒体氧化磷酸化功能障碍,ROS 产生增加,而ROS 进一步氧化和破坏线粒体膜、电子传输系统和三羧酸酶,并进一步抑制线粒体氧化磷酸化,如此形成恶性循环[9-11]。急进高原72 h 内,机体抗氧化能力明显减弱,氧化应激明显增加,脂质过氧化水平在48 h 达到峰值[12]。急进高原早期的氧化应激加重机体疲劳,影响作用能力。
辅酶Q10(coenzyme Q10,CoQ10)广泛存在于人体各组织器官,其中心、肾和肝等代谢旺盛的组织含量较高;而在细胞器中,主要存在于高尔基体的囊泡、线粒体质膜和溶酶体中[13]。CoQ10作为线粒体靶向小分子物质,其主要作用为通过参与线粒体中的电子传递链促进ATP产生。同时,CoQ10为一种重要的脂溶性抗氧化剂,可保护细胞膜、线粒体和其他细胞器(如高尔基体、溶酶体、内质网和过氧化物酶体)免受自由基诱导的氧化应激损伤。CoQ10除了直接作为抗氧化剂外,还参与抗氧化剂维生素C 和维生素E 的再生[14]。CoQ10 被美国食品药品监督管理局批准作为膳食添加剂应用,具有良好的依从性和耐受性,然而其对急进高原作业能力和疲劳等的影响未见深入研究。本研究通过建立急进高原大鼠模型,评价CoQ10在急进高原条件下的抗疲劳作用,并初步探索其可能机制。
1 材料与方法
1.1 动物
SPF 级雄性Wistar 大鼠,体重200~230 g,北京维通利华有限公司,生产许可证号:SCXK(京)2016-0011。饲养环境湿度40%~60%,温度23~27℃;12 h 昼夜循环(光照时间8∶00~20∶00),自由摄食饮水,饲养过程符合军事科学院军事医学研究院实验动物伦理委员会指导原则。伦理批准编号:IACUC-DWZX-2020-778。
1.2 药物、试剂和主要仪器
CoQ10、羧甲纤维素钠(sodium carboxymethyl cellulose,CMC-Na)和4%组织细胞固定液,北京索莱宝科技有限公司;丙二醛(malondialdehyde,MDA)试剂盒和总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒,南京建成生物工程研究所有限公司;TUNEL 试剂盒,瑞士罗氏公司;DAB 显色剂,武汉赛维尔生物科技有限公司。96孔酶标板,美国Corning 公司;OmegaA15-3677 全自动酶标仪,德国BMGLABTECH 公司;TDL-5M 离心机,四川蜀科公司;特殊军事作业环境模拟设施(简称低压氧舱),贵州风雷航空军械责任有限公司;Vit-ro-950 型血气分析仪,美国强生公司;Vert.A1 型光学显微镜,德国蔡司公司;大鼠游泳池,实验室自制。
1.3 大鼠急进高原模型的建立和分组
Wistar 大鼠分为常压常氧(normal pressure and normoxia,NN)组、低压低氧(hypobaric and hypoxia,HH)组和HH+CoQ10 组,每组12 只。HH+CoQ10 组连续6 d 每日单次ig 给予CoQ10 30 mg·kg-1(用0.5%CMC-Na配制成混悬液),其余2 组以同样方式给予等体积溶剂。给药4 d 后,将HH 和HH+CoQ10 组大鼠移置在低压氧舱中,以5 m·s-1速度上升至模拟海拔6000 m,停留并继续给药2 d;NN组大鼠保持在NN条件下饲养。
1.4 大鼠游泳力竭实验
末次给药1 h后,每组随机取6只大鼠进行游泳力竭实验。实验前称量大鼠体重,将重量为大鼠体重8%的铅块系于大鼠尾部。将大鼠置于水深30 cm、水温27~30℃的水槽中进行力竭游泳实验。以大鼠沉入水下持续≥10 s 判定为力竭。记录大鼠力竭时间。
1.5 大鼠血液样本的制备、血气分析及血清MDA含量和T-SOD 活性检测
末次给药1 h后,将每组其余6只大鼠麻醉后置仰卧位,使用肝素化的1 mL 注射器经腹主动脉取血。部分主动脉血密封,10 min 内用血气分析仪分析动脉血pH、动脉血二氧化碳分压(arterial carbon dioxide pressure,PaCO2)、动脉血氧分压(arterial oxygen partial pressure,PaO2)、动脉血氧饱和度(arterial oxygen saturation,SaO2),及碱剩余(alkali residual,BE)、动脉血碳酸氢根(arterial bicarbonate,HCO3-)、血清钙离子(serum calcium ion,Ca2+)和动脉血乳酸(arterial lactate,Lac)含量。部分主动脉血置离心管中,4℃,450×g离心10 min,取血清,按照试剂盒说明书操作,测定血清中MDA 含量和T-SOD 活性。
1.6 HE染色观察大鼠心、肾、肺和脑组织病理变化
大鼠取血后处死,分别取心尖组织、左肾、左肺和左侧大脑半球,4%多聚甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,制成5 μm 石蜡切片。HE 染色后脱水封片,显微镜下观察心、肺、肾和脑组织病理改变。
1.7 TUNEL法检测大鼠心、肝、肾、肺和脑组织细胞凋亡
将1.6 制备的心、肾、肺和脑组织切片,经乙醇梯度脱水、抗原修复和细胞膜破膜处理,按照试剂盒说明书操作。染色、封片后显微镜下观察,细胞核中有棕黄色颗粒者为阳性细胞,即凋亡细胞。随机选取每组大鼠心、肺、肾和脑组织切片TUNEL 染色,在显微镜下选择6 个200 倍高倍视野,计数凋亡细胞数和总细胞数,细胞凋亡率为凋亡细胞数占总细胞数的百分比。
1.8 统计学分析
实验结果数据用x±s表示,采用SPSS18.0 软件进行统计学分析。HH 游泳力竭时间、NN 中HCO3-,BE,Lac和Ca2+检测结果数据不符合正态分布,组间比较采样Mann-Whitney 秩和检验。其他结果数据符合正态分布,并且方差齐,采用独立样本的t检验。P<0.05为差异有统计学意义。
2 结果
2.1 CoQ10 对模拟急进高原模型大鼠游泳力竭时间的影响
模拟急进6000 m 高原48 h 后,与NN 组大鼠比较,HH 组大鼠游泳力竭时间显著缩短(P<0.01);与HH 组比较,HH+CoQ10 组大鼠游泳力竭时间显著延长(P<0.05)(图1)。提示CoQ10 具有一定抗疲劳作用。

Fig.1 Effect of coenzyme Q10(CoQ10)on exhaustive swimming time in rushing-into-plateau model rats.Wistar rats were randomly divided into three groups:normal pressure and normoxia〔NN,vehicle(0.5% CMC-Na)〕group,hypobaric and hypoxia(HH,vehicle)group,HH+CoQ10 group(CoQ10 30 mg·kg-1). All rats except those in NN group were rushed into a high altitude of 6000 m 4 d after preventive administration.Vehicle and CoQ10 were administrated for another 2 d. x± s,n=6.**P<0.01,compared with NN group;#P<0.05,compared with HH group.
2.2 CoQ10对急进高原模型大鼠血气指标的影响
如表1 所示,模拟急进6000 m 高原48 h 后,与NN 组大鼠比较,HH 组大鼠动脉血pH,PaO2,SaO2和HCO3-含量显著降低(P<0.01),PaCO2,BE,Ca2+和Lac 含量显著升高(P<0.01)。与HH 组大鼠比较,HH+CoQ10 组大鼠动脉血pH 显著升高(P<0.05),PaCO2,Ca2+和Lac 含量显著降低(P<0.05)。提示CoQ10 可改善急进高原环境下大鼠的酸中毒和高CO2血症,降低血清Lac水平。
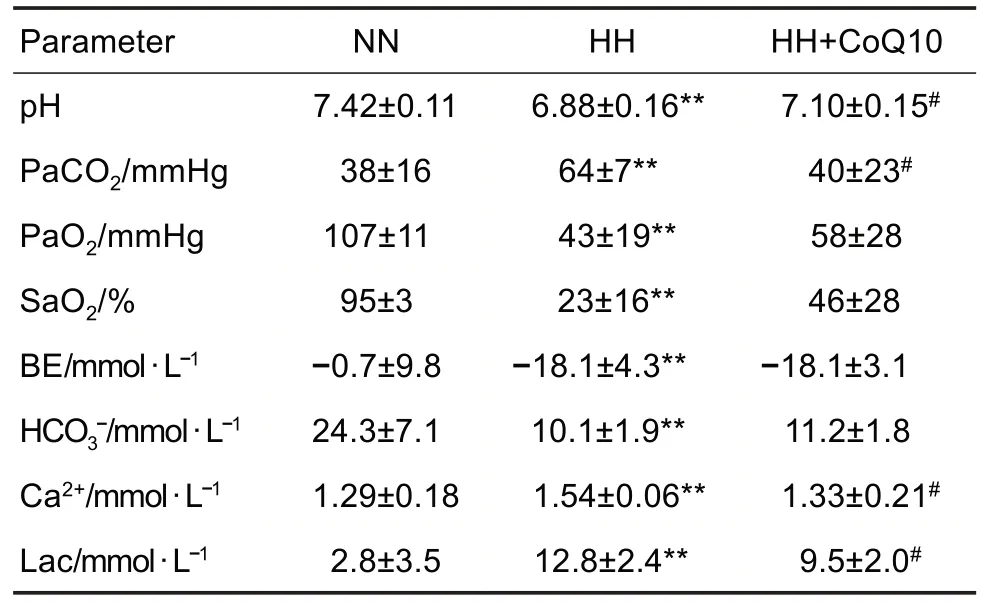
Tab.1 Effect of CoQ10 on arterial blood gas analysis of rushing-into-plateau model rats
2.3 CoQ10 对急进高原模型大鼠心、肺、肾和脑组织病理结构的影响
HE 染色结果显示(图2),NN 组大鼠心肌细胞界限清楚,胞核清晰,胞浆无明显变性坏死;肾小管、肾小球结构正常;肺泡壁菲薄,肺泡隔清晰,囊泡明显;脑组织神经元细胞形态大小如常,核仁大且明显。HH 组大鼠心肌细胞界限清晰,肌纤维有断裂现象;肺泡间隔增宽,肺泡上皮增生,肺泡间充质大量炎症细胞浸润;肾小管上皮细胞水肿明显,肾小球无明显病理改变;大脑神经元水肿,核固缩明显。HH+CoQ10组大鼠在心肌、肾、肺、脑组织存在与HH 组大鼠类似病理改变,程度较轻。提示CoQ10 可改善模拟急进高原环境下大鼠的肺水肿和脑水肿,减轻肾小管上皮细胞肿胀。
2.4 CoQ10 对急进高原模型大鼠心、肺、肾和脑组织细胞凋亡的影响
TUNEL染色结果显示,NN,HH和HH+CoQ10组大鼠心、肺和脑细胞凋亡率(数据略)均未见明显改变(图3)。与NN 组大鼠比较,HH组大鼠肾小管上皮细胞凋亡率显著增加(P<0.01);与HH 组比较,HH+CoQ10组大鼠肾小管上皮细胞凋亡率显著减少(P<0.01)(图4)。提示CoQ10 可改善急进高原环境下大鼠肾小管上皮细胞凋亡。
2.5 CoQ10 对急进高原模型大鼠血清T-SOD 活性和MDA含量的影响
与NN 组大鼠比较,HH 组大鼠血清T-SOD 活性显著降低(P<0.01),MDA含量显著升高(P<0.01);与HH 组比较,HH+CoQ10 组大鼠血清T-SOD 活性显著增高(P<0.05),MDA 含量显著减低(P<0.05)(图5)。提示CoQ10 可改善急进高原环境下大鼠血清氧化应激水平。

Fig.2 Effect of CoQ10 on histopathological changes of heart,lung,kidney and brain of rushing-into-plateau model rats by HE staining. See Fig.1 for the rat treatment.

Fig.3 Effect of CoQ10 on apoptosis of heart,lung and brain of rushing-into-plateau model rats by TUNEL staining.See Fig.1 for the rat treatment.
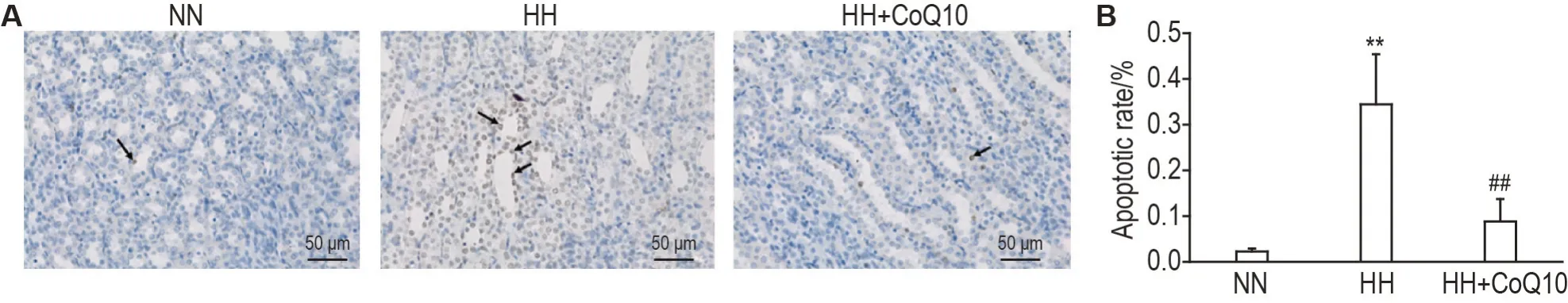
Fig.4 Effect of CoQ10 on apoptosis rates of renal tubular epithelial cells of rushing-into-plateau model rats by TUNEL staining. See Fig.1 for the rat treatment.Arrows indicate apoptotic cells. B:the quantitative result of A.±s,n=6. **P<0.01,compared with NN group;##P<0.01,compared with HH group.

Fig.5 Effect of CoQ10 on total superoxide dismutase(T-SOD)activity(A)and malondialdehyde(MDA)content(B)in serum of rushing-into-plateau model rats. See Fig.1 for the rat treatment.±s,n=6. **P<0.01,compared with NN group;#P<0.05,compared with HH group.
3 讨论
现有模拟高原模型及中国高海拔地区人类生活的海拔高度大致在4000 m 以上。据文献报道,海拔5000~6000 m 暴露24~72 h 可诱发急进高原模型动物组织病理改变[15]。因此,本研究采用高度6000 m 暴露时间48 h,采用低压氧舱模拟高原环境建立急进高原大鼠模型,可快速到达海拔高度,有效减少动物在到达高原运输过程中的习服和其他因素造成的实验偏差。
本研究结果表明,与HH 组大鼠比较,预防性给予CoQ10,大鼠游泳力竭时间明显延长,酸中毒、高CO2血症明显缓解,同时脑、肺、肾组织病理损伤及血清氧化应激明显改善,表明CoQ10可有效缓解急进高原早期的疲劳,改善肺、脑、肾等重要脏器的病理损伤,减轻组织氧化损伤,维持身体健康。
CoQ10作为营养补充剂已经广泛应用,300 mg·d-1已被普遍建议用于人类,并且未观察到毒性作用[16]。本研究旨在研究普遍应用于人体剂量的CoQ10对于模拟高原大鼠的作用,按照人体与大鼠剂量换算(体表面积换算方法)[17],ig给予大鼠每日单次30 mg·kg-1,这也是CoQ10研究的常规剂量之一[18-19]。
本研究大鼠游泳力竭实验发现,大鼠在模拟6000 m 高原暴露48 h 后运动能力显著下降,而给予CoQ10 可明显改善大鼠体能。同时,HH 组大鼠肺泡壁增厚,肺泡上皮增生,大脑神经元细胞水肿,核固缩,呈现出典型的肺水肿和脑水肿的病理改变;给予CoQ10 可改善上述病理改变。文献报道,CoQ10可通过抗炎作用改善脂多糖诱导的肺损伤,给予CoQ10 后血清C 反应蛋白水平降低44.58%,碱性磷酸酶活性降低37.38%,乳酸脱氢酶水平减低48.6%,肺组织病理损伤显著改善[20]。在另一项有关麻醉和非移植轻度肺损伤的研究中还发现,CoQ10 可通过降低肿瘤坏死因子α 表达发挥肺保护作用[21]。上述报道与本研究结果具有一致性。
近年来相关研究表明,肾通过调节体液、电解质和酸碱平衡,在适应环境和高原病综合征(急性高原病、高海拔脑水肿和高海拔肺水肿)中发挥重要作用,并且肾损伤多发生在急进高原的2~4 d[12,22-23]。本研究结果发现,HH 组大鼠肾小管上皮细胞出现明显的水肿和凋亡,细胞凋亡率显著高于NN 和CoQ10 组,表明CoQ10 对急进高原大鼠早期的肾小管损伤具有一定保护作用。
本研究结果表明,HH 组大鼠血清MDA 含量显著升高,T-SOD 活性显著降低;给予CoQ10 可显著降低血清MDA,升高T-SOD 水平。MDA 是氧自由基攻击生物膜中多不饱和脂肪酸引发脂质过氧化而形成的过氧化物,其含量反映机体氧化应激损伤程度[24]。而T-SOD 在机体的氧化还原平衡中起重要作用,可清除超氧阴离子自由基(·O-2),保护细胞免受损伤,T-SOD 活性可间接反映机体清除氧自由基的能力[24]。Goldfarb 等[25]和Thirupathi 等[26]研究均发现,补充抗氧化剂可减轻肌肉损伤,缓解疲劳,提高作业能力。另有研究报道,补充牛磺酸可提高运动能力,减少肌肉损伤[27-28]。但也有研究报道,大量补充外源性抗氧化剂可能干扰肌细胞氧化还原反应信号通路,影响其氧自由基清除能力,而CoQ10作为内源性抗氧化剂,优势更加明显[29]。
综上所述,CoQ10可纠正急进高原肺水肿所致的酸中毒和高CO2血症,改善心、肺、肾和脑组织病理损伤,抑制氧化应激,提高机体在急进高原环境下的抗疲劳能力。
