可注射导电水凝胶聚吡咯-壳聚糖对慢性心肌梗死后心脏功能长期改善
2023-07-31王琦王馨竹姜增誉周景莉何生
王琦 王馨竹 姜增誉 周景莉 何生
1山西医科大学基础医学院(太原 030001);2山西医科大学第一医院影像科(太原 030001);3山西医科大学附属人民医院心内科(太原 030001)
心血管疾病位于人类疾病谱首位,是造成人类死亡的最主要因素[1]。在我国,心血管死亡病例以心肌梗死及其引起的心力衰竭、心律失常为主,并有增加趋势[2]。急性心肌梗死发生后,冠状动脉完全堵塞,血流中断,供血量急剧下降,造成大量心肌细胞死亡[3],取而代之的是导电性较差的瘢痕组织,继而发生慢性阶段的病理性重构[4],变薄和变硬的纤维化心脏组织[5],导致电阻率增加,破坏了心肌电信号,电传播延迟,造成心脏收缩不同步,进一步引起心肌供血不足,最终导致心力衰竭[6]。在慢性心肌梗死中,目前缺乏能够改善组织电阻、促进血管生成和抑制心室重塑的改善患者远期预后有效治疗方法[7-8]。导电水凝胶可通过抑制心室重塑和促进心室再同步收缩[9-10],修复急性心肌梗死后心功能。然而,导电材料对已形成瘢痕的慢性心肌梗死的修复能力及长效性如何尚未可知。
导电生物材料具有导电特性,易于加工[11],能够改善心脏电生理[12],是一种治疗心肌梗死的理想材料[13-15]。聚吡咯(Polypyrrole,PPY)因能提高心肌收缩,它是第一个在生物医学领域得到发展和使用的一种导电聚合物[16]。但是这种导电聚合物因为生物相容性差和机械强度不足的缺点,限制其在生物组织工程中的应用。为了克服这一缺陷,本研究将其与天然材料壳聚糖相结合[17-18],合成了聚吡咯-壳聚糖(Polypyrrole-Chitosan,PPYCHI)可注射导电水凝胶。
笔者已证实了导电水凝胶PPY-CHI 对急性心肌梗死早期促心肌传导及同步化电活动的可行性[9]。本实验拟通过构建大鼠慢性心肌梗死模型验证可注射导电水凝胶PPY-CHI 是否也能长期降低组织电阻、促进心肌电传导和血管生成及抑制心室重塑,以期阐明PPY-CHI 对心肌梗死后的持续修复作用。
1 材料与方法
1.1 材料
1.1.1 实验试剂及仪器主要实验试剂、仪器:98%聚吡咯、低分子壳聚糖、甘油磷酸二钠、25%戊二醛、六水三氯化铁(Sigrma,美国);透析膜(Fisher,加拿大);手术器械(FST,德国);心脏超声仪(Vivid T,美国);荧光倒置显微镜(Ti-U,Nikon,日本)。
1.1.2 实验动物SD 雌性大鼠40 只,SPF 级,6~8 周龄,体质量200~250 g;SD 新生大鼠20 只,SPF级,1~3 d,均购买于山西医科大学实验动物中心。
1.2 实验方法
1.2.1 导电水凝胶PPY-CHI 的制备按照标准化方案[9],合成了导电复合材料PPY-CHI。选取同等浓度的CHI 作为对照材料,调至pH=6 左右待用。向PPY-CHI 和CHI 复合物中加入不同剂量甘油磷酸钠(50%质量浓度)和戊二醛(4%/0.4%质量浓度)形成水凝胶。
1.2.2 导电水凝胶PPY-CHI 的导电率及电压损失测定(1)四探针法:采用四探针电导分析仪,对导电水凝胶PPY-CHI 及CHI 的导电率进行测量,事先制备了尺寸和厚度均为1 mm 的PPY-CHI 和CHI 薄膜,并与4 个探针(探针间距为2.5 mm)密切接触,同一个样品测试3 个不同的区域,根据系统软件计算导电率,比较两者的导电率。(2)电压损失测定:采用微电极阵列对导电水凝胶PPY-CHI和CHI 距离刺激点不同距离处的场电位幅值进行测量,先在水凝胶(水凝胶PPY-CHI 和CHI 的制备如上所述)0 cm 处做上标记,再将电刺激器的正极和负极均放置于距标记0.5 cm 处,初始给予100 mV 的电压值,之后每秒给400 mV。电刺激产生的电反通过ECG 软件进行监测。同理,将正负极记录叉分别移至1.0、1.5、2.0 cm 处,记录每处的电压,每间隔重复测量5 次。
1.2.3 导电水凝胶PPY-CHI 的生物相容性(1)NRVMs 的提取:按照标准化方案,如前所述[10],成功分离出NRVMs 细胞。(2)NRVMs 细胞共培养:将上述分离的NRVMs 按照5 × 105/cm2的密度分别接种于含有Saline、CHI 和PPY-CHI 包被的培养皿中,共同孵育3 d,镜下观察细胞在水凝胶PPY-CHI 及CHI 包被下的生长状态。(3)NRVMs 标记物检测:将上述培养NRVMs 加入4%PFA 固定半小时;0.2%细胞通透液常温下孵育10 min;加入封闭液常温封闭1 h;加入混合后一抗(CX-43;SARC,1∶1 000,Invitrogen),4 ℃下过夜反应;第二天使用稀释后荧光二抗(Alexa Fluor 546,山羊抗兔;Alexa Fluor 488,山羊抗鼠,1∶1 000,Invitrogen),常温下避光反应1 h;随后加入DAPI(1∶1 000,Sigma),常温下避光反应10 min;滴加抗淬灭剂,盖上盖玻片,荧光显微镜观察并摄片。
1.2.4 慢性心肌梗死模型的制作大鼠慢性心肌梗死模型的制作采用前述方法[9,19],对大鼠心室左前降支进行永久结扎,形成心肌梗死模型。对大鼠充分麻醉并插管后,采取右侧30°仰卧位,刮去胸前毛发,定位大鼠左边第一个和第二个乳头之间,碘伏消毒后,铺设洞巾,逐层开胸,暴露心脏,找到左前降支动脉并永久结扎,直到心尖部损伤心肌变白,则造模成功,缝合伤口。
1.2.5 移植导电水凝胶PPY-CHI 治疗心肌梗死心肌梗死造模4 周后,将大鼠随机分为Saline、CHI和PPY-CHI 组,经诱导麻醉、气管插管、对心肌梗死大鼠进行二次胸腔解剖,选择前切口的相邻肋骨之间入路,完全暴露心脏,抽取100 μL 的相对应材料注入梗死区域。苏醒后放入干净笼中长期观察。
1.2.6 治疗前后心脏机械功能评估5%异氟烷麻醉大鼠后,剃掉其胸毛,保持2%麻醉剂浓度,采取左侧位,在M 型超声模式下选取心脏短轴和长轴测量。分别在3 组大鼠的-1、0、4、8、12、26 周进行检测,比较3 组不同时间点的左心室射血分数(LVEF)、左心室缩短分数(LVFS)、左心室舒张末期内径(LVIDS),评估3 组材料在治疗前、后的心功能连续变化情况。
1.2.7 导电水凝胶PPY-CHI 及CHI 对大鼠心肌梗死局部组织电阻变化通过四探针测试仪测量移植导电材料22 周后大鼠心脏组织电阻,首先将4 个电极探针同电阻仪相连,然后插入心脏左心室瘢痕区或边缘区,深度约为1 mm。通过上述方式分别测量导电水凝胶PPY-CHI、CHI 和Saline 各组心肌梗死部位及周边区电阻(n=5),比较其组织电阻高低。
1.2.8 大鼠心脏切片马松染色经包埋脱蜡后,根据PhyEasyTM马松染色试剂盒的步骤进行,A 液对心肌细胞核染色,B 液对心肌细胞胞浆染色,采用分色液分色,再脱水透明处理后封片,通风橱中风干,过夜,镜下摄片。
1.2.9 血管密度免疫荧光染色玻片脱蜡后,使用0.1%Tris-EDTA 行抗原修复;0.2% 细胞通透液常温下孵育10 min;加入封闭液常温封闭1 h;加入一抗(α-SMA,1∶1 000,Invitrogen),于4 ℃过夜反应;第二天加入荧光二抗(Alexa Fluor 488,山羊抗鼠,1∶1 000,Invitrogen),常温避光孵育1 h;随后加入DAPI(1∶1 000,Sigma),常温下避光反应10 min;滴加淬灭剂,盖上盖玻片,镜下观察摄片。
1.3 统计学方法采用GraphPad Prism 9.3 进行数据分析,符合正态分布以()表示,组间比较选择单因素方差分析,两组间以独立样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 心肌梗死模型的制备及PPY-CHI 移植结扎雌性SD 大鼠的左心室前降支,术中可见心尖部位损伤心肌变白(图1A),并将术前、术后超声心动图进行对比,结果发现,与造模前相比,LVEF、LVFS 显著下降,验证了心肌梗死模型的成功制备。并选取心脏功能LVFS 在25%左右的动物随机分为Saline、CHI 和PPY-CHI 组开展后续实验。
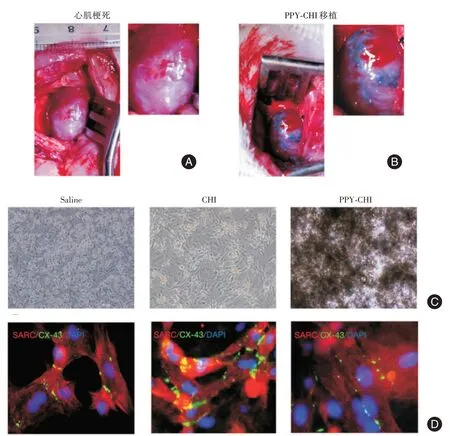
图1 心肌梗死模型的制备及PPY-CHI 移植Fig.1 Preparation of myocardial infarction model and PPY-CHI transplantation
为了测定3组材料是否能与大鼠心肌细胞良好结合,在3组材料植入前分别与NRVMs共培养并通过CX-43 和SARC 进行免疫荧光标记(图1C、1D),NRVMs 在3 组材料包被下生长状况良好且每视野阳性细胞数未见明显差异,为细胞的良好载体。
大鼠继续饲养4 周后,将3 组大鼠分别给予相应的移植治疗,植入PPY-CHI 水凝胶后可见心肌组织间有黑色物质凝集(图1B)。
2.2 治疗前后机械功能的变化情况动物实验及检测指标按照流程进行(图2A)。在心肌梗死发生前(-1 周),心肌梗死发生后(4 周)、治疗后4、8、12 和33 周分别使用超声心动图对不同治疗组的大鼠(移植PPY-CHI 水凝胶组、CHI 水凝胶组和Saline 组)进行心脏功能评估。典型的M 超图像(图2B),心肌梗死后心室腔较梗前有所扩张、心室前壁收缩波逐渐消失;治疗后心室腔的收缩程度不一、心室前壁波形得到一定程度的恢复。

图2 心功能监测Fig.2 Cardiac function monitoring
对各组LVFS、LVEF、LVIDS 进行统计分析,发现治疗后LVFS 和LVEF 逐步增加,LVIDS 逐步降低(图2C)。注射CHI 后4、8、12 和22 周后LVEF和LVFS 均较注射Saline 组有所改善。但PPY-CHI注射后4、8、12 和22 周,LVEF、LVFS 的改善更为显著,LVIDS进一步的降低。可能是由于移植PPYCHI 后心脏扩张的程度减弱,促使心脏同步收缩。
2.3 导电水凝胶PPY-CHI 移植缩小心肌梗死面积采用马松染色,观察导电水凝胶PPY-CHI 移植后对大鼠心室重塑的影响。结果显示,PPY-CHI组的瘢痕面积明显低于CHI 组和Saline 组,在心肌梗死周边区可见心室壁厚度显著增加,且PPYCHI 组显著高于CHI 组,两组又明显高于Saline 组。然而,3 组心脏在其他区域均未观察到这种差异(图3A、3B)。以上数据表明,导电水凝胶PPY-CHI对心肌梗死的修复具有促进作用,能够消除心肌梗死后对心脏重构作用。

图3 导电水凝胶移植22 周后大鼠马松染色Fig.3 Masson's trichrome staining on rats after 22 weeks of conductive hydrogel transplantation
2.4 导电水凝胶PPY-CHI移植促进血管生成为了评估血管生成,用α-SMA 来定量毛细血管密度。PPY-CHI 和CHI 组荧光强度明显高于Saline 组,而PPY-CHI 组又高于CHI 组荧光强度(图4A、4B)。总的来说,与CHI 组相比,PPY-CHI 组毛细血管密度明显增加,表明PPY-CHI 组的血管生成能力较强。以上结果说明PPY-CHI 通过改善局部血供,促进心肌梗死后血管生成。
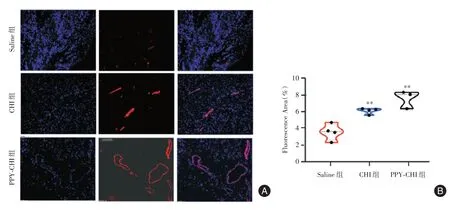
图4 导电材料移植22 周后毛细血管密度荧光图Fig.4 luorescence map of capillary density and arteriole density after 22 weeks of conductive material transplantation
2.5 导电水凝胶PPY-CHI 移植对大鼠心肌梗死局部组织电阻变化在体外实验中,采用四探针法多点检测PPY-CHI 和CHI 两组材料的导电率,结果证实PPY-CHI 水凝胶的导电性明显高于单独使用CHI 的导电性(图5A);采用微电极陈列法测量距电极0.5、1、1.5、2 cm 处的场电位幅值,比较相同电压刺激后不同距离电位损失情况(表1 和图5B),PPY-CHI 水凝胶相较于CHI 水凝胶具有更高的场电位,表明电信号在不同距离下PPY-CHI传导衰减低于CHI。通过四探针法和等距离电压损失幅度测量发现,PPY-CHI 水凝胶不管是在电导率还是在场电位幅值的测量,其性能均优于单独使用CHI 水凝胶。由此证明PPY-CHI 的导电性更加优越。
表1 导电材料水凝胶PPY-CHI 和CHI 场电位幅值对比表Tab.1 Comparison table of potential amplitudes of PPY-CHI and CHI fields in hydrogels of conductive materials ±s
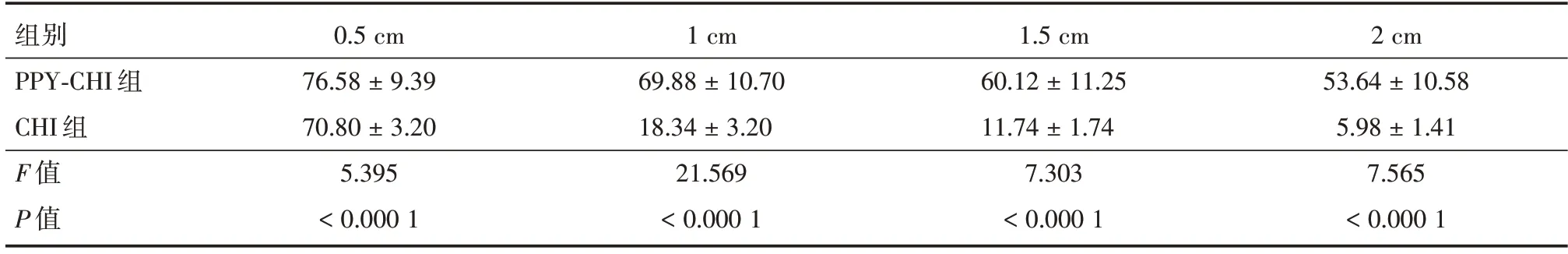
表1 导电材料水凝胶PPY-CHI 和CHI 场电位幅值对比表Tab.1 Comparison table of potential amplitudes of PPY-CHI and CHI fields in hydrogels of conductive materials ±s
组别PPY-CHI 组CHI 组F 值P 值0.5 cm 76.58±9.39 70.80±3.20 5.395<0.000 1 1 cm 69.88±10.70 18.34±3.20 21.569<0.000 1 1.5 cm 60.12±11.25 11.74±1.74 7.303<0.000 1 2 cm 53.64±10.58 5.98±1.41 7.565<0.000 1
为了验证PPY-CHI 在大鼠心肌梗死局部的导电性,移植导电材料22 周后,通过四探针测试仪测量了纤维瘢痕区域及周边区域组织电阻(图5C)。测量过程分别测量各组心肌梗死部位及边缘区电阻(图5B)。比较3 组组织电阻(图5D),发现注射导电水凝胶PPY-CHI 组的组织电阻要小于注射导电水凝胶CHI 组的电阻和Saline 组,差异有统计学意义(P<0.05),证明导电水凝胶PPY-CHI 降低了局部组织电阻、增加了组织的导电性。
3 讨论
尽管导电生物材料在治疗急性心肌梗死方面显示了较好的疗效[20-21],但其对慢性心肌梗死的疗效仍未可知。前期侧重于对大鼠急性心肌梗死后电传导及血管生成进行了探究,但对于抑制心室重塑尚未说明,且治疗时间均在3 个月内的急性心肌梗死,对于梗死后3 个月以后或者慢性心肌梗死患者PPY-CHI 是否仍有效果,以及对心室重塑是否有积极作用,是本实验预探究的问题。
本研究在SD 大鼠心肌梗死造模4 周后在心肌梗死局部注入导电水凝胶PPY-CHI 治疗,结果显示在移植PPY-CHI 4 周后即表现出明显改善左室心功能的作用(与梗后4 周相比),LVEF、LVFS 明显升高,LVIDS 明显降低,这种作用一直持续到在体实验结束,与HE 等[9]的研究结果一致。而这种持续的改善作用不能用降低组织电阻,促进同步心脏收缩完全解释。随着对导电材料作用的深入研究,它改善左室心功能的机制还包括改善心肌细胞存活微环境、抑制心肌梗死局部炎症反应、促进新生血管生成,抑制心室重构等[8-10,22]。本实验重点关注了导电材料移植促进血管生成、抑制心室重构和降低组织电阻的作用。首先,通过α-SMA荧光染色检测毛细血管密度,发现PPY-CHI 治疗组的荧光强度远高于CHI 组和Saline 组,这可能是由于PPY-CHI 能够改善局部血供,增加血管密度,抑制细胞凋亡,从而改善心功能。其次,对其心脏组织进行了马松染色,结果分析显示,与单独使用Saline 组和CHI 组比较,PPY-CHI 组的瘢痕大小明显低于其他两组,且在心肌梗死周边区心室壁厚度显著增加,这可能是由于PPY-CHI 通过增加纤维组织的强度,以防异常心室重塑来进行心脏修复。最后,对其心肌梗死局部组织电导率进行了分析,相较于CHI 单独注射而言,注射PPY-CHI 在心脏瘢痕区域具有更低的电阻和更快的传导速度,这可能是由于其PPY-CHI 增加了心肌内的电信号传播,促进瘢痕区域内心肌细胞的同步收缩,从而降低纤维化瘢痕抵抗率来维持心脏功能并改善电传导。
PPY 因易于表面修饰,能够支持细胞黏附和增殖而被用于心肌修复[10,23-24]。然而由于PPY 具有较差的力学性能而难以用于支架制造[25],将它们与其他聚合物混合已被成功证实可以增强其材料特性,用于MI 的治疗[9-10,13,21]。早期研究表明,PPY 与海藻酸盐的混合物注入大鼠梗死区可诱导动脉生成,但注射5 周后实验组的梗死面积无显著差异,这可能归因于PPY 的导电性[26]。沿着这一思路,MIHIC 等[22]将PPY 与CHI 混合物应用于心肌梗死的治疗,8 周后生物材料处理的心脏瘢痕大小显著减小。在电生理研究中,PPY-CHI 也显示出较强的导电性,在冷冻损伤后7 d 的大鼠心肌损伤区域植入PPY-CHI,增强了梗死组织的电信号传播,并在注射后4 周改善了心功能,而未引起心律失常[10]。这些发现也得到了HE 等[9]的支持,他们在心肌梗死后7 d,将PPY-CHI 注入梗死心肌,可观察到,在植入材料后12 周,LVFS 较梗后增加了10%,组织电阻显著降低,促进了心脏再同步收缩,增强心功能,而不引起心律失常。本实验中,在大鼠心肌梗死造模后4 周将PPY-CHI 导电水凝胶植入,22 周后其LVFS 较梗前增加了(10.6 ±0.55)%,组织电阻较Saline组降低(14.28±7.59)%,毛细血管密度较Saline 组增加(4.06 ± 1.75)%,左心室壁厚度较Saline 组增加(1.17±0.04)cm。本研究结果与之前的研究结果一致[9],即在活体动物研究中,PPY-CHI 对心功能的改善作用从第12 周持续到第22 周。
本次研究仅对体内心肌梗死的长期修复机制作了较多探索,但较少涉及与之对应的体外细胞实验。所以还需要大量的体外实验进一步验证本次研究结果,以期为临床防治慢性心肌梗死提供科学依据。
综上所述,证实PPY-CHI 可持续促进血管生成和心室重塑,使组织电阻率降低,增强瘢痕区域的导电能力,降低心律失常的发生率,让心脏再同步收缩,最终改善心功能,为慢性心肌梗死的治疗提供了新的策略。
