H9N2亚型流感病毒感染过程中神经介素B及受体对NF-κB信号通路泛素酶的调控
2023-07-31田世茂万乾晖许晓东孔迎迎唐钰冰陈吉龙杨桂红
田世茂,万乾晖,许晓东,孔迎迎,田 珂,唐钰冰,陈吉龙,杨桂红
(福建农林大学动物科学学院(蜂学学院)闽台动物病原生物学重点实验室,福州 350002)
甲型流感病毒(influenza A virus,IAV)属于正黏病毒科流感病毒属的单股负链RNA病毒,其基因组含8个RNA片段,这些片段编码至少10种蛋白,其具体数量取决于病毒毒株[1-4]。IAV基因组的分节段性使其在传播过程中易发生基因重组或突变导致疫苗的免疫失效[5],从而为兽医临床防控该病毒带来困难。IAV根据其表面HA和NA抗原不同,分为许多亚型,截止到现在,已鉴定出HA有18种亚型,NA有11种亚型[6-9],其中,H9N2亚型在家禽中分布最广泛,并为多种禽流感亚型提供基因片段[10-11],具有重要的公共卫生意义。因此,本研究使用H9N2毒株感染宿主细胞,以宿主免疫因子NMB/NMBR为突破口,通过分析宿主NMB/NMBR先天性抗IAV/H9N2感染机制以期寻找更有效的新型抗病毒途径。
神经介素B(neuromedin B,NMB)是一种含有32个氨基酸的生物活性肽,可与其受体神经介素B(NMBR)结合发挥多种生理功能[12]。本课题组前期研究发现,NMB/NMBR可以通过NF-κB信号通路参与抗IAV/H1N1的先天性免疫反应[13-14]。但关于NMB/NMBR是如何介导IAV/H1N1感染诱导的NF-κB信号通路尚不明确。研究表明:IAV/H9N2感染后可刺激宿主产生免疫应答[15-16],NF-κB信号通路作为先天免疫系统的重要一环被激活[17]。NF-κB信号通路激活过程中泛素化修饰发挥关键作用。病毒、白介素等刺激因素通过活化IκB激酶(IKK)激活下游抑制蛋白IκB释放NF-κB蛋白。IKK复合体包括IKKα、IKKβ和NEMO[18-19]。NEMO蛋白的泛素化修饰是激活NF-κB信号通路的关键过程,NEMO被泛素化后促进IKK复合物的招募和活化[20-22]。IKK复合物是激活NF-κB的守门员,受到很多泛素蛋白酶调节[23],如:E3泛素连接酶RNF8泛素化修饰IKKα和IKKβ导致NF-κB激活过程被抑制[24];去泛素化酶CYLD通过去除NEMO的泛素化负调控NF-κB信号通路;E3泛素连接酶MIB2则泛素化CYLD使其降解从而激活NF-κB信号通路[25]等。这些作用于IKK复合物节点的泛素蛋白酶对NF-κB信号通路的激活至关重要。本研究利用sh-NMBR细胞与NMB刺激的A549细胞,采用RT-PCR、qRT-PCR及Western blot技术探究NMB/NMBR如何调控IKK复合物节点的泛素蛋白酶从而影响IAV/H9N2感染诱导的NF-κB信号通路。该研究结果有助于理解NMB/NMBR对NF-κB信号通路的调节作用以及其参与发挥先天性抗流感病毒的免疫应答反应。
1 材料与方法
1.1 材料
1.1.1 细胞与病毒 人肺腺癌细胞(A549细胞)、人胚肾细胞(HEK293T细胞)购自美国ATCC细胞库。H9N2(禽流感病毒H9N2)毒株为本实验室分离、鉴定后保存。
1.1.2 质粒 pLP(pVSV-G)、pLP1、pLP2、pSIH-HI-GFP质粒均由本实验室保存。本课题组前期利用pSIH-HI-GFP载体构建重组sh-NMBR质粒,并保存于本实验室。NMBR干扰细胞系(sh-NMBR细胞)构建试验中使用sh-luciferase质粒构建对照组细胞(sh-luciferase细胞)。
1.1.3 引物序列 引物序列的合成由上海生工公司完成,具体序列信息见表1。

表1 RT-PCR和qRT-PCR引物Table 1 All primers used for RT-PCR and qRT-PCR
1.1.4 多肽合成 本研究中使用的多肽由中国杭州专肽生物技术有限公司合成,合成的多肽使用PBS溶解为100 μmol·L-1的浓度,分装保存在-80 ℃备用。NMB氨基酸序列:Ala-Pro-Leu-Ser-Trp-Asp-Leu-Pro-Glu-Pro-Arg-Ser-Arg-Ala-Gly-Lys-Ile-Arg-Val-His-Pro-Arg-Gly-Asn-Leu-Trp-Ala-Thr-Gly-His-Phe-Met-NH2。
1.1.5 主要试剂 琼脂粉、酵母提取物、蛋白胨购自Oxoid公司。胎牛血清购自Gibco公司。转染试剂Lipo8000购自上海碧云天生物技术有限公司。DNA纯化回收试剂盒、质粒小提试剂盒购自Tiangen公司。NucleoZol RNA 提取试剂购自上海基因生物技术国际贸易有限公司。RNA反转录cDNA试剂盒购自上海近岸科技有限公司。NC膜购自Millipore公司。tECL化学发光显色液购自苏州新赛美生物科技公司。Anti-NMBR(货号:ab134141)购自Abcam公司。Anti-P65(货号:8242)、Anti-p-P65(货号:3033)购自Cell Signaling Technology公司。兔抗鼠、鼠抗兔IgG二抗购自Jackson Immunoresearch公司。
1.2 方法
1.2.1 细胞复苏 将液氮冻存的细胞放入37 ℃水浴锅内快速摇晃直至解冻;转移至含有2 mL完全培养基的15 mL灭菌离心管,吹打混匀,800 r·min-1离心5 min;弃上清;继续加入1 mL完全培养基重悬细胞沉淀;转移到含有7 mL完全培养基的培养皿中轻轻摇匀,置于37 ℃, 5% CO2培养箱中培养。
1.2.2 sh-NMBR细胞系的构建 将HEK 293T细胞铺于100 mm培养皿,待细胞生长到70%~80%时进行转染;转染体系分为对照组:750 μL转染液+24 μL Lipo8000转染试剂+8 μg sh-Luciferase质粒+8 μg包装质粒:pLP(pVSV-G)、pLP1和pLP2;试验组:750 μL转染液+24 μL Lipo8000转染试剂+8 μg sh-NMBR重组质粒+8 μg包装质粒;将上述混合液沿皿壁加到已更换新鲜培养基的HEK 293T细胞培养皿中并摇匀,放入置于37 ℃, 5% CO2培养箱中培养;转染48 h后收集上清,将上清液经0.22 μm孔径滤膜过滤;用过滤后的转染上清液重悬提前消化于15 mL离心管的A549细胞,均匀地铺在6孔板中,避光滴加与细胞悬液1∶1 000比例的polybrene,使用水平离心机悬浮感染120 min(2 100 r·min-1,32 ℃);细胞悬浮感染结束后,补加500 μL完全培养基,37 ℃,5% CO2,继续培养24 h后可进行细胞传代。使用倒置荧光显微镜(Nikon Ti-E)观察细胞荧光,观察转染效率,再用RT-PCR或Western blot检测目的基因的干扰效果,最终可获得具有稳定干扰NMBR基因表达的细胞系(sh-NMBR细胞)。
1.2.3 病毒感染 A549细胞或sh-NMBR细胞生长到80%后,弃完全培养基(使用NMB刺激时,需提前12 h加入100 nmol·L-1的NMB),PBS清洗两次,加入1 mL维持液(基础培养基+双抗+2 mL胰酶);每孔加入适量病毒后置于培养箱吸附1 h,每15 min摇一次;吸附1 h后,弃维持液,PBS清洗两次,加入2 mL新鲜的维持液,放入37 ℃,5% CO2培养箱中,在攻毒后0、6和12 h收样。
1.2.4 RT-PCR和qRT-PCR 使用NucleoZol提取细胞RNA,按照反转录试剂盒说明书反转录成cDNA。使用NCBI数据库在线引物设计工具Primer-BLAST设计引物,具体引物序列见表1。
RT-PCR反应条件:95 ℃ 5 min; 95 ℃ 30 s, 55~60 ℃ 30 s, 72 ℃ 30 s,共20~35个循环;72 ℃ 5 min。反应结束后,取10 μL PCR扩增产物经1.5%琼脂糖凝胶电泳分析目的条带。
qRT-PCR反应条件:94 ℃ 30 s; 94 ℃ 5 s, 62 ℃ 15 s, 72 ℃ 10 s, 共40个循环;72 ℃ 30 s;反应结束后以GAPDH作为内参,3次重复数据取均值进行统计分析。
1.2.5 Western blot 提取细胞样品蛋白,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后转移到硝酸纤维素(NC)膜上;将NC膜置于5%牛奶中封闭2 h, 1×TBS中漂洗干净,一抗孵育2~3 h (Anti-NMBR购自Abcam公司,货号:ab134141;Anti-P65购自Cell Signaling Technology公司,货号:8242;Anti-Phospho-p65(pP65) 购自Cell Signaling Technology公司,货号:3033; Anti-GAPDH购自TransGen biotech公司,货号:HC301-01; Anti-NP 由本实验室制备并保存),孵育结束后,用1×TBS漂洗30 min,每10 min换一次新的TBS;再用二抗孵育2 h(鼠抗兔IgG购自Jackson ImmnoResearch 公司,货号:211-005-109),1×TBS漂洗30 min,每10 min换1次TBS,将条带置于tECL化学发光液(苏州新赛美生物科技公司)后放入化学发光仪(Tanon 5200)曝光。
1.2.6 统计学分析 以上相关试验均进行3次以上独立重复试验,运用T检验进行统计分析差异显著性。其中,*.P<0.05表示有差异;**.P<0.01表示差异显著;***.P<0.001;****.P<0.000 1表示差异极显著。
2 结 果
2.1 干扰NMBR后促进流感病毒H9N2亚型NP蛋白的表达
为明确NMBR对甲型流感病毒感染的调节作用,本试验用IAV/H9N2亚型感染sh-NMBR细胞,收集0、6和12 h的RNA样品和蛋白样品,分别采用RT-PCR、qRT-PCR和Western blot分析细胞中NMBR和NP的表达变化(图1)。
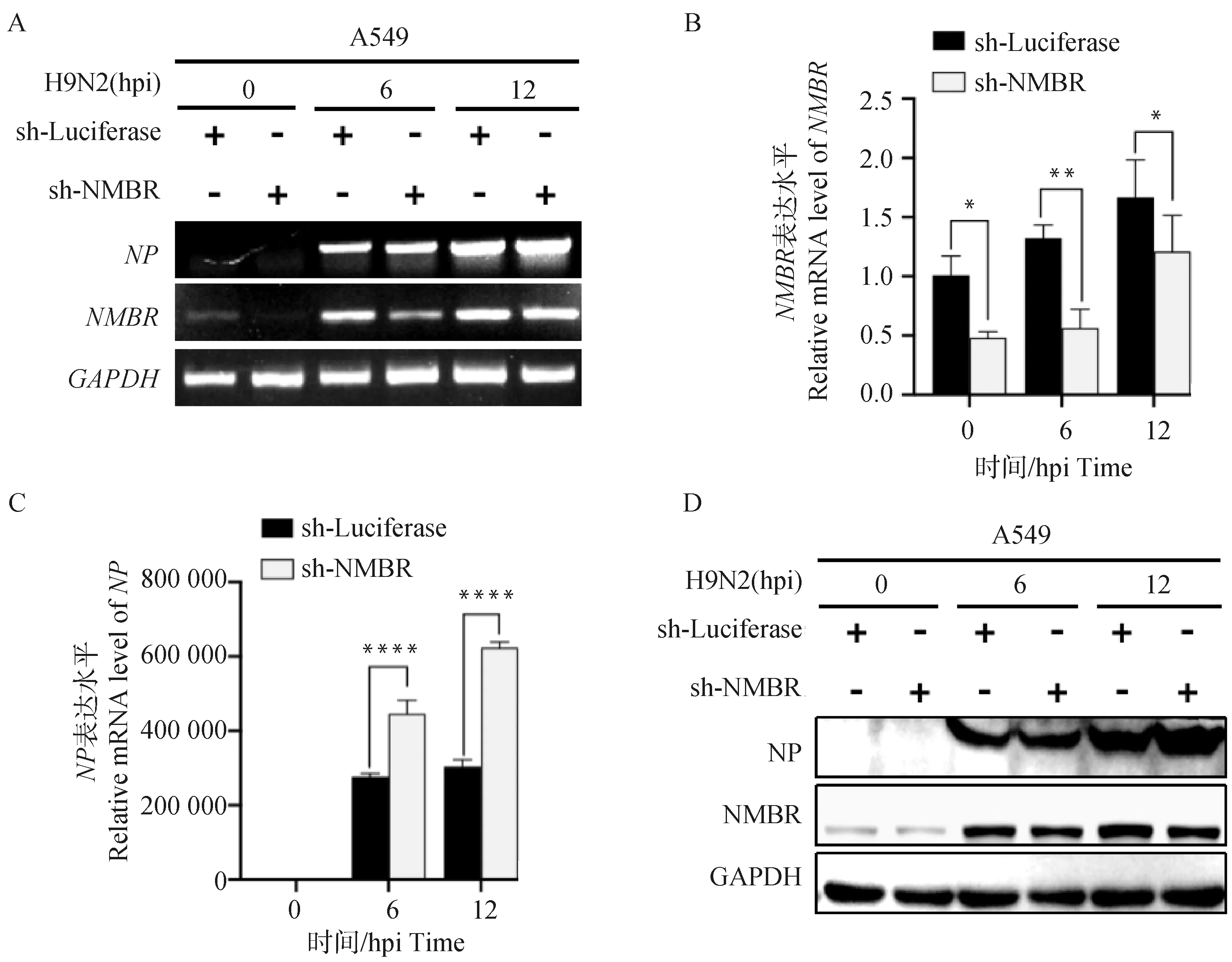
A. RT-PCR分析IAV/H9N2感染的sh-NMBR细胞中的NMBR和NP转录水平的表达变化;B和C. qRT-PCR分析各组NMBR和NP表达;D.Western blot分析各组NMBR和NP蛋白的表达水平;*. P<0.05;**.P<0.01; ****. P<0.000 1A. RT-PCR analyzed the transcript levels of NMBR and NP in sh-NMBR cells after IAV/H9N2 infection; B and C. qRT-PCR analyzed the expression levels of NMBR and NP in sh-NMBR cells after IAV/H9N2 infection; D. Western blot analyzed the expression levels of NMBR and NP in sh-NMBR cells after IAV/H9N2 infection; *. P<0.05;**.P<0.01; ****. P<0.000 1图1 分析IAV/H9N2感染的各组sh-NMBR细胞中NMBR和NP的表达变化Fig.1 Analysis the expression levels of NMBR and NP in sh-NMBR cells after IAV/H9N2 infection
如图1所示:与各时间点的对照组细胞相比,H9N2感染sh-NMBR细胞诱导NMBR的表达水平下降(6 h,P<0.01;12 h,P<0.05)和NP(6、12 h,P<0.000 1)的表达水平上升;同时,H9N2感染sh-NMBR细胞诱导6和12 h的NMBR蛋白和NP蛋白表达水平呈现出与转录水平相同的趋势。以上结果表明,NMBR可调节IAV/H9N2 亚型NP的表达。
2.2 NMBR对IAV/H9N2感染诱导的NF-κB信号通路中泛素蛋白酶的变化
收集IAV/H9N2感染的sh-NMBR细胞0、6和12 h的样品,分别采用RT-PCR、qRT-PCR和Western blot分析与NF-κB信号通路相关的RNF8、CYLD、MIB2和P65磷酸化水平的变化。如图2所示:与对照组相比,IAV/H9N2感染的sh-NMBR细胞中RNF8(6 h,P<0.05;12 h,P<0.001)和CYLD(6 h,P<0.000 1;12 h,P<0.01)转录水平上升,MIB2(6 h,P<0.000 1;12 h,P<0.000 1)转录水平下降,P65磷酸化水平下降。以上结果表明,NMBR通过调控RNF8、CYLD和MIB2的表达而影响P65蛋白的活性,暗示了NMBR对IAV/H9N2感染诱导的NF-κB信号通路的调节作用。
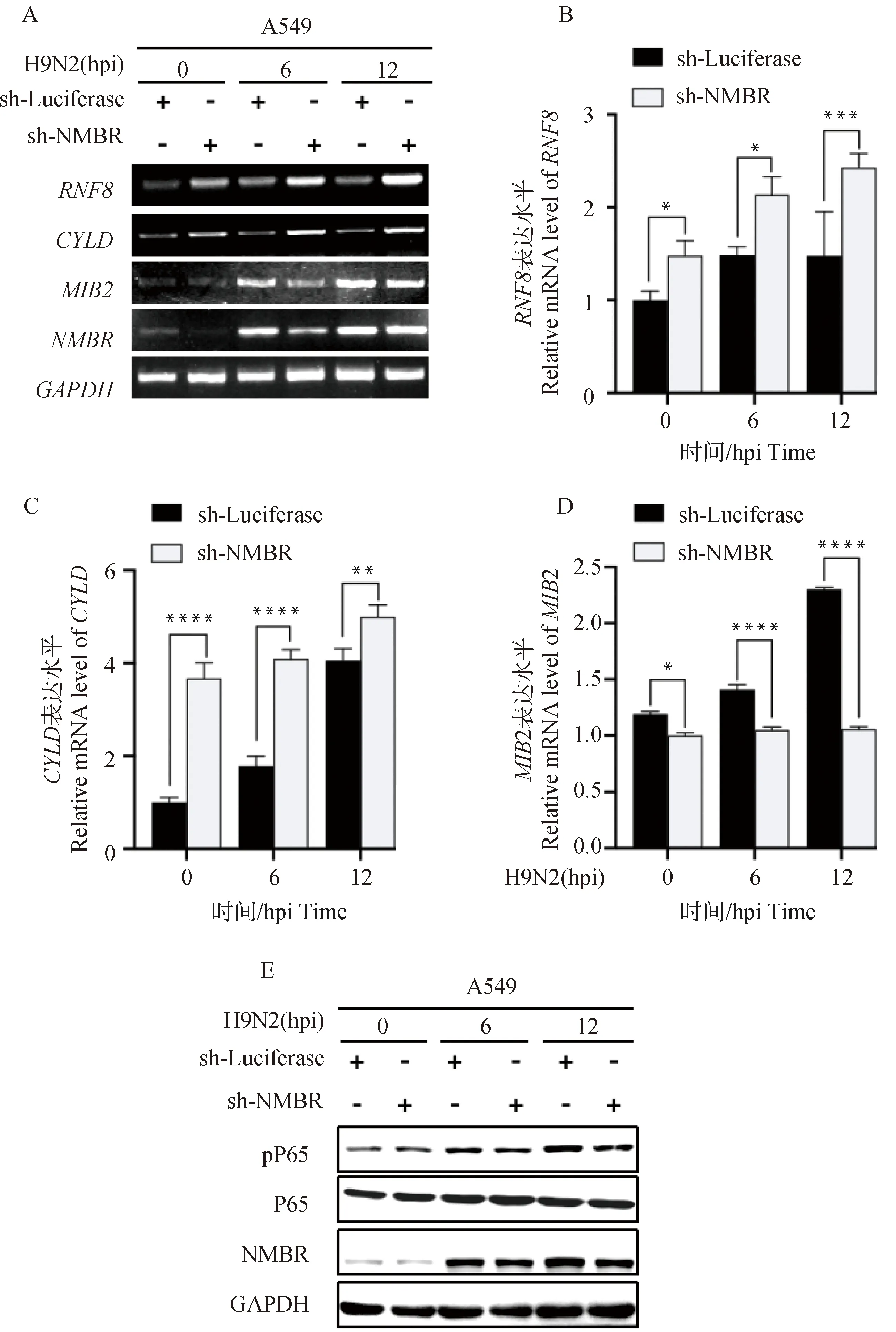
A. RT-PCR分析感染IAV/H9N2的NMBR干扰细胞中RNF8、CYLD和MIB2转录水平的变化;B~D. qPCR分析感染IAV/H9N2的NMBR干扰细胞中RNF8、CYLD和MIB2的转录水平表达量;E. Western blot分析感染IAV/H9N2的NMBR干扰细胞中P65磷酸化水平;*. P<0.05;**.P<0.01; ***. P<0.001;****. P<0.000 1A. RT-PCR analyzed the transcript levels of RNF8, CYLD and MIB2 in sh-NMBR cells after IAV/H9N2 infection;B-D. qRT-PCR analyzed the transcript levels of RNF8, CYLD and MIB2 in sh-NMBR cells after IAV/H9N2 infection; E. Western blot analysis of the expression levels of P65 phosphorylation in sh-NMBR cells after IAV/H9N2 infection; *. P<0.05; **.P<0.01; ***. P<0.001; ****. P<0.000 1图2 分析IAV/H9N2感染的各组sh-NMBR细胞中NF-κB信号通路上相关的泛素蛋白酶与P65磷酸化水平的表达变化Fig.2 Analysis the levels of the ubiquitination ligases and P65 phosphorylation related with NF-κB signaling pathway in sh-NMBR cells after IAV/H9N2 infection
2.3 NMB对IAV/H9N2感染A549细胞中NF-κB信号通路相关的泛素蛋白酶的表达的影响
为进一步确认NMBR对NF-κB信号通路密切相关的泛素蛋白酶(RNF8、CYLD和MIB2)的表达影响,本研究选用外源合成的NMB(100 nmol·L-1)作为A549细胞中NMBR表达的激活剂,分别采用RT-PCR、qRT-PCR以及Western blot分析IAV/H9N2感染诱导的RNF8、CYLD、MIB2和P65磷酸化水平的表达变化。如图3所示:与对照组相比,NMB成功刺激NMBR表达后可明显促进IAV/H9N2感染的细胞中RNF8(P<0.05)和CYLD(P<0.01)转录水平的下调,MIB2转录水平(P<0.05)和P65磷酸化水平的上调。以上结果表明,外源性NMB刺激细胞中NMBR表达后通过调控RNF8、CYLD和MIB2的表达而影响P65蛋白的活性,暗示NMB可通过NMBR参与调节IAV/H9N2感染诱导的NF-κB信号通路的活性。

A. RT-PCR分析NMB处理与感染IAV/H9N2后各组RNF8、CYLD和MIB2转录水平的变化;B~D. qPCR分析各组RNF8、CYLD和MIB2的转录水平表达量;E. Western blot分析各组P65磷酸化水平; ns. P>0.05; *. P<0.05;**.P<0.01A. RT-PCR analyzed the transnational levels of RNF8, CYLD and MIB2 in NMB treating A549 cells after IAV/H9N2 infection;B-D. qRT-PCR analyzed the transnational levels of RNF8, CYLD and MIB2 in NMB treating A549 cells after IAV/H9N2 infection; E. Western blot analysis of the expression levels of P65 phosphorylation in NMB treating A549 cells after IAV/H9N2 infection; ns. P>0.05; *. P<0.05; **.P<0.01图3 分析IAV/H9N2感染的各组NMB处理A549细胞中NF-κB信号通路相关的泛素蛋白酶与P65磷酸化水平的表达变化Fig.3 Analysis the levels of the ubiquitination ligases and P65 phosphorylation related with NF-κB signaling pathway in NMB treating A549 cells after IAV/H9N2 infection
3 讨 论
本课题组前期研究表明,NMB/NMBR通过调控宿主的IL-6和IFN-α基因发挥抗H1N1/PR8感染的作用[13],并已证明IAV/H1N1感染诱导的NMB和NMBR可通过NF-κB信号通路参与机体发挥抗IAV感染的先天性免疫应答反应[14],但NMBR调控甲型流感病毒感染激活的NF-κB信号通路的作用机制尚不明确。NF-κB信号通路是病毒感染激活机体发挥先天免疫应答反应的重要信号通路[26-27],而泛素化修饰在NF-κB信号通路的激活过程中发挥至关重要的作用[28]。NF-κB蛋白由p65和p50构成同源/异源二聚体,未激活时NF-κB二聚体被结合在抑制IκB蛋白,这种结合使NF-κB信号通路的活性被抑制[29]。研究表明,病毒和白介素等刺激因素通过IKK复合物活化IκB蛋白,磷酸化的IκB蛋白进而被泛素化修饰后降解,释放出有活性的NF-κB蛋白[18],进入细胞核启动转录进程。IKK复合物包括3个重要的成员:两个激活酶活性催化蛋白IKKα、IKKβ和调控蛋白NEMO[30]。IKK被激活后NEMO发生泛素化,促进IKK复合物的招募和活化,而IKK活化后就会刺激IκBα被泛素化修饰降解,释放NF-κB二聚体,激活NF-κB信号通路[18,31]。因此,IKK复合物是NF-κB信号通路上的重要节点,针对该节点的泛素化修饰值得深入研究。E3泛素连接酶RNF8已被证明可以特异性地泛素化IKK亚基IKKα和IKKβ,抑制其激活下游分子的能力,从而抑制NF-κB信号通路[24]。泛素化是一种可逆反应,可通过去泛素化酶(DUB)解除泛素化修饰,CYLD可以解除NEMO的泛素化,负调节NF-κB信号通路,然而E3泛素连接酶MIB2又可以促进CYLD降解从而激活NF-κB信号通路[25]。这些研究暗示与IKK复合物密切相关的泛素蛋白酶对NF-κB信号通路有重要的调节作用。本研究发现,NMB和NMBR均可以调节IAV/H9N2感染诱导细胞中RNF8、CYLD和MIB2表达,暗示NMB和NMBR通过调节作用于NF-κB信号通路IKK节点的E3泛素连接酶和去泛素化酶从而发挥抗IAV/H9N2感染诱导的免疫反应。本研究从泛素化修饰的角度分析NMB和NMBR调节甲型流感病毒感染的作用机制,为研究宿主-病毒之间的密切关系提供更充足的依据。
4 结 论
通过体外试验的研究,揭示NMB/NMBR通过调节与IKK直接相关的多个泛素蛋白酶的表达,参与IAV/H9N2亚型感染激活的NF-κB信号通路的调节。该研究结果表明,NMB/NMBR可通过泛素化修饰调节NF-κB信号通路的活性,参与机体发挥抗IAV感染的先天性免疫应答反应,为深入了解宿主抗IAV感染的作用机制和开发新型抗IAV药物提供更充足的理论依据。
