促干护色剂在枸杞干制过程中促干护色机理的研究
2023-07-27王晓雨利通常晨光任贵平杨海燕武运黄文书
王晓雨,利通,常晨光,任贵平,杨海燕,2,武运,2,黄文书,2*
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830052) 2(新疆果品采后科学与技术重点实验室,新疆 乌鲁木齐,830052)
枸杞(LyciumbarbarumL.)是一种茄科植物,具有丰富的化学成分和药用特性,两千多年来一直是传统中药的重要组成部分,被称为“超级水果”[1]。枸杞中含有较多营养物质和高抗氧化能力的生物活性化合物,如多糖、多酚、类胡萝卜素和氨基酸等[2],其中多聚糖复合物是枸杞果实中最重要、最丰富的一类化合物[1]。枸杞还具有促进健康的生物学效应,可预防或治疗高血压、降血糖、降血脂、保护视网膜、促进细胞凋亡和抑制癌细胞增殖[3-4]。枸杞为浆果类果实,具有较高的含水量,且表皮附着较厚的蜡质层,阻碍了干制过程中果实内部水分向外扩散,降低枸杞的干制速率,使干制时间较长。此外,枸杞在干制过程中易受到酶促褐变或非酶褐变的影响而发生褐变反应,导致枸杞干制品品质较差。因此,对枸杞的品质控制成为当前研究的热点问题。
食品在干制过程中会发生一些物理化学反应、营养成分和感官品质的变化[5]。枸杞在干制前易受到机械损伤以及干制过程中温度或氧气的影响,经常会出现色泽变暗的现象,从而导致褐变反应的发生。根据果蔬发生褐变反应的条件和机理不同,可以将褐变分为酶促褐变和非酶褐变,2种褐变均会导致枸杞品质下降,造成色泽劣变及营养物质损失。在工业规模下,由于干燥时间长、干燥温度高,还会出现原料组织收缩、失味、再水化能力下降等问题[6]。其次,枸杞发生褐变离不开水分含量和水分活度的影响,而降低水分含量的目的是延长食品的保质期,将水分活度降低到足够低的水平,可以使微生物、酶反应和其他劣化反应受到抑制[7]。因此,为提高枸杞的干燥速度,并防止枸杞在干制过程中发生褐变反应,可在枸杞干制前进行适当的促干护色预处理,使枸杞同时达到干制速度快、干制品色泽鲜艳的效果。然而,对于枸杞干制过程中的颜色变化和促干护色剂的作用机理,国内外少有研究。
本研究以鲜枸杞为原料,以未处理的枸杞为对照,使用无硫促干护色剂对枸杞进行预处理,并对枸杞进行干燥,在整个干燥过程中对酶促褐变和非酶褐变相关指标进行测定分析,利用光学显微镜和扫描电子显微镜观察枸杞表皮蜡质层的破坏情况,探究枸杞在干制过程中的褐变类型及促干护色剂的作用机理,旨在为实践中采取有效控制枸杞褐变措施,提高枸杞干制产品的品质提供指导。
1 材料与方法
1.1 材料与试剂
鲜枸杞,2021年9月采自新疆精河县,品种为宁杞9号。选取无腐烂霉变,无机械损伤,成熟度与颗粒大小均一的果实进行后续试验。碳酸钠、柠檬酸(食品级),河南万邦化工科技有限公司;亮氨酸标准品(≥98%)、5-羟甲基糠醛(5-hydroxymethylfurfural, 5-HMF)标准品(≥98%),上海源叶生物科技有限公司;福林酚试剂,北京索莱宝科技有限公司;茚三酮、正丙醇、正丁醇、乙二醇、乙酸钠、异丙醇、抗坏血酸、酒石酸钾钠、3,5-二硝基水杨酸、亚硫酸钠、碳酸钠、无水乙醇、聚乙二醇6000、聚乙烯吡咯烷酮、曲拉通(Triton X-100)、邻苯二酚、愈创木酚、过氧化氢、三氯乙酸、硫代巴比妥酸,均为分析纯。
1.2 仪器与设备
DHG-9420A型电热恒温鼓风干燥箱,上海申贤恒温设备厂;IKA®A11基本型研磨机,广州仪科实验室技术有限公司;SF-GL-16A型高速冷冻离心机,上海菲恰尔分析仪器有限公司;T6新世纪紫外分光光度计,北京普析通用仪器有限责任公司;LE204E型电子天平,梅特勒-托利多仪器(上海)有限公司;JEA202型电子天平,上海浦春计量仪器有限公司;DHS-16型水分测定仪,上海菁海仪器有限公司;NH-A-1808型高品质电脑色差仪,深圳市三恩时科技有限公司;DZKW-型电热恒温水浴锅,北京市永光明医疗仪器厂;KQ-300TDE型高频数控超声波清洗器,昆山市超声仪器有限公司;HDCE-X5 N型光学显微镜,深圳市赛克数码科技开发有限公司;JSM-7610FPlus型扫描电子显微镜,捷欧路(北京)科贸有限公司。
1.3 实验方法
1.3.1 样品预处理
促干护色剂配方参考王晓雨等[8]的方法进行配制,成分为脱蜡剂碳酸钠和护色剂柠檬酸,均为食品级成分。将枸杞(100 g)置于蒸馏水(250 mL)和促干护色液(250 mL)中浸泡10 min,取出后沥干表面水分,单层平铺于不锈钢丝网盘中,置于50 ℃热风干燥箱中将其干燥至水分含量低于13%,此为对照组和处理组。将枸杞在干燥期间每烘至8 h进行取样,用液氮速冻后置于-80 ℃冰箱中保存,用于后续试验。直接撕取不同处理下的枸杞表皮,用于光学显微镜和扫描电镜观察。
1.3.2 含水量的测定
采用快速水分测定仪测定枸杞干制后的水分含量。
1.3.3 色泽的测定
采用色差仪对枸杞干制后的色泽进行测定。用ΔE表示待测样品的色泽(L、a、b)与鲜样色泽的(L*、a*、b*)的差异[9]。ΔE表示整体颜色变化,计算方法如公式(1)所示:
(1)
式中:L、L*值分别表示干样和鲜样的明度;a、a*值分别表示干样和鲜样的红绿度;b、b*值分别表示干样和鲜样的黄蓝度,ΔE为总色差值。
1.3.4 多酚氧化酶(polyphenol oxidase, PPO)活性的测定
参考曹建康等[10]的方法对PPO活性进行测定。以每克干质量枸杞每分钟在420 nm处吸光度变化值增加1时为1个PPO活性单位(U),结果以U/g表示。
1.3.5 过氧化物酶(peroxidase, POD)活性的测定
参考曹建康等[10]的方法对POD活性进行测定。以每克干质量枸杞每分钟在470 nm处吸光度变化值增加1时为1个POD活性单位(U),结果以U/g表示。
1.3.6 总酚含量的测定
采用Folin-Ciocalteu法[11]对总酚含量进行测定。以没食子酸为标准品,所得标准曲线线性方程为:y=4.742 9x+0.007 5,R2=0.998 6,由此计算样品总酚含量(mg/g)。
1.3.7 还原糖含量的测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[10]对还原糖含量进行测定。以葡萄糖为标准品,所得标准曲线线性方程为:y=0.564 8x-0.011 3,R2=0.998 1,结果以百分含量(%)表示。计算如公式(2)所示:
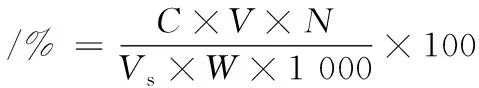
(2)
式中:C为从标准曲线查得的葡萄糖毫克数,mg;V为样品提取液总体积,mL;N为样品提取液稀释倍数;Vs为测定时所取样品提取液体积,mL;W为样品重量,g。
1.3.8 游离氨基酸总量的测定
采用茚三酮比色法[10]进行测定。以亮氨酸为标准品,所得标准曲线线性方程为:y=0.053 7x-0.003 8,R2=0.993 7,含量以每100 g果蔬中氨态氮的毫克数表示,即mg/100 g FW。游离氨基酸计算如公式(3)所示:
游离氨基酸总量/[mg·(100 g)-1FW]
(3)
式中:C为从标准曲线查得的氨基酸(亮氨酸)的质量,μg;V为样品提取液总体积,mL;Vs为测定时所取样品提取液体积,mL;W为样品质量,g。
1.3.9 5-HMF含量的测定
参考UDOMKUN等[12]的方法对5-HMF含量进行测定。以5-HMF为标准品,所得标准曲线线性方程为:y=0.020 5x-0.005 2,R2=0.997 5,根据标准曲线计算5-HMF含量,结果以μg/g表示。
1.3.10 表皮显微结构的观察
光学显微镜制样方法:将枸杞经不同处理后,撕取其表皮做成水装片,置于光学显微镜载物台上观察。需统一所有样品的放大倍数。
扫描电子显微镜制样方法:将经不同处理后的枸杞干制后,使用手术刀将枸杞表皮切成小块,将其固定在载物板上进行喷金处理,喷金后取出置于扫描电镜下,使用5.0 kV的加速电压对枸杞表皮进行微观结构观察,并对不同放大倍数的微观结构区域进行图片采集并保存分析。
1.4 数据处理
每个试验重复3次;实验数据采用SPSS 26.进行数据分析,单因素方差分析方法进行显著性分析;采用Origin 2019b制图。
2 结果与分析
2.1 促干护色剂对枸杞干制过程中水分含量的影响
根据水分含量可以判断2组不同处理干制速度的快慢。如图1所示,2组处理的水分含量的变化均呈下降趋势。处理组(促干护色处理)在干制32 h时干制速度变缓,在40 h达到干制终点,对照组在干制56 h时干制速度变缓,在72 h时达到干制终点,相比对照组,处理组可加快枸杞的干制速度,缩短干制时间,说明预处理方法对枸杞的干燥速度影响较大。预处理溶液中的脱蜡剂为碳酸钠,ZHAO等[13]研究发现,在热风干燥过程中,碳酸钠溶液预处理枸杞的总平均干燥速率是对照组的将近2倍,与本研究结果相似。2组处理在干制0~32 h的水分含量下降速度较快,在32 h后干燥速度较慢,由于干燥是水分和热量传递的过程,其速率的变化取决于内部水的扩散和表面水的蒸发。枸杞果肉较厚,果皮致密,在干制后期时,内部水分扩散速度低于表面水分的蒸发速度,导致干燥期非恒定速率[13]。当水分含量下降到一定程度时,枸杞内部的大部分自由水被除去,结合水开始散失,因此,枸杞在干燥后期的干燥速率迅速降低。相比对照组,处理组对枸杞的干制速度有较大的提升,具有较强的促干效果。
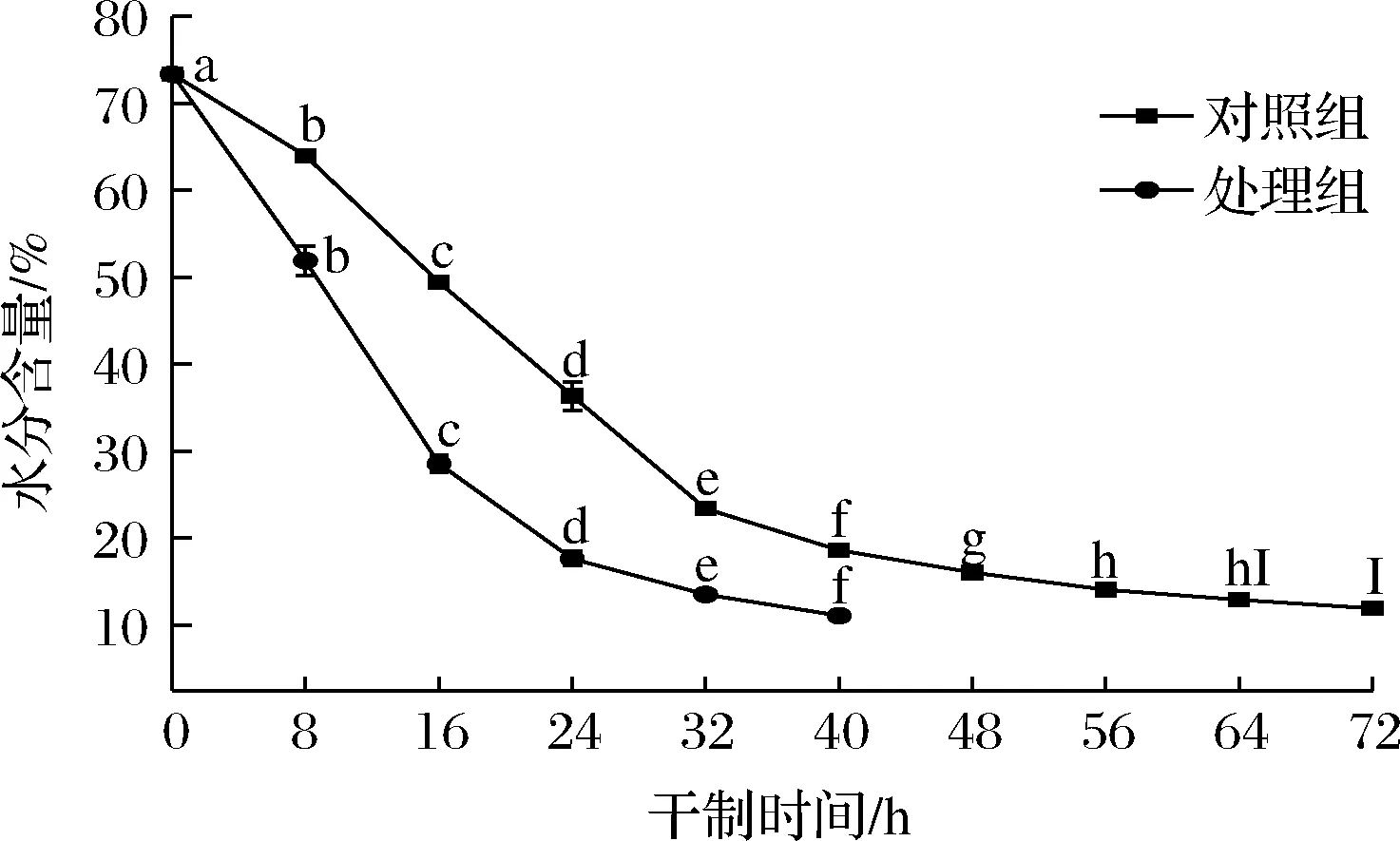
图1 不同处理对枸杞在干制过程中水分含量的影响Fig.1 Effects of different treatments on moisture content of Lycium barbarum during drying process注:小写字母表示2组处理在不同干制时间下差异显著(P<0.05)(下同)
2.2 促干护色剂对枸杞干制过程中色泽的影响
色差反映出经干燥后得到的枸杞与鲜果之间颜色的差异,色差值越小,颜色越接近鲜果,色差值越大,则与鲜果颜色差异越大。如图2所示,在枸杞干制过程中,2组处理的色差值均呈上升趋势。在干制8 h时,处理组的色差值高于对照组,对照组因未经促干护色处理,干制速度较慢,在干制8 h时与鲜果的状态和颜色接近。在干制16 h时,对照组的色差值开始大幅度升高,达到显著水平(P<0.05),推测可能是发生了酶促褐变反应导致枸杞颜色开始劣变,在干果中,褐变是由非酶促反应引起的,而在新鲜水果中是由酶促反应引起[14]。处理组的变化趋势较为平缓,说明促干护色剂在枸杞干燥过程中发挥了一定的护色作用,颜色也受处理过或未处理过的样品初始条件的影响,对样品进行预处理可减少加工和贮藏过程中的褐变现象,降低样品风味和营养物质的损失。这也跟枸杞的干制速度有关,枸杞在干燥中后期时,水分含量较低,水分活度下降至抑制氧化褐变的水平,从而抑制枸杞的氧化褐变现象。
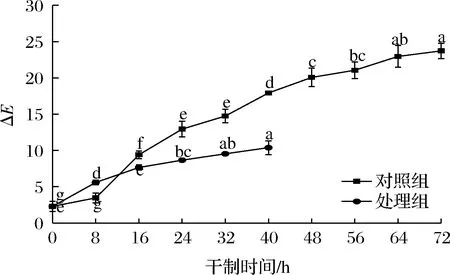
图2 不同处理对枸杞在干制过程中ΔE的影响Fig.2 Effects of different treatments on ΔE of Lycium barbarum during drying process
干制40 h时,处理组的色差值低于对照组,对照组因干制未结束,一些生化反应还在进行,颜色也受生长、成熟、采后处理和加工过程中发生的化学、生化、微生物和物理变化的影响。此外,在持续干燥的过程中,样品表面在后期变得干燥,另考虑空气中的高温,导致产品表面出现明显的质量退化和裂缝[14],所以色差值继续增大。处理组具有较好的护色效果,色差值较低,比对照组干制结束时的色差值低56%。说明经过处理的样品比未经处理的样品在外观品质上更容易被接受。
2.3 促干护色剂对枸杞干制过程中PPO活性的影响
褐变反应通常是PPO或POD作用于酚类化合物形成醌,醌最终聚合并产生褐变现象。如图3所示,在干制过程中,两组处理的PPO活性均呈下降趋势,在干燥初期,枸杞的酶活性较高,但随着干燥时间的延长,PPO活性逐渐降低,说明持续的热风干制过程和较高的温度下均可抑制PPO活性,KORBEL等[15]在对芒果的干制过程中也得到相似的结果。在干制结束时,对照组的PPO活性抑制率为77.25%,处理组的PPO活性抑制率为80.95%,说明促干护色处理使枸杞的PPO活性保持在较低的水平。
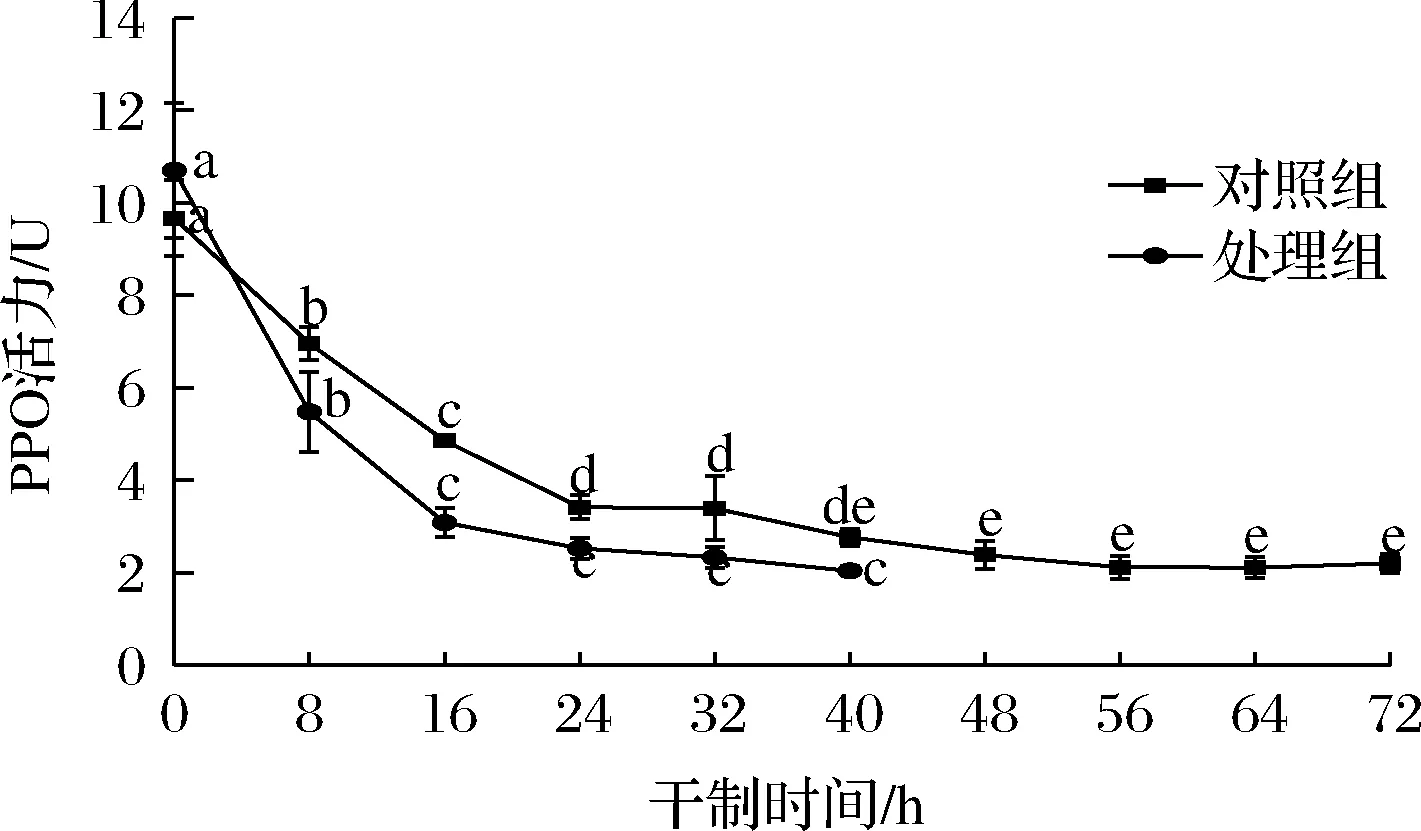
图3 不同处理对枸杞在干制过程中PPO活性的影响Fig.3 Effects of different treatments on PPO activity of Lycium barbarum during drying process
同时,处理组在干制0~40 h时酶活呈现快速下降趋势,而对照组下降趋势较为平缓。促干护色液由脱蜡剂碳酸钠和护色剂柠檬酸组成,PPO是一种含铜酶,柠檬酸对PPO活性中心的铜离子具有较强的螯合作用,使PPO活性受到抑制。此外,柠檬酸可降低反应体系的pH值,使其远离PPO的最适pH值,从而抑制PPO的活性[16]。因此,相比对照组,处理组对PPO活性具有较强的抑制作用。
2.4 促干护色剂对枸杞干制过程中POD活性的影响
POD广泛存在于各种植物体内,与PPO协同作用于果蔬产品的褐变。如图4所示,在整个干制过程中,2组处理的POD活性均呈波动下降趋势,说明长时间的干燥可降低枸杞的POD活性。在干制0~16 h时,对照组的POD活性出现小幅度上升趋势,这可能与其有较强的耐热性有关。黎婕[17]研究发现,在30~80 ℃,柚子果肉的POD能保持较高活性,但在一定温度下,热加工时间足够长,POD活性也会降低。其次,POD在植物细胞中有两种存在形式,一是以可溶形式存在于胞浆中,二是以结合形式与细胞膜或细胞器相结合,在加工过程中,膜界酶可能被释放和激活[18]。随着干制的进行,POD活性逐渐下降,在干制40 h时,2组处理的POD活性抑制率分别为43.66%和57.87%,处理组的POD活性下降较快,干制后期的水分含量较低,意味着酶的作用所需水分较少,从而使酶失去活性。在干制前对枸杞进行适当的促干护色处理,可在一定程度上抑制POD的活性,且柠檬酸对POD活性具有抑制作用,在果蔬加工时可作为酶促褐变的抑制剂。
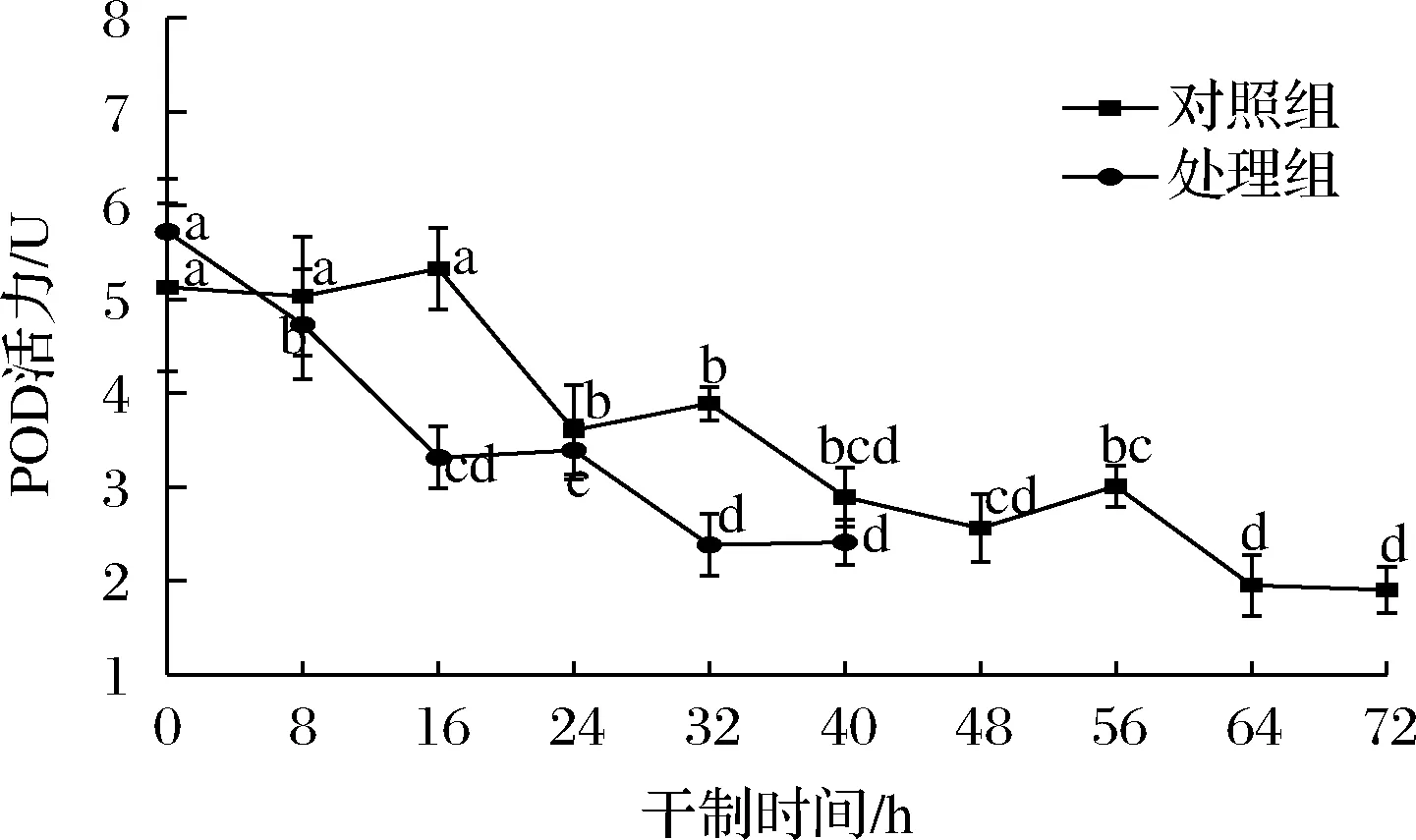
图4 不同处理对枸杞在干制过程中POD活性的影响Fig.4 Effects of different treatments on POD activity of Lycium barbarum during drying process
2.5 促干护色剂对枸杞干制过程中总酚含量的影响
如图5所示,在枸杞干制过程中,对照组的总酚含量呈先下降后上升的变化趋势,处理组的总酚含量呈上升趋势,且高于对照组。在干制前期,对照组的总酚含量呈下降趋势,在干制后期开始上升,这是由于干制前期枸杞中的多酚氧化酶还有较大活力,易与酚类物质发生反应导致总酚的消耗。而在干制后期呈现上升趋势可能是枸杞经过长时间的加热,由于植物细胞壁的破坏而改变其可萃取性,因此结合的多酚类化合物更容易释放。其次,酚酸主要与碳水化合物和蛋白质结合,在热加工过程中,因细胞成分和共价键的破坏而释放,使其多酚成分更易于提取。在干制结束时,2组处理的总酚含量相比鲜果枸杞的总酚含量分别增加了22%和30%。相关研究表明,干果的总酚含量要比鲜果的总酚含量高很多,因为抗氧化剂会在干燥后变得集中[19],与本研究结果相似。
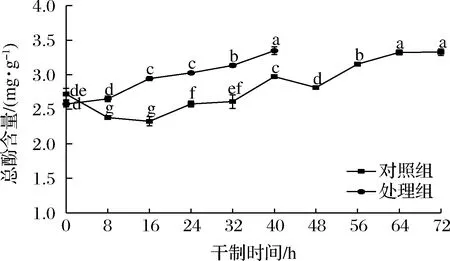
图5 不同处理对枸杞在干制过程中总酚含量的影响Fig.5 Effects of different treatments on total phenolic content of Lycium barbarum during drying process
2.6 促干护色剂对枸杞干制过程中还原糖含量的影响
果蔬在加工过程中会发生非酶褐变,如美拉德反应,是一种发生在氨基酸、肽或蛋白质等氨基化合物和羰基化合物之间的化学反应,羰基化合物通常是葡萄糖和果糖等还原糖类物质。如图6所示,随着干制的进行,2组处理的还原糖含量均呈先上升后下降的变化趋势。还原糖包括葡萄糖和果糖,在干制前期,还原糖含量增加,可能是因为蔗糖在高温环境下由转化酶水解产生果糖和葡萄糖等羰基化合物。宋云等[20]研究脱苦杏仁在干制过程中的还原糖含量的变化规律也得到类似的结果,推测是干制前期,多糖和双糖类物质会在高温下分解为还原糖等单糖类物质。

图6 不同处理对枸杞在干制过程中还原糖含量的影响Fig.6 Effects of different treatments on reducing sugar content of Lycium barbarum during drying process
在干制后期,枸杞中的还原糖含量下降,结合游离氨基酸总量和5-HMF含量的变化情况,推测在干制后期还原糖可能会参与到非酶褐变中,从而消耗还原糖类物质。张宝善等[21]发现红枣在50 ℃热风干制过程中,还原糖含量也呈现先上升后下降的变化趋势,推测糖的消耗与非酶褐变密切相关。在干制32 h时,处理组的还原糖含量达到峰值,对照组则在干制56 h时达到峰值,随后继续下降。处理组经过促干护色处理后加快了反应进程,而对照组因干制时间较长,反应较慢。此外,当枸杞水分含量和酶活降到一定程度时,非酶褐变也会发生,这也是导致色差值增大的另一个原因。
2.7 促干护色剂对枸杞干制过程中游离氨基酸总量的影响
氨基化合物是发生美拉德反应的另一种反应物,与羰基化合物反应后生成褐变色素,根据游离氨基酸在干制过程中的变化趋势可判断枸杞的褐变情况。如图7所示,随着干制的进行,2组处理的游离氨基酸总量均呈先上升后下降的变化趋势,可能是因为枸杞中的蛋白质或结合态氨基酸降解导致的结果。宋云等[20]研究脱苦杏仁在干制过程中游离氨基酸含量的变化规律时,也得到类似的结果。推测枸杞在干制前期,蛋白质因持续受热而发生水解反应,从而导致游离氨基酸含量增加。

图7 不同处理对枸杞在干制过程中游离氨基酸总量的影响Fig.7 Effects of different treatments on the total free amino acids of Lycium barbarum during the drying process
在整个干制过程中,处理组在干制24 h时达到峰值,对照组在干制32 h时达到峰值,随后继续下降。对照组在干制中期就出现下降趋势,说明对照组在干制中后期可能发生了非酶褐变反应,使氨基化合物参与到美拉德反应中,导致游离氨基酸而迅速减少。且干制时间越长,其损失量越大,褐变程度越严重。枸杞经促干护色处理后,在加快了干制速度和反应进程的同时,也抑制了很多生理生化反应,下降较为平缓,使参与美拉德反应的氨基酸较少,进而有效抑制褐变,这也与图2中的色差值结果一致。
2.8 促干护色剂对枸杞干制过程中5-HMF含量的影响
5-HMF是一种重要的中间体,可作为美拉德反应强度的指标,通常被用作美拉德反应演化的指示物和潜在的褐变标记物[22]。如图8所示,在枸杞干制过程中,两组处理的5-HMF含量均呈先下降后上升的变化趋势。干制初期,在鲜果中检测到5-HMF,可能与其成熟度和色素类物质有关。HELYES等[23]在新鲜番茄中检测到5-HMF,从绿色期到深红色期,番茄红素增加,与5-HMF含量成正比。在干制前期,5-HMF呈下降趋势,可能与枸杞中含有的绿原酸有关,绿原酸易被PPO作用形成醌型绿原酸,醌型绿原酸会抑制体系中果糖与氨基酸的结合,导致体系中5-HMF的含量降低[24]。
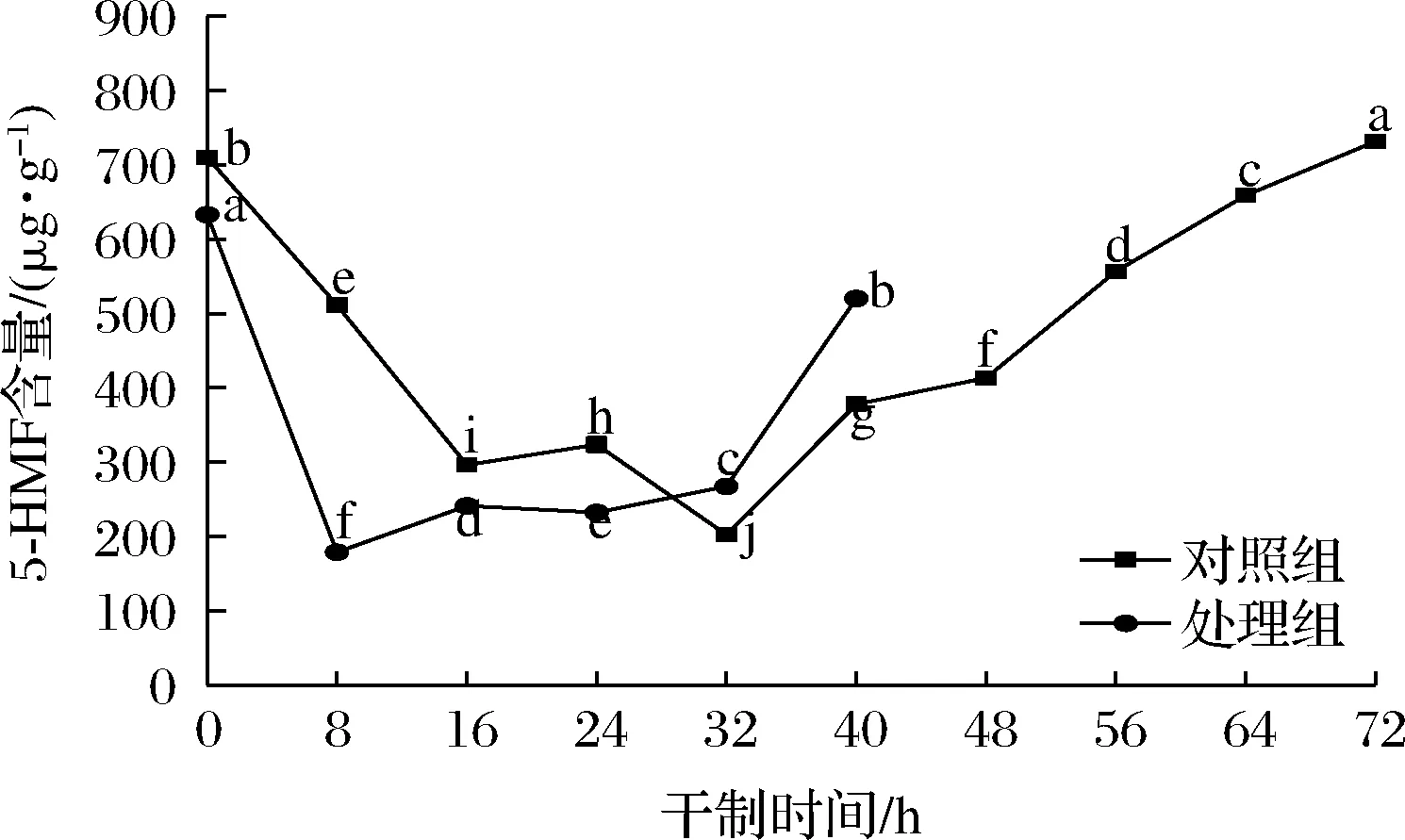
图8 不同处理对枸杞在干制过程中5-HMF含量的影响Fig.8 Effects of different treatments on the content of 5-HMF in Lycium barbarum during drying process
随着干制的进行,两组处理的5-HMF含量在干制后期均呈上升趋势,在热力的持续作用下,还原糖和氨基酸会发生美拉德反应,同时还可能在酸的作用下生成5-HMF,但还需经过一系列反应生成褐色物质。结合还原糖和游离氨基酸含量的变化,推测枸杞在干制前期主要以酶促褐变为主,干制后期可能存在美拉德反应参与枸杞的褐变。干制结束时,处理组的5-HMF含量比对照组低了28.90%。说明促干护色剂可抑制5-HMF的积累,进而抑制枸杞发生非酶褐变。ZHANG等[25]研究发现,经过高压二氧化碳预处理的蜜橘皮在干燥过程中的5-HMF含量比未处理时分别降低了9.23%和39.42%,与本研究结果类似,说明促干护色处理可在一定程度上抑制美拉德反应,使枸杞保持较好的色泽。与上述还原糖含量、游离氨基酸含量及色差值的结果一致。
2.9 不同处理对枸杞表皮微观结构的影响
为探究不同处理对枸杞的促干护色作用机理,对枸杞表皮进行微观结构观察。4组样品分别为:对照组(未经促干护色处理)、无硫促干护色处理、市售干枸杞和自然晾晒的干枸杞。
枸杞表皮上覆盖了较厚的蜡质层,其结构呈现整齐光滑的束状条带,排列紧密,且束状条带上附着大量的蜡质碎片[26]。由于枸杞表皮蜡质抑制水分由内而外的流动,影响枸杞内部水分的散失,使枸杞干燥困难。若对鲜枸杞表皮进行适当的脱蜡预处理,可加快其干制速率,缩短干制时间。如图9a-1~图9a-3、如图9d-1~图9d-3所示(对照组和自然晾晒组),未经促干护色处理的枸杞表皮蜡质层未被破坏,其结构光滑,呈规则紧密的线状排列,并附着大量的蜡质碎片(图9a-3),不能清晰地观察到角质层细胞,阻碍了枸杞内部水分散失,导致干燥速率较慢,这与NI等[27]对未处理的枸杞表皮观察结果一致。如图9b-1~图9b-3所示,经过无硫促干护色处理后的枸杞表皮蜡质层结构破坏严重,表皮细胞角质层暴露在外,可清晰地观察到枸杞表层组织结构(图9b-1),能够一定程度去除附着的蜡质碎片,表面粗糙有凹陷,并且可以观察到许多不规则的细小微孔(图9b-2),这些微孔可以减少枸杞蜡质层对水分运移的阻塞作用,在促进水分在干燥过程中的传递和蒸发的同时有利于护色液的渗入,使其内部水分较快排出,提高枸杞的干燥速率,护色效果也更好。相关研究表明,当表皮呈现多孔结构时,可加快样品的干燥速率,与XIE等[28]使用脉冲真空干燥枸杞和ZHOU等[29]使用冷等离子体处理枸杞的研究结果一致。

图9 不同处理下的表皮微观结构Fig.9 Epidermal microstructure under different treatments
如图9c-1~图9c-3所示,市售干枸杞通常是种植户使用3%~5%的高浓度碳酸钠溶液浸渍枸杞,以脱去表皮蜡质层,对其进行显微结构观察后,发现蜡质层局部被破坏,使蜡质层的束状结构断裂或聚集(图9c-2~图9c-3),且排列疏松,果实内部水分易排出,提高了干燥速度。同时,由于使用高浓度的碱液处理,导致干燥后的枸杞表面附着碱液残留,影响外观品质,因表面沾有大量的碱(图9c-3所示),导致市售干枸杞口感偏咸。
综合以上分析可知,不同预处理方法对枸杞表皮蜡质层的破坏程度各不相同,使其表皮微观结构存在差异。其次,微观结构的观察和分析进一步验证了不同预处理方法对枸杞的促干护色效果均有一定影响,使用促干护色剂处理后的枸杞表皮蜡质层结构破坏严重,除去蜡质层这道屏障后,在提高干燥速率的同时也能促进护色剂的渗入,使枸杞同时达到“干燥快、色泽好”的效果,进而合理判断促干护色剂的效果和作用机理。
3 讨论
在枸杞干制过程中,对照组达到干制标准所需时长为72 h,而处理组所需40 h,说明促干护色剂有较强的促干作用。NI等[27]研究发现,枸杞经碳酸钠溶液预处理后,其总平均干燥速率比对照组提高1.19倍,与本研究结果相似。碳酸钠溶液呈碱性,对蜡质层具有一定的溶解作用,使其聚集或断裂,形成水分子扩散通道,提高枸杞果实的有效水分扩散系数,进而提高枸杞的干燥速率,缩短干燥时间。颜色是评价枸杞干质量的关键属性之一,可以反映产品的质量状况。在干制结束时,处理组的色差值低于对照组,产品的颜色变化与产品的含水率有着相对复杂的关系,对照组干制速度较慢,在富氧环境下,干燥温度越高,干燥时间越长,与颜色变化有关的营养物质可能会发生降解[28]。
其次,脱水速度的快慢会影响果蔬中PPO的活性,在刘峰娟等[30]的研究中发现,对无核白葡萄进行快速脱水,可较大程度地抑制PPO活性,使其保持较好的色泽,与本研究结果相似。枸杞在干制0~16 h时,对照组的POD活性出现小幅度上升趋势,这可能与其有较强的的耐热性有关。相关研究提到,POD是一种温度稳定性较高的酶,对热加工表现出很强的耐受性,尤其是在80 ℃以下[18,31]。总酚含量在干制后期呈现上升趋势,干燥过程中酚类化合物会发生水解反应,有时水解产物在福林酚法中反应较好。JEONG等[32]也报道了加热过程中柑橘皮总酚含量增加,是由于基质的分解,新生成了一些低分子质量的酚类化合物,表明柑橘皮通过简单热处理可释放出酚类化合物。这也意味着植物中具有抗氧化活性的酚类化合物存在多种结合态,通过简单的加热过程可作为提高原料抗氧化活性的方式。
枸杞在干制后期可能会发生非酶褐变反应。还原糖含量和游离氨基酸总量呈先上升后下降的变化趋势,非酶褐变会导致二者的消耗,结合色差值和非酶褐变中间产物5-HMF的变化,推测枸杞在干制后期存在非酶褐变。干制后期水分含量不断下降,当水分含量和PPO活性越低,褐变程度和5-HMF含量就越高[12]。当5-HMF不断积累,并参与美拉德反应形成类黑精色素,就会导致食品发生褐变,这也是枸杞在干制过程中色差值不断增大的原因。使用促干护色剂对枸杞进行适当的预处理,可有效抑制5-HMF的积累。LI等[33]研究果饼在干燥过程中的褐变时,发现添加亚硫酸氢钠的产品的5-HMF含量比对照组降低了约47%,说明抗褐变剂能有效抑制5-HMF的积累,通过减少5-HMF的积累来抑制原料的褐变,与本研究结果相似。
此外,本试验发现鲜果中可检测到5-HMF,推测可能与成熟度或色素类物质有关。ABRAHAM等[34]提出鲜果中也含有5-HMF,其中李子可以作为5-HMF的特殊来源,即使在新鲜水果中也发现了高浓度的5-HMF(高达2 200 mg/kg),并表示果汁可能是5-HMF出现的一个主要来源,因为果汁中含有高浓度的5-HMF。CHOUDHARY等[35]表示5-HMF也存在于水果中,并且不同种类的食物有不同含量。对枸杞表皮进行显微结构观察,判断不同处理对表皮蜡质层的破坏情况,从而获得与其促干护色效果的关联性。对照组的蜡质层结构完好,束状结构排列致密,内部水分难以散失,导致枸杞干制时间较长,受到持续热和氧气的影响发生褐变反应,使其外观品质较差。经促干护色剂处理后的枸杞蜡质层结构破坏严重,蜡质碎片清除较完全,局部出现细小孔洞,减少蜡质层对水分转移的阻塞作用,在促进水分在干燥过程中传递和蒸发的同时有利于护色液的渗入,抑制枸杞在干燥过程中发生褐变反应,提升枸杞的干燥速率和外观品质。
4 结论
枸杞在干制过程中易受持续高温和氧气的影响导致褐变发生,严重影响枸杞的外观品质,降低其经济价值,需使用适当的促干护色处理提升其干制速率和整体品质。本文研究了枸杞在干制过程中发生的褐变反应类型及促干护色剂的作用机理,通过对枸杞的酶促褐变、非酶褐变相关指标进行测定及表皮显微结构的观察,判断促干护色剂对枸杞在干制过程中的褐变抑制情况和作用机理。研究结果发现,枸杞在干制过程中会发生酶促褐变和非酶褐变反应,均会导致枸杞干制品色泽劣变,且在干制前期以酶促褐变为主,干制后期以非酶褐变为主。枸杞经促干护色剂预处理后,可在整个干制过程中抑制PPO和POD的活性,以及美拉德反应中间产物5-HMF的积累,在加快干制速度的同时,对枸杞的褐变反应有较强的抑制作用,能够更好地保持枸杞原有的色泽。此外,通过表皮微观结构中可以观察到鲜枸杞经不同处理后蜡质层的破坏情况,从而进一步判断促干护色剂的效果和促干护色机理。
