呋喹替尼联合PD-1抑制剂四线治疗晚期结直肠癌的疗效观察
2023-07-27解燕茹山西省稷山县人民医院肿瘤科043200
解燕茹 山西省稷山县人民医院肿瘤科 043200
结直肠癌(Colorectal cancer,CRC)是常见的消化道恶性肿瘤,发病率在我国恶性肿瘤中居第4位,死亡率居第5位[1],超过50%的患者就诊时,已到Ⅲ~Ⅳ期,5年存活率不及40%[2]。近年来,随着靶向新药的不断研发,一二线化疗联合贝伐珠单抗、西妥昔单抗,以及三线的呋喹替尼、瑞戈非尼,使晚期转移性结直肠癌(metastatic colorectal cancer,mCRC)患者的中位总生存已超过30个月[3]。免疫治疗在多种实体瘤的疗效均得到证实,已成为临床研究的热点,尤其在错配基因修复缺失(dMMR)/高度微卫星不稳定性(MSI-H)mCRC中,不论KRAS、BRAF基因状态,也不论肿瘤部位(左半或右半),免疫检查点抑制剂已获批一线治疗dMMR/MSI-H mCRC的适应证,为晚期转移性结直肠癌的治疗锦上添花,使更多的患者有接受四线甚至更多线治疗的机会。但错配修复功能完整(pMMR)/微卫星稳定(MSS)患者未能从免疫治疗中获益,本文采用呋喹替尼联合PD-1抑制剂,四线治疗pMMR/MSS mCRC患者,取得较好临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 选取2020年1月—2022年4月我院收治的三线治疗失败后晚期转移性结直肠癌患者30例,随机分为观察组和对照组,各15例。纳入标准:有明确的病理证实为大肠癌,且免疫组化为pMMR/MSS;既往曾接受三线呋喹替尼治疗失败进展者;无脑转移;体能状态PS评分≤2分;至少有1个可测量靶病灶。排除标准:既往前线曾接受免疫检查点抑制剂;有严重脏器功能不全者;dMMR/MSI-H者;有自身免疫性疾病者。其中观察组男6例,女9例,年龄35~75(58.87±19.34)岁;对照组男8例,女7例,年龄40~80(59.93±10.86)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法 观察组给予口服呋喹替尼联合PD-1单抗,呋喹替尼(爱优特,和记黄埔医药苏州有限公司,规格1mg×21片)3mg qd连续服用21d,停药7d。PD-1单抗:使用信迪利单抗(达伯舒,信达生物制药苏州有限公司,规格100mg)9例,卡瑞利珠单抗(艾瑞卡,苏州盛迪亚生物医药有限公司,规格200mg)6例。具体用法为:0.9%氯化钠100ml+信迪利单抗/卡瑞利珠单抗200mg,缓慢静滴,至少30min以上,口服呋喹替尼第1天静滴,q28d。对照组予止疼、营养支持、对症治疗。治疗4个周期后复查评价。
1.3 观察指标 (1)近期疗效评价:根据WHO实体瘤客观判定标准进行评定。完全缓解(CR):所有病灶完全消失,至少维持4周;部分缓解(PR):病灶最大直径总和减小≥30%,至少维持4周;疾病稳定(SD):病灶最大直径总和减小未达PR,或增加未达PD;疾病进展(PD):病灶最大径直径总和增加≥20%或出现新的病灶。疾病控制率(DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%。(2)于治疗前和治疗4个周期后,测定两组患者免疫功能,观察CD3+CD4%、CD3+CD8% 、CD4/CD8。检测方法:空腹抽取患者2ml外周血于EDTA抗凝管,采用直接荧光标记法测定全血淋巴细胞亚群水平,使用流式细胞仪(厂家:青岛瑞斯凯尔生物科技有限公司,型号:RasieCyte 2L6C)进行检测。(3)不良反应:采用抗肿瘤药物不良反应评价标准进行评定,比较两组患者高血压、蛋白尿、甲状腺功能(甲功)异常、手足皮肤反应、发热情况。

2 结果
2.1 两组患者近期临床疗效比较 观察组DCR为46.67%,高于对照组的13.33%,差异有统计学意义(χ2=5.136,P=0.023<0.05)。见表1。

表1 两组近期疗效比较[n(%)]
2.2 两组患者血清免疫功能指标比较 治疗前两组患者血清CD3+CD4%、CD3+CD8%、CD4/CD8水平比较,差异均无统计学意义(P>0.05)。治疗4个周期后,观察组患者CD3+CD4%、CD4/CD8水平较治疗前明显升高,CD3+CD8+%水平较治疗前降低,而对照组患者CD3+CD4% CD4/CD8水平较治疗前下降,CD3+CD8+%水平较治疗前升高,且治疗后观察组CD3+CD4%、CD4/CD8水平较对照组升高,CD3+CD8%水平较对照组降低,差异均有统计学意义(P<0.05)。见表2。
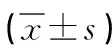
表2 两组患者免疫功能指标比较
2.3 两组不良反应发生率比较 观察组高血压、甲状腺功能异常发生率高于对照组,差异均有统计学意义(P<0.05),但蛋白尿、手足皮肤反应、发热发生率与对照组比较,差异无统计学意义(P>0.05)。见表3。
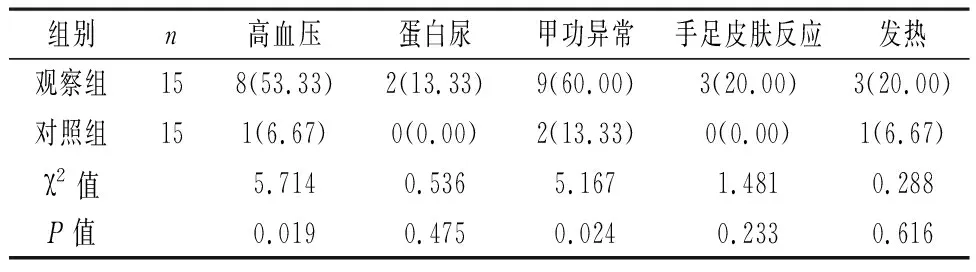
表3 两组不良反应比较[n(%)]
3 讨论
当前mCRC诊疗策略已非常规范,一二线pMMR者治疗以奥沙利铂、伊立替康、卡培他滨、氟尿嘧啶为基础的化疗,联合血管靶向药物贝伐珠单抗或抗表皮生长因子受体(EGFR)西妥昔单抗,依据KRAS状态、肿瘤部位、患者的体能状态评分分层选择,dMMR者一二线治疗选择PD-1单抗免疫治疗。三线治疗可选择瑞戈非尼、呋喹替尼、曲氟尿苷替匹嘧啶,但mCRC四线及后线该如何治疗,目前尚无标准指南推荐,部分患者进入临床研究,采用最佳支持治疗。
本文中,四线治疗选择继续服用呋喹替尼联合PD-1抑制剂,主要归于以下几个原因:(1)KEYNOTE-177[4]、CheckMate142等研究,均证实dMMR/MSI-H mCRC是PD-1单抗的优势人群,这也奠定了PD-1单抗一线治疗dMMR/MSI-H mCRC的地位,但全部mCRC 患者中dMMR/MSI-H仅占5%, pMMR/MSS患者约占95%, PD-1/PD-L1抑制剂对pMMR/MSS患者几乎无任何治疗效果[5],这意味一大部分mCRC患者并不能从免疫治疗中获益,远远不能满足临床治疗的需求,因此亟待探索改变pMMR/MSS mCRC患者免疫治疗无应答的困境。(2)Zelenay等[6]在小鼠大肠癌动物模型中,采用PD-1单抗联合抗血管内皮生长因子治疗,结果发现联合治疗后小鼠体内细胞毒性T细胞免疫功能增强,提高CD8+T淋巴细胞向肿瘤细胞内部的浸润,从而提高对PD-1单抗治疗的敏感性。REGONIVO研究[7]采用瑞戈非尼联合纳武利尤单抗治疗晚期三线及三线以上胃肠癌患者,入组的25例mCRC 患者中仅1例为MSI-H,其余24例均为MSS型,结果显示pMMR/MSS mCRC客观缓解率ORR为33%(8/24),中位无进展生存期为7.9个月。王育生等[8]对1例直肠癌肝肺转移MSS患者,三线采用口服瑞戈非尼,三线治疗失败后,四线继续口服瑞戈非尼同时联合PD-1抑制剂, PFS达3个月。(3)呋喹替尼是首个独立由中国人发明、中国医生研究、中国企业生产的抗肿瘤新药。对血管内皮生长因子受体(VEGFR)1、2、3都有强效的抑制作用,在Ⅰ期和Ⅱ期的临床试验中,呋喹替尼显示了其对结直肠癌作用强、毒性低、耐受性好的优势,Ⅲ期的随机、双盲、对照FRESCO研究[9],呋喹替尼中位OS、PFS均完胜安慰剂对照组,同时展现了良好的安全性,通过优先审评审批程序,于2018年9月国家药品监督管理局获批上市。呋喹替尼相较瑞戈非尼价格明显优惠,更容易被广大基层患者接受。基于以上研究结果及原因,笔者三线采用呋喹替尼单药治疗,三线治疗失败进展后,对于体能状态良好,预计生存超过3个月的患者,四线继续口服呋喹替尼,同时联合PD-1抑制,取得了较好的治疗效果。
本研究观察到四线呋喹替尼联合PD-1单抗免疫治疗,DCR较最佳支持治疗组明显延长,除引起血压增高、甲状腺功能异常外,并未因联合用药增加靶向药物和免疫抑制剂的不良反应,临床疗效、安全性良好,且6例使用卡瑞利珠单抗的患者,联合呋喹替尼靶向治疗,反应性毛细血管增生症反而较单用卡瑞利珠单抗减轻。CD4+淋巴细胞为辅助性T淋巴细胞,CD8+淋巴细胞为抑制性T淋巴细胞,二者维持于平衡状态,维持正常的免疫功能。研究发现[10]当CD4/CD8比例降低时,患者免疫功能呈抑制状态,肿瘤微环境呈现为“冷肿瘤”,而当CD4/CD8比例升高时,患者免疫原性增强,免疫功能呈增强状态,肿瘤微环境由“冷肿瘤”转变为“热肿瘤”状态。本研究中治疗前两组患者免疫功能测定无明显差异,治疗后观察组CD3+CD4%、CD4/CD8较对照组升高,CD3+CD8%水平较对照组降低,改善PD-1单抗对pMMR/MSS mCRC无应答。究其原因可能为:联合用药后,血管靶向药物改变肿瘤血管杂乱无章的状态,使肿瘤畸形血管正常化,提高T淋巴细胞向肿瘤组织聚集,从而将肿瘤微环境由免疫抑制型变为免疫增强型。然而本研究纳入的研究对象较少,观察时间较短,因此所得结论可能存在一定的局限性,需要更多的研究及更多的患者进一步证实。同时也提示若将PD-1单抗免疫抑制剂提前至三线,三线联合瑞戈非尼、呋喹替尼、曲氟尿苷替匹嘧啶,能否进一步提高三线单药治疗疗效,呋喹替尼跨线治疗是否会持续获益,还需进一步通过临床验证。
