通心络对高脂血症兔颈动脉外膜微血管新生的影响及机制
2023-07-26刘美之边爱忠王俊林孙爱敏安香珍姚俊叶
刘美之 边爱忠 王俊林 孙爱敏 安香珍 姚俊叶
(1石家庄市人民医院,河北 石家庄 050000;2衡水市景县中医院;3邯郸邯钢医院)
血管新生是在原有毛细血管基础上通过血管内皮细胞迁移、增殖等步骤,以芽生或分隔形式形成新血管的生物学过程。滋养血管主要起源于大动脉外膜的微血管网,这些微血管为动脉管壁外层提供氧和营养物质。血管新生是动脉粥样硬化血管病变的重要特征,外膜微血管新生伴随动脉硬化的病理过程。外膜微血管密度(MVD)增加被认为是斑块形成过程中动脉壁增厚的反应。有证据显示这种增生反应先于内皮功能障碍、内膜形成或斑块形成〔1,2〕。外膜微血管被认为是炎症介质或细胞进入血管壁的通道,最终可导致斑块形成,加速疾病的发展〔3,4〕。抗血管新生治疗可以有效地降低外膜MVD,延缓斑块进展〔5,6〕。神经和血管在组织中构成复杂的分支网络,在解剖和功能方面有着密切联系〔7〕。血管生成过程不仅需要完整的内皮细胞,外周神经系统也是重要参与者。组织学研究发现在动脉外膜与中膜交界处分布着大量去甲肾上腺素能和胆碱能神经纤维,可释放多种神经递质促进血管新生〔8,9〕。在胚胎发育中,血管外周神经可以引导血管分支的结构形成和动脉分化〔10,11〕。神经肽(NPY)、神经生长因子(NGF)是从交感神经释放支配心血管的神经递质,有潜在的促血管新生作用。体外实验证实NPY可以促进人内皮细胞黏附、迁移、增殖和毛细血管管腔形成〔12,13〕。在大鼠后肢缺血模型中,局部应用NPY能够显著增加血管性血友病因子(vWF)和CD31阳性血管的密度,促进缺血组织的血管新生〔14〕。另外有文献报道神经调节似乎参与诱导了新生微血管的成熟和稳定〔15〕。本研究主要探讨通心络对高脂血症兔颈动脉外膜微血管新生的影响及机制。
1 材料与方法
1.1实验动物 普通级健康新西兰白兔,3~4月龄,雄性,平均体质量(2.0±0.2)kg,购自北京富豪实验动物养殖中心,实验动物许可证号SCXK(京)2010-0010。
1.2模型建立及分组、药物治疗 参照文献〔16〕,建立硅胶管包裹兔右颈总动脉模型:3%戊巴比妥钠(1 ml/kg)经耳缘静脉麻醉,待麻醉脱毛后,将兔仰卧位固定于手术台上。常规消毒,铺洞巾。沿其颈部正中线甲状软骨下方剪开皮肤并逐层钝性分离各层,暴露右侧颈总动脉鞘,仔细游离出3~4 cm颈动脉,采用医用硅胶管,长20 mm,内径1.7 mm,外径3.2 mm,纵向切开后包裹于新西兰兔的右颈总动脉,生理盐水冲洗,缝合伤口,局部滴加青霉素钠。术后,连续3 d,1次/d,局部滴加青霉素钠80万U/d,预防感染。
实验兔90只,适应性喂养1 w后,颈动脉套管术后随机分为正常组、模型组、低剂量通心络组、中剂量通心络组、高剂量通心络组和阿托伐他汀组,每组15只。正常组全程给予普通饲料,其余各组给予高脂饲料(配方为胆固醇1%,猪油5%,蛋黄粉7.5%,基础饲料86.5%),饲料由河北省实验动物中心加工定制,每兔每日限量喂食120 g。高、中、低剂量通心络组分别给予通心络超微粉0.60、0.30、0.15 g/(kg·d)。阿托伐他汀组给予阿托伐他汀2.50 mg/(kg·d)灌胃给药。先配制一定浓度的药物,然后按照3 ml/kg体质量标准灌胃。颈动脉套管术后次日开始灌胃给药,正常组、模型组按3 ml/kg体质量标准给予0.5%羧甲基纤维素钠溶液,实验周期为4 w。
1.3标本采集 各组实验动物于4 w末取材,取材前,动物禁食12 h,使用3%戊巴比妥钠1 ml/kg处死动物,获取右颈总动脉,冰生理盐水冲洗后,小心剥离外周附着的结缔组织。取材组织一段置于10%的中性甲醛溶液中固定,留做石蜡切片,备用马松(Masson)染色和免疫组化、免疫荧光实验。整个过程保持无菌操作,动作迅速。另外每组随机选取3只动物,彩色微球实验检测右颈动脉壁微血管血流量。
1.4Masson染色 切片脱蜡至水,铁苏木素染色液(Weigert)5~10 min,1%盐酸酒精分化,丽春红酸性品红液染5~10 min,1%磷钼酸水溶液处理5 min,苯胺蓝液复染5 min,1%冰醋酸处理1 min,95%酒精脱水,无水酒精脱水,二甲苯透明,中性树胶封固。结果为胶原纤维呈绿色,血管壁平滑肌细胞呈红色,胞核呈蓝褐色。
1.5免疫组织化学 采用即用型快速酶免疫组化染色方法检测VEGF、CD31在颈动脉组织的定位和表达。在石蜡切片脱蜡后,将厚度5 μm颈动脉标本切片放入3%过氧化氢(H2O2)溶液,阻断内源性过氧化物酶。用5%牛血清白蛋白(BSA)按一定比例稀释好的一抗(CD31 1∶200 Abcam UK;VEGF 1∶200 Abcam UK)覆盖标本组织,4 ℃孵育过夜。添加辣根过氧化物酶(HRP)标记的二抗覆盖组织,二氨基联苯胺(DAB)显色。苏木素复染细胞核,脱水透明封片,在光学显微镜下观察。结果判定:VEGF阳性染色为位于细胞质的棕黄色颗粒,根据阳性细胞数及阳性信号出现的位置综合判断结果,参照文献〔17〕采用半定量积分法,根据阳性细胞率和阳性细胞着色强度分别记分。CD31阳性着色部位为胞膜或胞质,采用Weidner等〔18〕提出的方法进行CD31标记的MVD量化分析。首先在40倍光镜视野下扫视整个切片寻找微血管高密度集中区域作为“热点”,然后在400倍光镜视野下随机计数5个高倍视野,取其平均值作为该标本的MVD。
1.6免疫荧光 石蜡切片脱蜡至水,抗原修复后,滴加用5%BSA按一定比例稀一抗〔酪氨酸羟化酶(TH)1∶100 Abcam UK;NPY 1∶200 Abcam UK〕覆盖组织,切片平放于湿盒内4 ℃孵育过夜。玻片置于磷酸盐缓冲液(PBS,pH7.4)中在脱色摇床上晃动洗涤3次,每次5 min,滴加与一抗相应种属的二抗覆盖组织,避光室温孵育60 min。将玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5 min。4,6-二脒基-2-苯基吲哚(DAPI)复染细胞核:玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后在圈内滴加DAPI染液,避光室温孵育10 min,切片稍甩干后用抗荧光淬灭封片剂封片,于IX71 荧光倒置显微镜下观察并采集图像。
1.7心肌血流量(MBF)检测 彩色微球血流测量系统(Triton Technology,Inc.,USA)检测颈动脉壁滋养血管的血流量。动物麻醉、固定,股动脉插管,然后剪断二、三、四肋骨,暴露心脏,将0.3 ml含有2.1×105个黄色微球(最大吸光度波长448 nm)悬浮液与0.2 ml 0.05%吐温混合液在10 s内用注射器直接注入左心室。留取血液及组织标本:在微球注射后5 s开始匀速股动脉采血,持续1 min。股动脉采血后立即取右颈总动脉段。血样本及各组织样本分置于提前称重的15 ml或50 ml聚丙烯离心管中。再次称重后计算血样本及组织重量。每个离心管中加入浓度为1.0×105个/ml蓝色微球悬浮液100 μl作为内控。通过强碱溶解,沉降法回收嵌顿在颈动脉组织的微球。使用酸化乙氧乙酸乙酯200 μl萃取微球表面的染料,紫外可见光分光光度计检测吸光度值以计算评估各待测器官或组织的微血管血流量,将所得实验数据输入Triton Technology公司提供的软件,计算出各组MBF。

2 结 果
2.1颈动脉Masson染色 如图1所示,平滑肌细胞被染成红色,胶原纤维呈蓝色。正常组腹主动脉大体观察呈乳白色,内膜平整光滑,未见脂质沉积,模型组腹主动脉段内膜出现多病灶、散在的脂质沉积,脂质成分呈红色,呈斑点或长短不一的条纹,即脂质条纹形成,为动脉粥样硬化早期病变。低、中、高剂量通心络组及阿托伐他汀组不同程度减少腹主动脉内膜的脂质沉积,高剂量通心络组腹主动脉内膜脂质沉积明显减少。

A:正常组;B:模型组;C:低剂量通心络组;D:中剂量通心络组;E:高剂量通心络组;F:阿托伐他汀组图1 各组腹主动脉(油红染色)
2.2颈动脉壁MBF变化 模型组颈动脉管壁血流量MBF较正常组显著升高(P<0.01),与模型组比较,通心络各剂量组和阿托伐他汀组不同程度降低,以高、中剂量通心络组和阿托伐他汀组降低明显(P<0.05,P<0.01),高剂量通心络组较阿托伐他汀组显著降低(P<0.01)。见表1。

表1 各组MVD、VEGF、MBF比较
2.3颈动脉外膜微血管新生 VEGF阳性物为棕黄色颗粒状,主要位于细胞质及细胞外间质中。正常组颈动脉组织内膜、中膜及外膜均可见VEGF少量阳性表达;模型组VEGF在血管各层的阳性表达明显增多,以外膜微血管内皮细胞及周边部位表达阳性;低、中、高剂量通心络组和阿托伐他汀组VEGF阳性表达不同程度上减少。模型组VEGF阳性表达率显著高于正常组(P<0.01),与模型组比较,高、中剂量通心络组和阿托伐他汀干预后,外膜VEGF阳性表达率明显降低(P<0.05,P<0.01),以高剂量通心络组降低最为显著(P<0.01),高、中剂量通心络组和阿托伐他汀组组间比较均无统计学差异(P>0.05)。
正常组颈动脉可见位于颈动脉外膜CD31标记的少量微血管。模型组血管外膜微血管数量明显增多,中膜未见CD31标记的微血管。通心络各剂量组和阿托伐他汀组外膜微血管数量不同程度减少,以高、中剂量通心络组和阿托伐他汀组外膜微血管数量减少较为明显。管壁MVD定量分析显示,模型组MVD阳性标记指数较正常组显著升高(P<0.01),高、中剂量通心络组和阿托伐他汀组MVD阳性标记指数较模型组显著降低(P<0.01),通心络高剂量组较阿托伐他汀组MVD阳性标记指数降低明显(P<0.05)。见表1、图2。
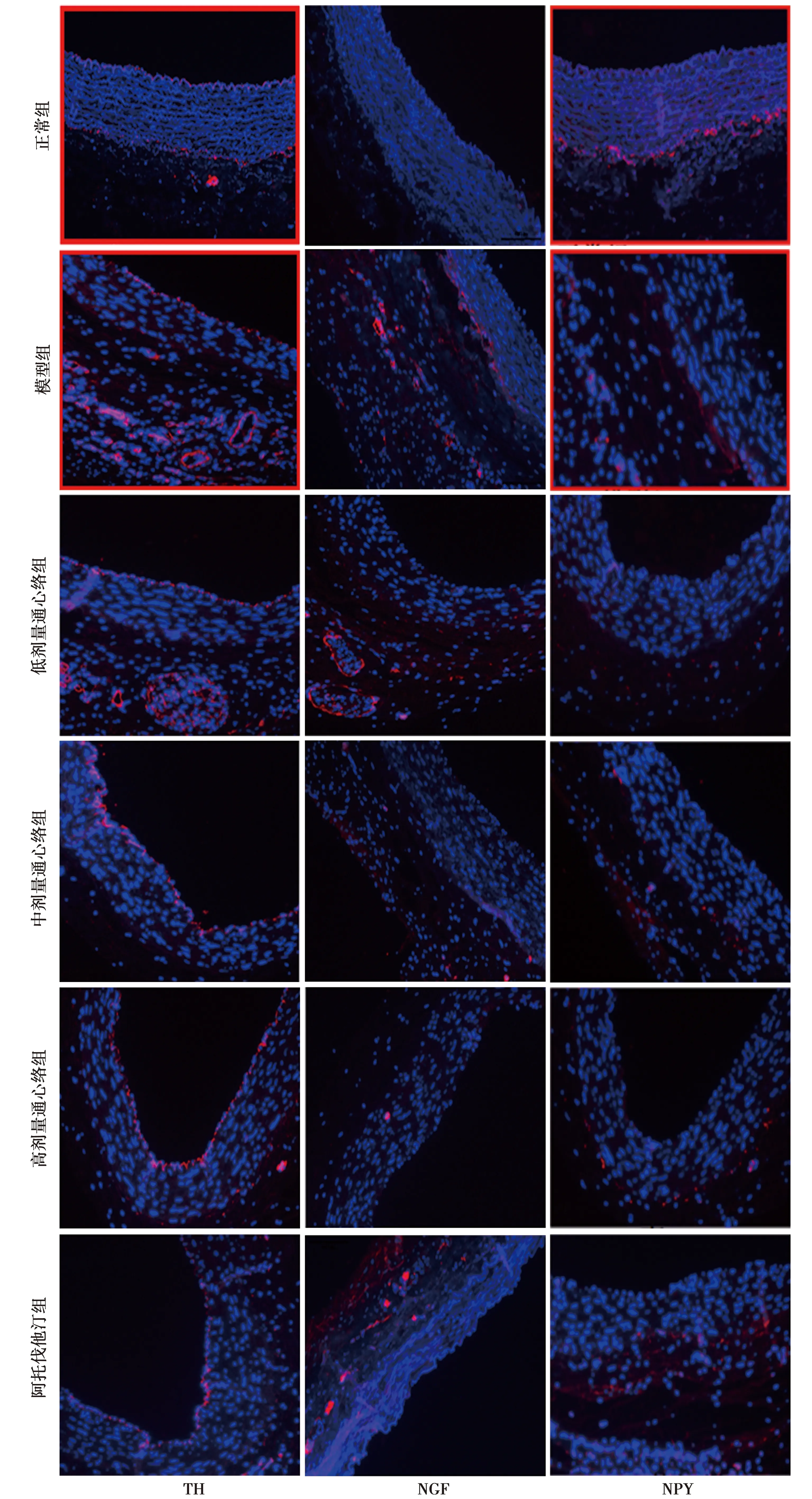
图2 免疫荧光标记TH、NGF、NPY在各组兔颈动脉壁表达(×200)
2.4免疫荧光结果 正常组TH阳性标记的交感神经分布在动脉内膜和中膜-外膜交界区域,模型组外膜微血管周围TH表达显著,通心络各剂量组外膜微血管周围TH表达不同程度减弱。免疫荧光显示NGF、NPY在颈动脉管壁的定位及表达,模型组外膜微血管周围NGF和NPY阳性表达明显增多,通心络各剂量组外膜区域NGF、NPY的阳性表达不同程度下降。见图2。
3 讨 论
本研究发现,通心络在一定程度上抑制高脂血症兔颈动脉外膜抑制外膜微血管新生,下调VEGF和CD34阳性表达,减少微血管血流量,及抑制血管外膜神经内分泌因子NGF及NPY的表达。因此推测高脂血症兔颈动脉外膜微血管的新生,可能与降低外膜神经内分泌因子表达有关。
新生内膜形成或内膜增生是动脉粥样硬化和再狭窄的重要病理标志,与外膜滋养血管有关。外膜血管新生被认为是斑块不稳定的因素,促进了新生内膜形成。实验数据显示,长期应用血管新生抑制剂,可以抑制动脉粥样硬化病变进展〔19〕。其他数据证明了血管新生的程度与斑块大小的相关性。血管新生是促血管新生因子与抗血管生成因子相互作用的结果。VEGF是血管新生的主要调节因子,VEGF治疗明显增强了斑块的发展〔20〕。血管新生作为一种代偿机制,会重新分配动脉壁微血管血流量。本研究采用彩色微球检测了颈动脉壁微血管血流量变化,研究数据显示外膜血管新生驱动滋养血管的血流量的增加,通心络降低了动脉壁微血管血流量。微血管血流量的减少可能潜在减轻了新生内膜增生,滋养血管新生在新生内膜形成的作用,可以在之前的研究中得到证明〔21〕。
交感神经似乎一定程度上刺激了外膜微血管新生,TH免疫荧光显示滋养血管周围存在交感神经末梢,提示交感神经与外膜血管新生可能具有一定联系。模型组外膜微血管新生最显著,而NPY、NGF的表达也最明显,通心络各剂量治疗组NPY、NGF表达不同程度下降。颈动脉外膜区域存在着交感神经末梢,因此推测在外膜神经末梢释放神经内分泌因子会刺激微血管的新生。通心络胶囊具有益气活血,化瘀通络止痛的功效,方中人参味甘微苦,性温,补益心气,使气旺血行,为君药;水蛭活血化瘀,通经透络;土鳖虫逐瘀通络;全虫、蜈蚣、蝉蜕虫类药,善于走窜解痉,引诸药通经透络,共为臣药,现代医学研究显示蜈蚣、全蝎等虫类药与调节神经内分泌密切相关〔22~24〕;赤芍活血化瘀止痛;冰片芳香走散,疏通经络,共为佐使药。因此推测通心络抑制外膜微血管新生可能与通过影响调节下调神经内分泌因子表达相关,尚需后续深入研究。
