盐酸大观霉素盐酸林可霉素可溶性粉制剂工艺与稳定性考察研究
2023-07-25程海鹏杨近越耿久荣
程海鹏 杨近越 耿久荣

摘 要:盐酸大观霉素盐酸林可霉素可溶性粉是《中国兽药典》上为数不多的复方抗生素兽药,抗菌谱和活性比单方制剂更广更强,是抗生素联合应用的典范之一。市售部分产品采用粉碎工艺增加溶解性,有些采取添加抗结剂防止板结,少量产品进行辐照灭菌后用于注射。本文就盐酸大观霉素盐酸林可霉素可溶性粉的制剂工艺及其产品稳定性进行了试验研究,以期能对本品制剂工艺和现场使用有一定指导作用。
关键词:盐酸大观霉素;盐酸林可霉素;制剂工艺;临床应用
中图分类号:S943 文献标识码:B 文章编号:1673-1085(2023)07-0001-08
盐酸大观霉素盐酸林可霉素可溶性粉可用在5~7日龄雏鸡革兰氏阴性细菌、革兰氏阳性细菌及支原体感染[1],能有效控制雏鸡大肠杆菌和支原体混合感染,有效防控气囊炎和心包炎[2]。罗永江等[3]发现,盐酸林可—硫酸大观霉素可溶性粉在治疗霉形体病或与大肠杆菌混合感染时显效较快,无明显毒副作用,是理想的抗禽霉形体的复方药。田玲等[4]用盐酸大观霉素盐酸林可霉素注射液治疗仔猪腹泻,结果治愈率达到96.7%,总有效率达到100%,显著好于痢菌净和氟苯尼考。章寿民等[5]发现林可—壮观合剂能有效防治猪支原体肺炎。盐酸林可霉素-硫酸大观霉素混悬注射液除具有治疗作用外,还能促进猪、鸡生长及显著改善饲料报酬,使料肉比降低 5.39%[6]。
大观霉素对部分支原体(如鸡毒支原体、火鸡支原体、滑液支原体等)敏感,对多种革兰氏阴性菌有抑制作用[7];作用于细菌核蛋白体30s亚单位,有效抑制细菌细胞蛋白质合成[8]。大观霉素有关物质来源于发酵过程,主要有(4R)-双氢大观霉素和(4S)-双氢大观霉素,前者是有效组分,后者为杂质[9-10]。大观霉素对热较敏感,尤其水溶液中半缩酮结构非常不稳定,易发生开环和闭环[11]。盐酸林可霉素主要针对革兰氏阳性菌,抗菌性可与大观霉素有效协同,对一部分革兰氏阴性菌也有一定抗性[6];容易富集于骨组织,对各种厌氧菌有很好的抗菌作用[12]。林可霉素与细菌核糖体的 50s亚基相互作用,抑制细菌的蛋白质合成[7]。盐酸林可霉素理化性质非常稳定,在70 ℃保质期可以到6个月,并且保存过程中无需遮光,其水溶液在室温下保持2年不失活[13]。
因大观霉素内服吸收率仅7%,林可霉素生物利用度为30%~40%[7],两者口服生物利用度都比较低,所以临床经常溶于油乳剂灭活疫苗注射使用。盐酸大观霉素结晶水多(5个结晶水,水分16%~20%)[1],使得盐酸大观霉素盐酸林可霉素可溶性粉含水分高,在生产、储运和使用过程中极易结块变色,发生性状、有关物质和含量等指标的变化,甚至出现不符合质量标准的情况。本文就盐酸大观霉素盐酸林可霉素可溶性粉不同制剂工艺和生产条件对产品稳定性的影响进行试验,以确定更好的工艺条件,避免不恰当的生产方式给产品带来不利影响。
1 仪器与试药
1.1 仪器
安捷伦高效液相色谱仪1260II[G7111A型号四元泵,G7129A型号自动进样器,G7116A型号柱温箱,G7114A型号检测器,C.01.10(287)版本色谱工作站],抑菌圈测量仪(北京先驱威锋技术有限公司),生化培养箱(德国宾德),水分測定仪(北京先驱威锋技术有限公司),十万分之一天平(梅特勒公司),薄层成像系统(德国德赛克科技有限公司)。
1.2 试验药品及试剂
大观霉素标准品,中国兽医药品监察所,批号:K0261705,效价:644单位/mg。林可霉素,中国兽医药品监察所,批号:K0102002,含量:84.9%。其余试剂:甲醇,色谱级;硼砂、磷酸、磷酸氢二钾、磷酸二氢钾,都为分析纯。
2 样品及方法
2.1 样品的制备
盐酸大观霉素盐酸林可霉素可溶性粉,规格:5 g;大观霉素2 g(200万IU)与林可霉素1 g(按C18H34N2O6S计)。原料:盐酸大观霉素,批号3232009035,山东鲁抗医药股份有限公司。盐酸林可霉素,批号190122022,河南天方药业有限公司。
2.1.1 样品1 盐酸大观霉素、盐酸林可霉素和葡萄糖粉按《中国兽药典》中本品制法制作样品,完成配制、混合,并即时用市售产铝箔袋(单面14丝,PET 2丝+VMPET 2+PE 8丝+PET 2丝)分装封口。生产环境湿度45%±5%,温度21℃±2℃,标记为样品1,三批的批号分别为21010401、21010402、21010403。
2.1.2 样品2 制样环境同样品1。按样品1制法,混合后在平盘均匀放置,厚度不超过0.5 cm,在环境湿度65%±2%暴露4 h,标记为样品2,三批的批号分别为21010501、21010502、21010503。
2.1.3 样品3 制样环境同样品1。盐酸大观霉素、盐酸林可霉素和葡萄糖粉分别进行粉碎,全部通过六号筛(100目),再完成配制、混合,并即时用市售产品铝箔袋分装封口,标记为样品3,三批的批号分别为21010601、21010602、21010603。
2.1.4 样品4 制样环境同样品1。制样过程中用羟丙基倍他环糊精替代总制样量中6%葡萄糖粉,增强产品抗结性,标记为样品4,三批的批号分别为21010701、21010702、21010703。
2.1.5 样品5 制样环境同样品1。 按样品1制法,用塑料袋(单面15丝,PE3丝+PET12丝)包装封口后,在北京鸿仪四方辐射技术股份有限公司经60Co-r射线用5kGy辐照剂量灭菌0.5 h,标记为样品5,三批的批号分别为21010801、21010802、21010803。
2.2 试验方法
加速试验:按照《中国兽药典》在温度40℃±2℃,相对湿度75%±5%的条件下放置6个月。在试验期间第0、1、2、3、6个月取样检测[1]。
依据《中国兽药典》中盐酸大观霉素盐酸林可霉素可溶性粉的质量标准,考察5个样品稳定性,监测性状(白色或类白色粉末)、外观均匀度(色泽均匀,无花纹与色斑)、粒度[100%通过五号筛(80目)]、水分(小于等于15%)、林可霉素B含量(不得超过林可霉素与林可霉素B峰面积和的5.0%)、大观霉素含量(应为标示量的90.0%~110.0%)和林可霉素含量(应为标示量的90.0%~110.0%)[1]。
3 试验结果
3.1 稳定性结果
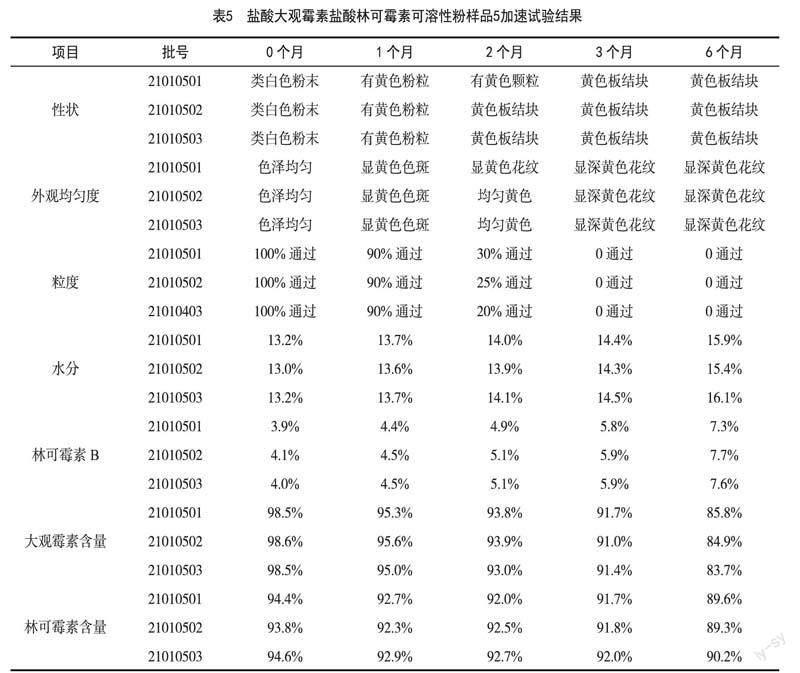
样品1、样品2、样品3、样品4、样品5的加速试验结果分别见表 1、表2、表3、表4、表5。
表1样品1结果显示,在符合兽药GMP要求的环境和规程条件下生产的盐酸大观霉素盐酸林可霉素可溶性粉,在6个月考察期中,各监测项均符合质量标准要求。其中,水分、林可霉素B略有上升,大观霉素和林可霉素含量有较明显下降。
样品2模拟生产或使用过程产品在较高湿度环境下静态裸露4 h,从3个月开始,性状、外观均匀度和粒度项均不符合标准要求。虽然水分项始终合格,但在0~6个月时所有指标均比样品1有明显提高。
样品3参考部分企业的工艺对所有物料都进行粉碎,以增加溶解度。在6个月时,样品3的性状、外观均匀度和粒度项均不符合标准要求。样品3的稳定性好于样品2,说明物料粉碎全部通过六号筛,对稳定性的影响小于产品暴露在湿度65%±2%的环境4 h。但样品3的稳定性,明显低于样品1。
样品4添加了水溶性抗结剂,各时间段的所有项目都符合要求。结果显示各项优于样品1,明显优于样品2和3。
样品5参考个别企业的工艺对产品进行辐照灭菌,便于临床应用于注射,发现辐照灭菌对产品稳定性产生了非常明显的影响。其中,性状、外观均匀度和粒度在1个月时不符合标准要求,6个月时所有项目基本都不达标。
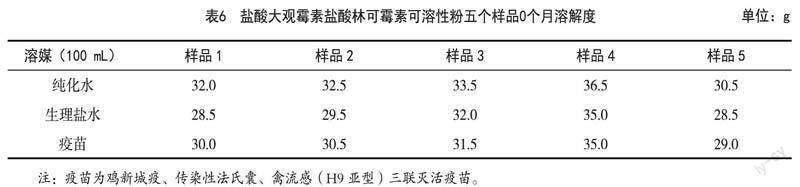
3.2 溶解性
样品1~5号0个月溶解度见表6。
4 结论
(1)盐酸大观霉素盐酸林可霉素可溶性粉生产过程中,如样品1按照兽药GMP要求严格控制物料裸露环境的温湿度,试验结果皆符合要求。样品2在六个月考察过程中,水分项都符合要求;但在3个月时,产品中出现黄色粉粒,外观均匀度检测发现黄色色斑,不符合要求。
(2)通过粉碎(100%通过五号筛提高到通过六号筛)有助于提高产品溶解性,纯化水中样品3溶解度比样品1增加了1.5 g。但因物料表面积增加,吸湿性增强,在6个月时性状、外观均匀度和粒度都不符合要求。
(3)产品中添加6%羟丙基倍他环糊精,比较明显地增强了产品的稳定性和溶解性。在长期稳定性考察过程中,36个月时样品1和4依然合格,但样品4各项指标变化幅度更小、更稳定,同时溶解性依然最优。
(4)盐酸大观霉素盐酸林可霉素可溶性粉经60Co-r用5kGy辐照灭菌,无菌检测项符合要求,但对产品稳定性造成了极大影响。产品在1个月时,性状、外观均匀度和粒度都不符合要求;林可霉素B在3个月时两批不符合要求;基本所有项目在6个月时都不符合要求。含水量高的制剂,因照射而产生水的辐照分解物H和OH自由基或H2O2、H2O過氧基等,都会快速增加有机成分的分解率。因此,水分含量高的兽药产品,很难既灭菌消毒又能保全产品[14]。
(5)林可霉素中有A、B等组分,其中林可霉素中A有最高的药效和最低的毒性;但林可霉素B组分,其药效只有A组分的四分之一,而毒性要大很多,而且B组分是生产林可霉素最主要的副产品[15]。林可霉素在不同pH值和温度范围内降解机理不同,会降解为含林可霉素B在内的有关物质,降解反应服从一级反应动力学规律。降解为需能过程,给予能量会提高降解速度[16-17]。
盐酸大观霉素盐酸林可霉素可溶性粉水分高,生产储运过程中控制不当容易出现有效期内产品不合格的情况,稳定性明显差于盐酸大观霉素盐酸林可霉素预混剂[100 g:(2.2+2.2)g]。预混剂稳定性试验结果显示,林可霉素含量下降不高于1.59%,大观霉素含量下降不高于1.08%,其他项目变化不明显[18]。分析原因应是预混剂含量低、产品水分少以及性状为淡褐色导致有色度微小变化表现不明显等有关。上述试验结果确认了本品生产过程中需要严格控制环境温湿度和物料暴露时间,即温度控制在18~23℃、湿度为35%~50%,仅在除尘投料口和制剂分装过程中瞬时暴漏,保证在兽药GMP规范要求的相对封闭设备中完成自动化生产。本品适宜用粒度达标的盐酸大观霉素、盐酸林可霉素、水溶性抗结剂和所需葡萄糖等原辅料直接混合包装,不宜用或粉碎为过细物料,否则影响产品稳定性。如果能适量添加水溶性抗结剂,有助于提高产品的稳定性和溶解度,严禁对本品进行辐照灭菌,否则将很快失效。储运过程中也要遵守常温密闭保存的要求,才能保证产品始终符合标准要求。希望通过本试验,给予盐酸大观霉素盐酸林可霉素可溶性粉生产、储运和使用环节一些指导,使得产品能有更好的临床效果。
参考文献:
[1] 中国兽药典委员会.中国兽药典(一部)(2020年版)[M].北京:中国农业出版社,2020(S1):224.
[2] 李清泉,王忠.林可霉素与大观霉素复方制剂的临床应用[J].兽医导刊,2012:94-95.
[3] 罗永江,胡振英,郑继方,等.盐酸林可霉素—硫酸大观霉素治疗鸡霉形体和大肠杆菌混合感染的疗效试验[J].甘肃畜牧兽医2004(5)::8-9.
[4] 田玲,刘澜,杜继红,等.盐酸大观霉素盐酸克林可霉素注射液对仔猪保健及治疗断奶仔猪腹泻的临床效果观察[J].中国兽医杂志,2010,46(9):68-69.
[5] 章壽民,肖达,李龙瑞.林可-壮观霉素合剂在兽医临床上的应用[J].中国兽医科技,1997(11):37-38.
[6] 范惠敏,王忠,王立琦,等.盐酸林可霉素-硫酸大观霉素混悬注射液在猪体内的药动学研究[J].华南农业大学学报,2012(33)2:244-252.
[7] 中国兽医药品监察所.《中国兽药典》兽药产品说明书范本——化学药品卷(2020年版)[M].北京:中国农业出版社,2020:216-217.
[8] 李眉,陈惠贞.大观霉素的药理和临床应用[J].中国新药杂志,1993(02):11-15.
[9] Hoebus J,Yun L M,Hoogmartens J.An improved gas chromatographic assay for spectinomycin hydrochloride[J].Chromatographia,1994,39:71-73.
[10] Phillips J G,Simmonds C.Determination of spectinomycin using cation-exchange chromatography with pulsed amperometric detection[J].Journal of chromatography A,1994,675:123-128.
[11]王琰,姚尚辰,王明福,等.HPLC-PAD法测定盐酸大观霉素含量及有关物质[J].中国抗生素杂志,2014,6(39):439-446.
[12] 楚文南.洁霉素类抗生素的临床应用[J].中国临床医生杂志,1990(8):44-45.
[13]戴自英.实用抗菌素学[M].上海:上海人民出版 社,1977:250.
[14]刘琼英.辐照技术在药品灭菌消毒中的应用[J].国外医药.药学分册,1987(5):284-286.
[15] 魏宇.盐酸林可霉素多晶型与结晶过程研究[D].天津:天津大学化工学院,2019:1-2.
[16]王怀友,任建成,刘连栋,等.林可霉素降解动力学研究[J].山东:山东师大学报(自然科学版),1993(2):47-49.
[17]任建成,齐登福,刘连栋,等.林可霉素水溶液的化学稳定性研究[J].山东:山东师大学报(自然科学版),1995(3):284-286.
[18]赵春蕊,张素卿,吉利伟,等.盐酸林可霉素硫酸大观霉素预混剂质量一致性评价研究[J].畜禽业,2022(6):27-29.
Spectinomycin Hydrochloride and Lincomycin Hydrochloride Soluble Powder Preparation Technology and Stability Study
CHENG Haipeng,YANG Jinyue,GENG Jiurong
(Beijing Kang Mu Biotechnology Co., LTD,Beijing 101109, China)
Abstract: Spectinomycin hydrochloride and lincomycin hydrochloride soluble powder is one of the few compound antibiotic veterinary drugs listed in the Chinese Veterinary Pharmacopoeia. Its antibacterial spectrum and activity are broader and stronger than that of monotherapy preparation, and it is one of the models of antibiotic combined application. Some products on the market adopt grinding technology to increase the solubility while others adopt the addition of anti-caking agent to prevent binding, and a small number of products are sterilized by irradiation for injection. In this paper, the preparation technology and stability of spectinomycin hydrochloride and lincomycin hydrochloride soluble powder were studied in order to provide some guidance for the process and field use of this product.
Keywords: Spectinomycin hydrochloride; Lincomycin hydrochloride; Preparation process; Clinical application
