大鼠坐骨神经射频热凝神经病理性疼痛模型的建立
2023-07-23刘彦朋黄科昌任占杰
刘彦朋 张 瑞 孙 柏 徐 赓 黄科昌 任占杰△
(1 潍坊医学院麻醉学院,潍坊 261053;2 潍坊护理职业学院,潍坊 261041;3 潍坊医学院附属医院疼痛科,潍坊 261000)
神经病理性疼痛是由躯体感觉神经系统的损伤或疾病引起的疼痛[1],其发病率高,在普通人群中约占7%~8%[2],且疼痛严重,并常表现为灼烧样、针刺样的自发性疼痛,常伴有疼痛区域的感觉异常,甚至伴有睡眠障碍、抑郁焦虑等身心健康问题,其发病机制复杂[3]。目前针对不同的损伤机制,已经存在许多神经病理性疼痛模型,如坐骨神经慢性卡压损伤、糖尿病周围神经损伤模型、臂丛神经撕脱等外周神经损伤模型。
热效应治疗已在临床广泛应用。常见的热效应治疗方式包括微波消融术、射频热凝术、经皮激光消融术和高强度聚焦超声等,其工作机理均是通过不同的能量方式产生局部热效应作用于靶组织,通过高温作用使组织凝固坏死达到灭活细胞和组织的目的。另外临床手术过程中,为满足视野要求,术中使用热凝止血时,由于器械头部的高温以及应用过程中的横向热扩散作用,导致医源性热损伤的发病率有所增加[4],因此热损伤已成为周围神经损伤的常见原因,并由此引发病人术后出现神经性疼痛[5]。与牵拉、卡压损伤类似,热损伤通常难以发现和识别,其后果可能更加不可逆[6]。正因如此,治疗后神经损伤的并发症以及神经病理性疼痛的发生也随之增多[5,7,8]。
既往有关于热效应对动物神经损伤的研究,发现40℃、5 min 不会对猪的神经根功能产生任何影响,而70℃、5 min 则会导致神经根功能完全阻滞,不同温度对神经损伤的程度不同,且与温度的增高呈正相关,说明温度的高低在神经损伤过程中有决定性的作用[9]。对于损伤的机制,既往的研究发现大鼠周围神经的温度在58℃以上时会对神经内膜造成破坏,引起损伤,但在58℃下,无髓神经纤维电位最先消除并且发现了无髓神经纤维的变性,揭示了无髓神经纤维在高温下更易损伤[10,11]。但另外的研究显示,在组织病理学观察中,髓鞘是神经纤维中较为脆弱的部分[12],在44℃、30 min 热处理后,观察到大量轴突出现脱髓鞘,同时其他的神经结构保持正常[13]。这些发现反映了不同温度及热效应时间对神经的损伤不同,同时其损伤机制可能也存在差异。并且有研究显示传导痛觉的神经纤维较运动纤维更易受到热效应的损伤,这可能与神经热损伤后病理性神经痛的发生密切相关[14]。由于缺乏神经热损伤动物模型,使得临床中出现的热损伤后神经痛缺乏相关基础研究。本研究通过射频热凝技术的热效应处理模拟临床中存在的相关热损伤后神经痛病人的发病过程,由此创建一种新型的稳定的热损伤后神经病理性疼痛模型,并探讨可能存在的发病机制,为临床中热效应治疗后并发的神经痛的预防与治疗提供依据。
方 法
1.动物及饲养
成年雄性SD 大鼠44 只(220~250 g),以2~3只为一组饲养在塑料盒中,大鼠由济南朋悦实验动物繁育有限公司提供,生产许可证号:SCXK(鲁)20190003。动物房及行为实验室温度为23~26℃,相对湿度40%~60%。为保证动物的生物节律,实行12 小时的光照/黑暗循环环境设定,并自由摄取食物和水。本研究过程严格按照2006 年科技部颁发的《关于善待实验动物的指导性意见》及潍坊医学院动物实验的相关管理规定(伦理批号2020SLD137)。
2.主要设备及试剂
射频热凝电极套管针(德国英诺曼德医疗科技有限公司,批号:LOT19B051D, 编号/型号:240100,规格:22G-50 mm-4 mm),射频手术电极(北京北琪医疗科技股份有限公司,型号:CD2201,规格:4 mm-50 mm),射频控温热凝器R-2000B D1(北京北琪医疗科技股份有限公司),PL-200 热刺痛仪(成都泰盟科技有限公司),vonFrey 纤维丝(Aesthesio),多样品组织研磨仪Tissuelyser-48 L(上海净信实业发展有限公司),高速冷冻离心机Neofuge 13 R(力康发展有限公司),微量离心机(赛默飞世尔科技有限公司),生物安全柜(上海力申科学仪器有限公司),核酸蛋白分析仪Nanodrop 2000 c(赛默飞科技有限公司),Light-Cycler 480 II实时荧光定量PCR 仪(罗氏诊断产品有限公司),TRLZOL Reagent RNA 提取试剂(赛默飞科技有限公司),无水乙醇500 ml(烟台远东精细化工有限公司),异丙醇500 ml(天津科茂化学试剂有限公司),高效切片石蜡(上海华灵康复器械厂),4%多聚甲醛通用型组织固定液(Biosharp)等。
3.实验方案
将24 只SD 大鼠按随机数字表法随机分成4 组,每组6只。假手术组(Sham组)仅进行手术相关操作,不采取射频热凝处理。其余三组设定不同的射频温度,分别为55℃(RF55)组、65℃(RF65)组和75℃(RF75)组。术后观察大鼠行为学变化。根据行为学观察,选择出最佳造模温度。再根据最佳温度(65℃)另取20 只大鼠随机分为2 组:假手术组(Sham 组)和模型组(RF65组),每组10 只,14 天后观察大鼠坐骨神经病理切片及背根神经节Nav1.8 mRNA的表达。
4.手术操作及射频热凝处理
应用腹腔注射戊巴比妥钠(实验室提供,50 mg/kg)对大鼠进行麻醉。大鼠取俯卧位,伸展大鼠四肢,固定于固定架上。取大鼠右侧股骨附近清理表层鼠毛,碘伏消毒3 遍,铺洞巾,在右侧股后正中纵切6~8 mm 切口。暴露皮下肌肉,用止血钳钝性分离肌肉后,暴露出粗大的、乳白色的坐骨神经,神经刺激后出现右足抽动,说明坐骨神经选择正确。于神经分叉处向上1 cm 处放置射频热凝穿刺针,使用双极模式,两穿刺针之间间隔5 mm,将射频热凝电极套管针的电极导线连接射频治疗仪,针尖贴近大鼠坐骨神经。RF55组、RF65组和RF75组分别采取55℃、65℃和75℃,其余射频参数为:脉率2 Hz、脉宽20 ms、持续时间 1 min,重复进行2 次射频热凝,间隔5 min。手术结束后将坐骨神经归位,整理肌肉,缝合创口。本实验由专人进行,保证手术方式和处理方式的一致。
5.行为学观察
行为学实验均在白天进行,测试都固定在每日9:00~12:00 之间进行,实验前3 天每日将大鼠置于行为学观察箱中适应。术前、术后1、3、5、7、10、15、20、25、30、35、40 天进行机械刺激缩足反射阈值(mechanical withdrawal threshold, MWT) 和热缩足反射潜伏期(thermal withdrawal latency, TWL)测试。于术前、术后1、3 天分别观察大鼠后爪休息时姿势(assessments of resting paw posture)评价大鼠自发性痛行为和大鼠右下肢运动功能变化。
MWT 是测定大鼠机械痛阈值的重要指标[15],为消除大鼠心理因素对测试结果的影响,于测试前将大鼠放于测试箱内15~20 min,实验环境控制在(23±2)℃,实验室维持在安静环境。然后在底为有孔金属网格的相互隔开又透明的容器内,选用不同质量的vonFrey 纤维丝垂直刺激大鼠右侧后爪外侧部,设置单位为g,从小强度刺激开始,逐步上升,每个压力刺激10 次,间隔3~5 s,10 次刺激中有5 次以上发生缩足、抖动与舔足反应的刺激强度,即为大鼠的MWT。TWL 是测定大鼠对热痛刺激的重要指标[16],测试前将大鼠处于静息状态15~20 min,实验环境控制在(23±2)℃,实验室维持在安静环境。大鼠置于有机玻璃罩内,通过PL-200 热刺痛仪辐照大鼠的足底,设置参数为强度60%,每次连续光热刺激不超过30 s,单位为s。当大鼠出现快速抬足反应时,记录开始照射至出现缩足逃避反应的时间,重复测量5 次,每次间隔时间不低于5 min,取5 次平均值作为该大鼠的TWL。
实验前将大鼠放于试验箱中适应30 min 以上,在经射频热凝处理后,于术前、术后1、3 天观察20 min 大鼠后爪休息时姿势,评价大鼠自发性疼痛程度[17]。评分标准:大鼠后足可正常平放地面上记0 分;大鼠后足平放地面,足趾并拢向下记1 分;大鼠后足仅后爪内侧缘着地记2 分;大鼠仅有后跟触地,足趾向内卷起记3 分;大鼠全脚抬高,远离地面记4 分;大鼠出现舔舐足部的表现记5 分。
选取各组大鼠于术前、术后1、3 天行改良的Tarlov 评分[18],观察射频前后大鼠手术侧肢体活动及功能的改变,判断神经的损伤程度。评分标准:大鼠完全瘫痪评0 分;大鼠完全瘫痪,对下肢针刺有反应,但肢体不能移动评1 分;虽然四肢可以移动,但不能站立或只能稳定站立(< 5 s)评2 分;大鼠可以站立,但不能行走评3 分;大鼠可以行走几步,但不能稳定行走评4 分;大鼠可以缓慢行走,但行走不灵活,有一些缺陷评5 分;大鼠能正常行走评6 分。
6.组织形态学观察
根据射频热凝后大鼠行为学观察,发现RF65大鼠神经病理性疼痛临床表现较为典型,且具有较强的稳定性,遂选择65℃作为最佳造模温度对模型进行复制。模型复制后14 天,对Sham 组和RF65组大鼠取材,取大鼠L4~L6背根神经节于-80℃冻存,行Nav1.8 mRNA 分析。取大鼠损伤侧坐骨神经行石蜡包埋,制备成5 μm 的切片进行苏木精-伊红 (hematoxylin-eosin, HE)染色,光镜下观察坐骨神经结构。
7.Nav1.8 mRNA 测定
采用RT-PCR 分析L4~L6背根神经节Nav1.8 mRNA 含量。将冻存背根神经节按Trizol 法进行RNA 提取,分光光度法对提取的RNA 进行质和量的鉴定。按照FastPure Cell/Tissue Total RNA Isolation Kit V2 试剂盒说明书行逆转录获得cDNA,再对Nav1.8 基因与内参β-Actin 基因进行扩增。扩增后行水平电泳,用图像分析系统进行半定量分析。
引物序列如下:Nav1.8 上游引物:5'-GCCATTCCTCTCACTGTTCC-3',下游引物:5'-CTTCT CTCATTGGCGTTTTTG-3',扩增片段长345 bp;β-Actin上游引物:5'-AGGGAAATCGTGCGTGAC-3',下游引物:5'-CATGGATGCCACAGGATTC-3',扩增片段长211 bp。引物由华大基因公司合成提供。
8.统计学分析
采用SPSS 25.0 软件进行数据处理和分析,对数据进行正态性检验,对符合正态分布的数据进行数据分析,计量资料以均数±标准差(±SD)表示,多组间比较使用重复测量方差分析,两组间比较采用独立样本t检验,以P< 0.05 为差异有统计学意义。
结 果
1.MWT 测定
Sham 组整个观察期间MWT 无明显变化,在到达刺激阈值时仅有短时间的回缩躲避反应。射频热凝术后的大鼠对于机械痛的刺激出现较长时间躲避刺激的反应。RF55组术后3~10 天MWT 较术前降低(P< 0.01),但术后15 天即可恢复术前状态;与Sham 组对比,术后3~10 天差异有统计学意义(P< 0.05)。RF65组术后1 天MWT 升高,5~30 天MWT 降低(P< 0.05),35 天大鼠MWT 回归术前水平;与Sham 组对比,5~30 天对比差异有统计学意义(P< 0.05)。RF75组,3~15 天MWT 明显增高(P< 0.05),在整个观测期间,MWT 未见降低的现象;3~10 天与Sham 组对比差异有统计学意义(P<0.05,见图1)。

图1 大鼠机械痛阈值变化比较*P < 0.05,**P < 0.01,与Sham 组相比;#P < 0.05,##P < 0.01,与术前相比Fig.1 Comparison of mechanical withdrawal threshold of rats between different group*P < 0.05, **P < 0.01, compared with group Sham;#P < 0.05, ##P < 0.01, compared with 0 day.
2.TWL 测定
整个观察期间,Sham 组TWL 未见明显变化,RF55组TWL 于术后1 天有延长(P< 0.05),7~15天较术前有明显缩短(P< 0.05),第20 天恢复术前水平;与Sham 组对比,7~15 天有明显的缩短(P< 0.05)。RF65组术后1~3 天TWL 较术前有明显的延长(P< 0.01),7~30 天TWL 较术前有明显的缩短(P< 0.05),35 天恢复术前水平;与Sham 组对比,术后1~3 天期间TWL 有明显的延长(P< 0.05),7~25 天TWL 有明显的缩短(P< 0.01)。整个观测期间RF75组大鼠TWL 均明显长于术前(P< 0.01),且与Sham 组对比,TWL 均显著延长(P< 0.01,见图2)。

图2 大鼠足底热痛刺激潜伏期变化比较*P < 0.05,**P < 0.01,与Sham 组相比;#P < 0.05,##P < 0.01,与术前相比Fig.2 Comparison of thermal withdrawal latency of rats between different group*P < 0.05, **P < 0.01, compared with group Sham;#P < 0.05, ##P < 0.01, compared with 0 day.
3.术后自发性痛
大鼠术后清醒后,经射频热凝处理的当天,抬足舔足次数较术前增加不明显,但从术后1 天开始自发性舔足次数增加,并出现啃咬术侧足部脚趾的情况。RF55、RF65和RF75组术后1 天的自发性痛评分分别为0.88±0.35、1.38±0.14 和1.94±0.77,术后3 天分别为2.33±0.54、3.08±0.26 和3.83±0.25,差异具有统计学意义(P< 0.01,见图3)。在休息姿势时,射频后大鼠间歇性地突然舔术侧后爪,同时用嘴轻轻咬或拉指甲。这种行为开始于术后1 天,在术后20 天内常见,但在25~40 天频率降低。RF65和RF75组出现自噬现象,消融后3~7 天最明显,常见滴血、反复啃咬状态,术后20 天大鼠自噬减少,伤口结痂愈合。手术侧大鼠足部多弯曲,脚趾聚拢,后爪外翻。

图3 大鼠休息时爪姿势评分比较**P < 0.01,与Sham 组相比;##P < 0.01,与术前相比Fig.3 Comparison of assessments of resting paw posture of rats between different group**P < 0.01, compared with group Sham; ##P < 0.01,compared with 0 day.
4.运动功能评分
射频热凝后,Sham 组大鼠运动功能未见有明显异常,而经过射频热凝的大鼠手术侧肢体活动减少,RF55、RF65和RF75组Tarlov 评分术后1 天较术前对比均出现差异(P< 0.05),术后3 天仅RF75组较术前有差异(P< 0.01)。RF55组大鼠术后,能正常行走和着地。RF65组大鼠后爪外翻,能正常行走,行走时后爪的内侧边缘与地板接触,后足受力向健侧偏移。RF75组大鼠还出现肢体拖曳和下肢肿胀的情况,运动功能明显受累。与Sham 组比较,RF65组术后1 天Tarlov 评分差异有统计学意义(P< 0.05),RF75组术后1 天和3 天差异均有统计学意义(P< 0.01,见图4)。

图4 大鼠运动功能变化比较*P < 0.05,**P < 0.01,与Sham 组相比;#P < 0.05,##P < 0.01,与术前相比Fig.4 Comparison of Tarlov scoring of rats between different group*P < 0.05, **P < 0.01, compared with group Sham;#P < 0.05, ##P < 0.01, compared with 0 day.
5.组织形态学观察
根据既往确定的最佳造模温度,对模型进行复制,观察模型组大鼠坐骨神经的神经病理变化。Sham 组大鼠坐骨神经纤维排列相对规整,神经纤维粗细、走行较为一致,神经组织结构较为完整。而RF65组大鼠局部损伤明显,出现了神经断裂,空泡增多,组织水肿的情况,神经组织结构疏松。说明65℃射频热凝对神经造成了一定程度的损伤(见图5)。

图5 大鼠坐骨神经HE 染色切片(HE 染色,标尺 = 60 μm)空泡Fig.5 Photomicrographs of the sciatic nerve after operation stained with HE, Bar scale = 60 μm, Vacuoles
6.RT-PCR
大鼠坐骨神经射频热凝后14 天,RF65组大鼠的背根神经节组织内的Nav1.8 mRNA 表达量较Sham组显著增加(P< 0.05,见图6)。
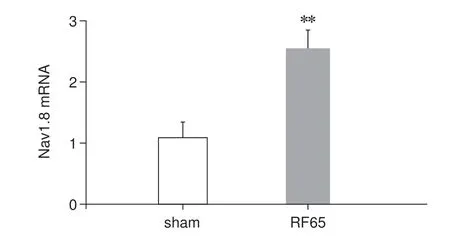
图6 射频热凝后大鼠背根神经节Nav1.8 mRNA 的表达(n = 10)**P < 0.01,与Sham 组相比Fig.6 Expression of Nav1.8 mRNA in rat dorsal root ganglion after radiofrequency thermocoagulation (n = 10)**P < 0.01, compared with group Sham.
讨 论
神经纤维对温度的耐受不同。既往的研究表明42℃的脉冲射频对于任何神经均没有损伤,造成神经损伤的温度一般大于50℃。60℃时传递痛觉和温觉的Aδ 和C 类纤维破坏,而传导运动和触压觉的Aα 纤维、Aβ 纤维和运动纤维能耐受更高的温度[14]。郝玢[19]报道65℃射频5 min 对大鼠坐骨神经造成明显的损伤。Heavner 等[20]在新鲜蛋清中采用不同温度的射频热凝对比,发现在42℃时没有产生凝固物,但当温度在60℃以上时就开始产生蛋清的凝固现象。所以我们的实验分别设置了55℃、65℃、75℃三个温度来进行坐骨神经的连续射频热凝处理。
RF65组和RF55组均于术后逐渐开始出现MWT和TWL 的改变。两组MWT 的明显降低分别出现于第3 天和第5 天,RF55组持续时间仅为1 周,而RF65组持续降低有25 天。两组TWL 均于术后7 天开始明显缩短,RF55组持续8 天,而RF65组持续长达23 天。RF55组损伤程度较轻,痛觉敏感维持的时间较短,大鼠术后神经功能恢复较快,2 周左右其神经功能即可恢复至术前状态。RF75组术后神经损伤较为严重,出现了较明显的运动功能损伤,大鼠术后出现拖曳、自噬严重的现象,且TWL 较Sham 组及术前明显上升,未出现MWT、TWL 降低的情况,不符合病理性神经痛相关的临床表现[21,22]。通过不同温度的射频热凝,以及损伤后大鼠行为学的变化,对比发现RF65组术后大鼠的行为学变化更加符合神经病理性疼痛模型的临床表现。
RF65组的损伤后表现,与Bennett 等[21]创建的经典的大鼠坐骨神经结扎模型表现出的坐骨神经损伤后的临床表现类似,在坐骨神经的处理后,出现了患侧肢体自发性痛敏感和对有害刺激反应阈值明显减低的过程。王厚融等[23]通过坐骨神经卡压损伤动物模型显示,机械痛阈值和热痛阈值术后7天开始降低,能维持1 个月余。Song 等[24]建立的大鼠背根神经节慢性卡压模型术后第1 天开始出现间歇性舔舐手术侧后爪,轻微的自噬现象,在术后前2 周常见,第5 周后频率减低;机械痛阈方面第1 天就开始降低,第1 周过后开始缓慢恢复,到第5 周仍低于术前水平。而本研究中RF65组大鼠术后MWT 先有一个短暂的阈值增高,于第5 天开始有明显的阈值降低,MWT 能维持到术后30 天,临床表现类似。可见,本研究创建的模型与一些经典的病理神经痛模型的病程相似。
Nav1.8 的外周表达增加已被证明与慢性疼痛的症状有关[25],坐骨神经卡压损伤使大鼠出现神经病理性疼痛的症状,且损伤神经中的Nav1.8 mRNA的表达增加[26]。本研究RF65组其背根神经节内Nav1.8 mRNA 的表达水平较Sham 组也有明显的增加,说明Nav1.8 通道可能参与本研究创建的射频热凝病理性神经痛模型的机制。
目前有多种坐骨神经损伤的病理性神经痛模型,大多数病理性神经痛模型[3,27]是通过对坐骨神经的套扎、卡压造成损伤,其卡压的松紧程度、力度等存在一定的人为误差,难以避免。其余的坐骨神经局部炎症性损伤、非压迫性髓核移植等[28,29]也不能完全确保损伤程度的一致性。而本研究创建的65℃射频热凝后神经病理性疼痛模型的创建过程操作相对稳定,客观的多种射频热凝参数能保证神经损伤的一致性更高,使模型大鼠的表现也相对更加稳定。
当前临床中射频热凝的相关参数设定没有固定标准,神经的损伤程度与温度、暴露时间有关,电压[30]与电流的频率对神经的损伤程度也有相关性,本研究中射频参数主要是温度控制,改变射频热凝的其他参数,会对模型的建立产生何种影响需要进一步去探索。另外本研究仅选择了行为学表现较为明显的时间点进行了Nav1.8 mRNA 的测定,没有对该观察指标进行多时间点的动态监测,因此对于Nav1.8 mRNA 的最佳观测时间点仍需要进一步的观测。
本研究建立的大鼠射频热凝损伤病理性神经痛模型是一种新型的热损伤神经病理性疼痛模型。其潜在的价值是通过对该动物模型的观察和研究,发现热损伤可能的机制,以及在临床中预防和处理热效应损伤后并发的神经痛。
利益冲突声明:作者声明本文无利益冲突。
