长链非编码RNA FAM83H-AS1对子宫内膜癌细胞增殖、侵袭和转移的影响
2023-07-22宋晓霞田金刘玉玲姜秋慧刘晓妍王倩倩张丽丽周晓丽赵晓丽
宋晓霞 田金 刘玉玲 姜秋慧 刘晓妍 王倩倩 张丽丽 周晓丽赵晓丽
1河南中医药大学第五临床医学院 郑州人民医院妇科,郑州 450000;2郑州大学第二附属医院妇科,郑州 450000
子宫内膜癌是最常见的妇科恶性肿瘤。随着医疗技术的进步,用于子宫内膜癌治疗的方法在不断提高,但晚期子宫内膜癌患者的治愈率仍然很低。对于有肿瘤转移或复发的患者,无论其分级或分期,预后均较差;这些患者的死亡风险显著增高,通常生活质量较差,中位总生存时间明显较低[1-2]。目前,子宫内膜癌的发病和转移机制尚不清楚。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 个核苷酸,不编码蛋白质的功能性RNA 分子[3-4]。虽然lncRNA 不具有编码蛋白质的功能,但是能够通过调节mRNA剪切、降解和翻译等生理过程发挥作用[5]。序列相似性家族83成员H 反义RNA 1(FAM83H-AS1)是一种与癌症进展密切相关的lncRNA,其异常的高表达水平与多种癌症的发生发展密切相关。目前,FAM83H-AS1 在子宫内膜癌中的作用及其机制和FAM83H-AS1 对子宫内膜癌细胞增殖、迁移和侵袭的作用仍不清楚。本研究主要通过检测人子宫内膜癌组织及癌旁组织中LncRNA FAM83H-AS1 的表达水平,并通过细胞学试验验证LncRNA FAM83H-AS1 对子宫内膜癌细胞增殖、侵袭和转移的影响。
资料与方法
1.主要资料
收集2018年10月至2020年10月就诊于郑州人民医院的39 例子宫内膜癌患者的肿瘤组织以及配对的癌旁组织,其中包括子宫内膜样癌20 例(其中G1 5 例,G2 7 例,G3 8例),非内膜样癌19例(其中包括浆液性癌10例,黏液性癌5 例,透明细胞癌4 例)。组织标本于手术期间取得,并立即在-80 °C 下冷冻直到下一步使用。在样本收集之前,从每个参与者处获得了书面知情同意,研究方案经郑州人民医院临床研究伦理委员会批准备案。
纳入标准:年龄范围25~75 岁;符合《子宫内膜癌诊断与治疗指南》中子宫内膜癌的诊断标准[6];经病理组织学检查确诊者;入院前3 个月无性激素类药物治疗史者;术前未接受过放疗、化疗等抗肿瘤治疗方案者;依从性良好者。
排除标准:脑外伤、中枢神经系统感染引起的痴呆等;精神疾病患者;有酗酒或药物滥用史的患者;心肝肾严重功能障碍患者;合并其他肿瘤性疾病者;血液性系统疾病患者。
4 种子宫内膜癌细胞系(HEC-1B、HEC-1A、ishikawa 以及RL-952)和1株正常子宫内膜上皮细胞系(hEEC)购自湖南丰晖生物科技有限公司。
2.主要方法
2.1.逆转录定量聚合酶链式反应(qRT-PCR) 采用qRT-PCR 检测临床上收集的39 例子宫内膜癌患者的肿瘤组织以及配对的癌旁组织中FAM83H-AS1的表达水平。具体步骤:通过TRIzol 试剂(Thermofisher Scientific,美国)提取,并且使用NanoDrop 1000 分光光度计(Thermofisher Scientific,美国)测定蛋白质浓度。使用Agilent 2100生物分析仪(Agilent Technologies,美国)评估提取的RNA 的质量,使用PrimeScript synthesis cDNA kit(Takara Biotechnology,日本)反转录合成cDNA,SYBR Green PCR Master Mix(Takara Biotechnology,日本)进行qPCR,将GAPDH mRNA 含量标准化 。 引 物 序 列 如 下 。 FAM83H-AS1:(R) 5’-AGCTCCACCTCCCGGGTTCACG-3’、 (F)5’-CGTGAACCCGGGAGGTGGAGCT3’。逆转录反应体系严格按照说明书进行。
2.2.构建低表达FAM83H-AS1 的子宫内膜癌细胞系靶向FAM83H-AS1 的shRNA 由生工生物科技有限公司合成,并插入pLKO.1-TRC 克隆载体(Addgene)中,靶向序列分别为:5’-CTTGCGATCGGGTCGATCGATCTTAGCTTTGCGA-3’(shRNA1)和5’-GTCCGTAGCTAGCTAAAGTCGATTCGATCGTACAAGA-3’(shRNA-2)。另外,将pLKO.1-TRC 对照载体用作对照的空载体(命名为sh-NC)。
2.3.细胞增殖试验[细胞计数试剂盒8(CCK-8)] 转染后24 h 收集细胞并进行重悬,将细胞密度为1×106个/ml、浓度为2×105个/ml 的单细胞悬液接种到96 孔板中,并在细胞接种后96 h 进行CCK-8 测定(Beyotime,中国)。96 h 后取出孔板,将10 μl CCK-8 溶液添加到每个孔中并在37 ℃下孵育2 h后,使用酶标仪(Bio-Rad Laboratories,美国)在450 nm波长下分析细胞的增殖活性。将来自3 个独立试验的结果取平均值进行分析。
2.4.TUNEL 染色 首先用PBS 或HBSS 洗涤1 次。如果细胞贴得不牢,可以干燥样品,使细胞贴得更牢;用4%多聚甲醛固定细胞30 min;用PBS 或HBSS 洗涤1 次;加入含0.3% Triton X-100的PBS,室温孵育5 min;在样品上加50 μl TUNEL 检测液,37 ℃避光孵育60 min;PBS 或HBSS 洗涤3 次。最后,用抗荧光淬灭封片液封片后荧光显微镜下观察。可以使用的激发波长450~500 nm,发射波长515~565 nm。
2.5.EdU 染色 显微镜下观察细胞,配制2×EdU 工作液,加入2×EdU 工作液,孵育-固定-弃去培养液,用4%多聚甲醛溶液来固定,固定时间20 min。洗涤-渗透剂-洗涤,EdU检测。
2.6.流式细胞术 使用胰酶消化细胞,1 000 转/min 离心收集所有细胞;使用4 ℃预冷的PBS 洗涤细胞2 次;将0.5 ml PBS 悬浮细胞缓慢加入到预冷的70%乙醇溶液中(用PBS 配制,-20 ℃预冷),快速混匀,使用封口膜封口,-20 ℃固定过夜;将固定过的细胞以4 ℃、1 000 转/min 离心5 min,弃上清液,转移到EP 管中,用PBS 洗涤2 次。计数细胞,调整细胞密度为1×106个细胞/ml,取1 ml 进行试验。4 ℃,1 000 转/min 离心5 min,取细胞沉淀;加入900 μl PBS缓冲液重悬细胞;加入100 μl RNaseA 溶液,使RNaseA 终浓度为100 mg/L,37 ℃孵育30 min;4 ℃,1 000 转/min 离心5 min,弃去上清液;加入450 μl PBS 悬浮细胞,加入450 μl PI 染液,避光冰置20 min;上流式细胞仪检测,分析记录结果。
2.7.Transwell 试验 Transwell 试验检测HEC-1A 和HEC-1B 的迁移和侵袭能力。Matrigel 胶4 ℃过夜,提前开制冰机,枪盒预冷。Matrigel 胶的原液为8.6 g/L。用无血清培养基将Matrigel 胶分别配制成100 mg/L 和30 mg/L 的溶液;向24 孔板的每孔中加入400 μl 30 g/L 的Matrigel 胶溶液,将transwell小室置于溶液内,再滴加200 μl浓度为30 g/L的Matrigel 胶溶液,冰上放置1.0 h 后吸弃溶液、晾干;将100 μg/L 的Matrigel胶溶液吹打均匀后,吸取100 μl缓慢滴加于transwell上室基底膜上。晃动均匀后置于37 ℃培养箱内放置0.5 h;将细胞在无血清培养基中培养过夜;将小室放入含有600 μl 无血清培养基的24 孔板小孔中后,放在孵育箱中活化30 min 以上;消化细胞,将其制成单细胞悬液,吸取1.0 ml 至标记好的1.5 ml EP 管内,离心后用无血清培养基重悬细胞。调整细胞浓度为2×105个/ml 的单细胞悬液;取200 μl细胞悬液加入到小室上室中,在小室的下室中加入600 μl 含15% FBS 的RPMI-1640 培养基,放在孵育箱中培养24.0 h;弃培养基,用含4%多聚甲醛的固定液室温固定细胞20 min,接着用0.1%结晶紫染色20 min,然后用棉签擦去小室上层细胞,冲洗晾干小室;于倒置显微镜下采集图像(×100),随机选取6个不同视野计数分析。
3.统计学方法
数据分析用GraphPad Prism 8.0 软件,对于临床样本分析,使用配对t检验检测数据间差异有无统计学意义,对于细胞试验,使用单向方差分析或者双向方差分析,方差分析后使用Tukey’s multiple comparison test 进行独立检验,P<0.05为差异有统计学意义。
结果
1.lncRNA FAM83H-AS1 在子宫内膜癌组织中的表达水平明显增高
癌组织lncRNA FAM83H-AS1 表达水平明显高于癌旁组织(图1)。为了进一步分析FAM83H-AS1 的表达水平与患者的临床表型的相关性,研究分析了FAM83H-AS1 表达水平与患者年龄、肿瘤大小、FIGO 分期、淋巴结转移、肿瘤组织学分级以及组织学类型的关系,结果发现,FAM 83H-AS1 的表达水平与患者的年龄、肿瘤大小无明显相关性(均P>0.05)。但是,在FAM83H-AS1 阳性的患者中,具有更高的FIGO 分期;此外,研究还发现,非内膜样癌FAM83H-AS1 的表达水平更高,且肿瘤的组织学分级越高越有转移的可能,预示着预后更不佳(表1)。

表1 子宫内膜癌患者肿瘤组织中FAM83H-AS1的表达水平与子宫内膜癌患者临床病理特征相关性[例(%)]
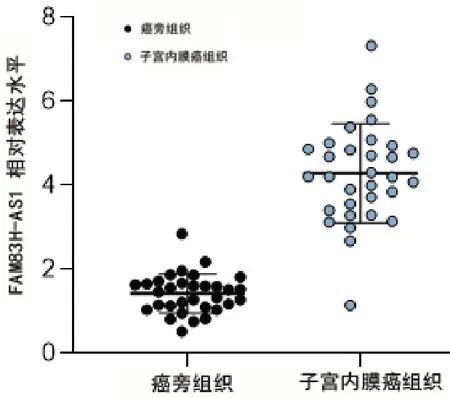
图1 FAM83H-AS1在子宫内膜癌组织中的表达水平明显提高
2.低表达FAM83H-AS1的子宫内膜癌细胞系构建成功
为了验证FAM83H-AS1 在子宫内膜癌中的作用,我们将shRNA 靶向FAM83H-AS1 转染至子宫内膜癌细胞HEC-1A 和HEC-1B 中,通过qRT-PCR 检测细胞中FAM83H-AS1 的表达水平,确认敲低效率,发现shRNA-1 与shRNA-2 均具有良好的敲低效应,并且shRNA-1的效率更高(图2)。
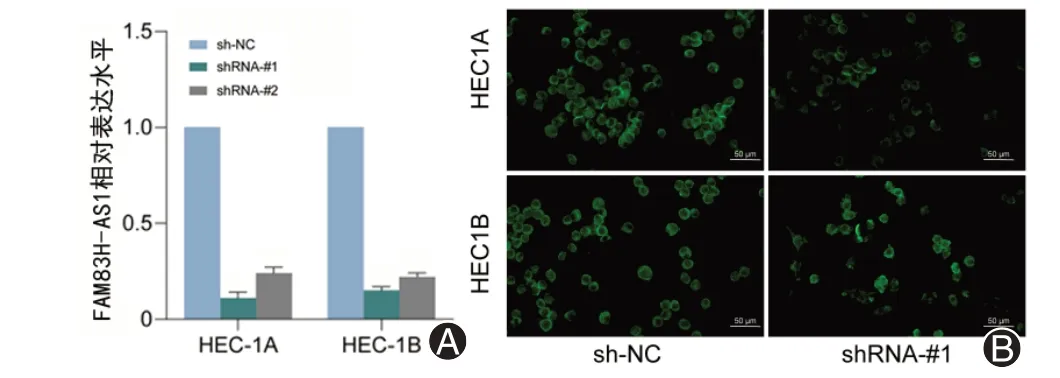
图2 shRNA对FAM83H-AS1敲低效率的检测。A:逆转录定量聚合酶链式反应检测在shRNA 靶向FAM83H-AS1 转染至子宫内膜癌细胞HEC-1A和HEC-1B中之后FAM83H-AS1的表达水平;B:荧光显微镜下观察转染后细胞中绿色荧光表达以确认转染成功
3.敲低FAM83H-AS1削弱子宫内膜癌细胞的增殖活性
采用CCK-8 试剂盒在敲低FAM83H-AS1 之后检测HEC-1A 和HEC-1B 的增殖活性,结果显示,在敲低FAM83H-AS1 的子宫内膜癌细胞HEC-1A 和HEC-1B 中,24 h 后细胞活性显著低于转染Scr-shRNA 的细胞(图3A);进一步将子宫内膜癌细胞系HEC-1A 和HEC-1B 接种在琼脂糖凝胶平皿中,用于分析细胞的克隆形成数量,接种后7 d,对平板进行结晶紫染色,研究结果显示,敲低FAM83H-AS1 的子宫内膜癌细胞HEC-1A 和HEC-1B 在平板中形成的细胞克隆数量显著减少(图3B)。采用EdU染色检测细胞中的增殖细胞数量,结果显示,EdU 阳性细胞数量明显减少(图3C)。
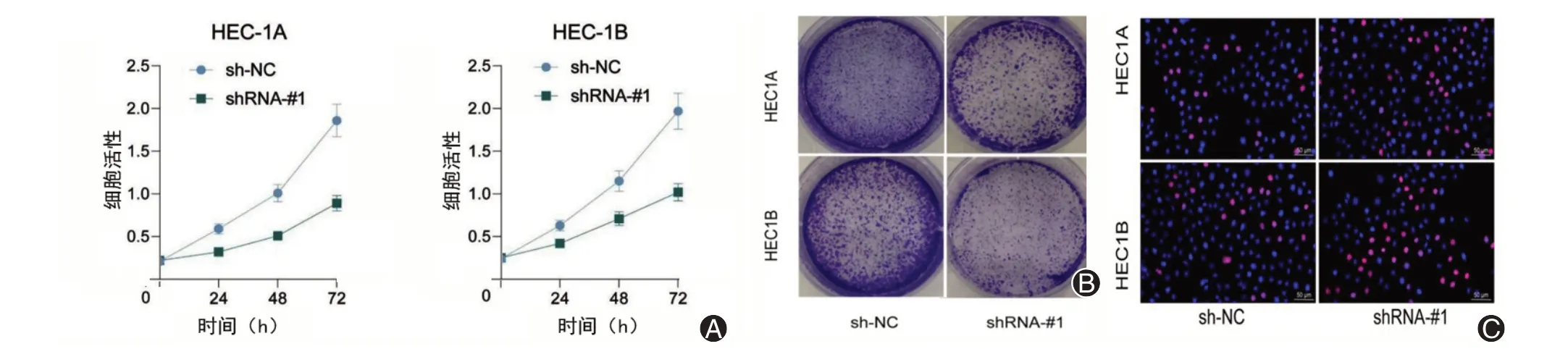
图3 敲低FAM83H-AS1 削弱子宫内膜癌细胞的增殖活性。A:细胞计数试剂盒8 检测HEC-1A 与HEC-1B 在敲减FAM83H-AS 前后细胞增殖情况;B:细胞克隆形成试验检测HEC-1A与HEC-1B在敲减FAM83H-AS前后细胞增殖情况;C:EdU染色检测细胞的DNA复制能力
4.敲低FAM83H-AS1促进子宫内膜癌细胞的凋亡
采用TUNEL 染色检测敲低FAM83H-AS1 的子宫内膜癌细胞HEC-1A 和HEC-1B 的凋亡小体的形成数量,观察到在sh-NC 的细胞中,平均每个视野有2~3 个绿色荧光基团(凋亡小体),然而在敲低FAM83H-AS1 的子宫内膜癌细胞中,平均每个视野的凋亡小体数量明显增加(图4A)。进一步采用流式细胞术检测细胞中的凋亡比例,我们观察到敲低FAM83H-AS1 会显著促进细胞凋亡(图4B)。以上结果均充分说明:敲低FAM83H-AS1 会导致子宫内膜癌细胞活性降低,并且促进细胞凋亡。

图4 敲低FAM83H-AS1 促进子宫内膜癌细胞凋亡。A:TUNEL 染色检测细胞中的凋亡小体数量;B:流式细胞术检测细胞中的凋亡细胞比例
5.敲低FAM83H-AS1 抑制子宫内膜癌细胞的迁移与侵袭
为了进一步明确敲低FAM83H-AS1对子宫内膜癌细胞转移的影响,采用Transwell 试验检测HEC-1A 和HEC-1B细胞的迁移和侵袭能力,从结果中我们发现,敲低FAM83H-AS1 会显著抑制子宫内膜癌细胞的迁移和侵袭(图5A、B)。

图5 敲低FAM83H-AS1 抑制子宫内膜癌细胞的迁移与侵袭。A:Tranwell 试验检测HEC1A 和HEC1B 的迁移能力;B:Tranwell 试验检测HEC1A和HEC1B的侵袭能力
讨论
在人类基因组中大约只有2%的基因编码蛋白质;大多数基因组不会翻译成蛋白质,而是可以编码一系列非编码RNA(non-coding RNA,ncRNA)[7-10]。在最近的几十年中,已经鉴出了一组称为lncRNA 的ncRNA。大多数lncRNA 通常位于细胞核中,在那里它们可能在表观遗传调控中起关键作用,包括通过染色质修饰;但是,越来越多的研究已经确定了细胞质中也存在lncRNA。这表明lncRNA 在基因的表达、翻译以及翻译后调控中都起着重要作用[11-14]。研究表明,具有序列相似性的FAM83H-AS1的lncRNA家族的异常表达与癌症患者的预后不良有关。有研究发现,肝癌患者中FAM83H-AS1 高表达与总生存期(overall survival,OS)具有明显相关性[15-17]。在胃癌中,FAM83H-AS1 高表达能够影响胃癌患者的OS 和无病生存率(disease-free survival,DFS),FAM83H-AS1 在胃癌的发生发展中扮演着癌基因的作用[18-19]。另一项研究表明,卵巢癌患者肿瘤组织中FAM83H-AS1 的表达水平明显高于癌旁组织,并且FAM83H-AS1 高表达与卵巢癌的肿瘤分化程度、肿瘤淋巴结转移(LNM)和远处转移有关[20]。
本研究主要采用qRT-PCR 检测临床收集的39 例子宫内膜癌患者的肿瘤组织及其配对的癌旁组织中FAM83H-AS1的表达情况,为了进一步分析FAM83H-AS1的表达水平与患者的临床表型的相关性,研究分析了FAM83H-AS1 的表达水平与患者的年龄、肿瘤大小、FIGO分期、淋巴结转移、肿瘤分化程度以及组织学类型的关系,结果发现,FAM83H-AS1的表达水平与患者的年龄、肿瘤大小无明显相关性(均P>0.05);但是,高表达FAM83H-AS1的患者具有更高的FIGO 分期;此外,研究还发现,非内膜样癌FAM83H-AS1 的表达水平更高,且肿瘤的组织学分级越高越有转移的可能,预示着预后更不佳。进一步使用Lipofectamine 2000 转染试剂盒将靶向FAM83H-AS1 的shRNA 质粒转染至子宫内膜癌细胞HEC-1A 和HEC-1B中,通过qRT-PCR 检测shRNA 的转染效率,结果显示,敲低FAM83H-AS1 会显著抑制子宫内膜癌细胞在体外的增殖,其主要表现在低表达FAM83H-AS1 HEC-1A 和HEC-1B 的子宫内膜癌细胞的增殖活性被显著抑制,在平板上形成的克隆数量也显著减少,EdU 阳性细胞数量也显著降低;而且,进一步通过TUNEL 染色以及流式细胞术检测发现,敲低FAM83H-AS1 会显著促进HEC-1A 与HEC-1B 中凋亡小体的形成;进一步采用Transwell 试验检测HEC-1A 和HEC-1B 的迁移和侵袭能力,从结果显示,敲低FAM83H-AS1 会显著抑制子宫内膜癌细胞的迁移和侵袭,表明低表达FAM83H-AS1会明显促进子宫内膜癌细胞的凋亡。以上结果说明,FAM83H-AS1 在子宫内膜癌的发生和发展中具有重要的作用。
综上所述,lncRNA FAM83H-AS1高表达可能与子宫内膜癌的发生发展有关。但是,由于样本数量较少,lncRNA FAM83H-AS1在子宫内膜癌发病机制中的作用以及表达和调控机制还有待进一步研究。此外,该基因是否可作为子宫内膜癌患者的易感筛查指标,以及如何找到有效下调lncRNA FAM83H-AS1 的方法,并能够让其应用于临床,是我们下一步研究的目标。
利益冲突所有作者均声明不存在利益冲突
