UHPLC同时测定不同产地和不同采收期裸花紫珠及同属植物中9种活性成分的含量与质量评价
2023-07-21杨祖凡杨义芳康兴东李小峰吴永忠肖军平贾强强
杨祖凡,杨 扬,杨义芳,康兴东,李小峰,吴永忠,肖军平,王 稳,贾强强*,周 斌*
UHPLC同时测定不同产地和不同采收期裸花紫珠及同属植物中9种活性成分的含量与质量评价
杨祖凡1, 2,杨 扬3,杨义芳3,康兴东4,李小峰4,吴永忠4,肖军平4,王 稳1,贾强强1*,周 斌3*
1. 青海大学三江源生态与高原农牧业国家重点实验室,青海 西宁 810016 2. 青海大学医学院,青海 西宁 810001 3. 上海医药工业研究院,上海 201203 4. 江西普正药业有限公司,江西 吉安 331409
利用UHPLC-UV建立裸花紫珠药材中9个活性成分同时定量的方法,并测定其在不同产地及不同采收期裸花紫珠中的含量,用于裸花紫珠药材的质量评价及产地、采收期的选择。采用Phenomenex kintex XB-C18色谱柱(150 mm×2.1 mm,1.7 μm),以乙腈(A)-0.1%磷酸水溶液(B)为流动相进行梯度洗脱;体积流量0.3 mL/min;检测波长332 nm和210 nm;柱温为45 ℃;测定了83批裸花紫珠和7批同属不同种紫珠属样品中的9个活性成分含量。结合主成分分析及正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)对裸花紫珠进行全面分析。建立了裸花紫珠中9个活性成分含量同时测定的方法。其中咖啡酸、木犀草苷、连翘酯苷B、毛蕊花糖苷、木犀草素-4'--β--吡喃葡萄糖苷、木犀草素-3'--β--吡喃葡萄糖苷、木犀草素、藿香黄酮醇和熊果酸分别在1.240~124.0、2.040~204.0、1.020~101.6、5.100~510.0、0.904 0~90.40、0.982 0~98.20、0.872 0~87.20、0.822 0~82.20、2.280~228.0 μg/mL内线性关系良好,精密度、重复性、稳定性RSD值均小于3.00%,平均加样回收率在95.58%~101.73%,回收率RSD值均小于2.50%。主成分分析筛选出2个主成分,其累积方差贡献率为77.33%,表明这2个主成分可包含原有数据的大多数信息;OPLS-DA法标记出裸花紫珠药材中的4个差异性成分,分别为咖啡酸、连翘酯苷B、毛蕊花糖苷和熊果酸。建立的多成分含量测定方法适用于裸花紫珠的质量评价,为裸花紫珠质量控制及相关经典名方开发提供参考。
裸花紫珠;UHPLC-UV;主成分分析;多成分含量测定;苯丙烯酸类;黄酮类;咖啡酸;木犀草苷;连翘酯苷B;毛蕊花糖苷;木犀草素-4'--β--吡喃葡萄糖苷;木犀草素-3'--β--吡喃葡萄糖苷;木犀草素;藿香黄酮醇;熊果酸
裸花紫珠Hook. et Arn.是马鞭草科紫珠属L.植物,其干燥叶可入药,生长于海拔1200 m及以下的平原、山坡、谷地、林地中,主要分布在中国广东、广西、海南、江西等地[1-2],其提取物具有抗炎、抗菌、保护神经、抗氧化和镇痛等作用[3-12]。对裸花紫珠有效成分的研究已有文献报道,主要集中在利用比色法[13]、分光光度法[14-17]对总黄酮含量进行测定,或使用HPLC对毛蕊花糖苷、木犀草苷等少数指标成分进行定量[18-20]。但由于药材成分复杂,单一指标成分专属性不强,难以反映药材的整体质量。因此,有必要建立中药裸花紫珠多指标成分含量测定的方法。
现有文献报道苯丙素类、黄酮类和萜类等化合物为裸花紫珠药材的主要活性成分[21-26]。结合本团队前期对裸花紫珠指纹图谱的研究结果[27-28],最终确定使用UHPLC-UV方法对裸花紫珠中9个主要活性成分同时进行定量分析,包括3个苯丙烯酸类(咖啡酸、连翘酯苷B、毛蕊花糖苷),5个黄酮类(木犀草苷、木犀草素-4′--β--吡喃葡萄糖苷、木犀草素-3′--β--吡喃葡萄糖苷、木犀草素和藿香黄酮醇),以及1个三萜类(熊果酸)化合物。本研究分别优化了供试品提取条件与色谱条件,开发了9种活性成分同时定量的方法,并进行了全面的方法学验证。最后,利用该方法对不同产地及采收时间的83批裸花紫珠和同一时期采收的7批同属不同种紫珠属样品进行了比较分析,探索了各活性成分的差异和变化规律,对其内在质量进行整体评价。相较于以往的报道[29-30],本研究在多指标成分定量分析时选择的指标成分更多,收集样本更全,研究数据更丰富。并采用了化学模式识别分析,OPLS-DA法标记出裸花紫珠药材中的4个差异性成分,可能是导致裸花紫珠质量产生差异的关键因素,可以更好的为裸花紫珠的质量评价研究提供参考。
1 仪器与材料
1.1 仪器
Waters ACQUITY ARC型超高效液相色谱仪,配有二元高压梯度泵、真空脱气机、自动进样器、柱温箱、二极管阵列检测器(美国沃特世公司);CPA225D型十万分之一天平(塞多利斯科学仪器有限公司);PB1501-N型万分之一天平(瑞士梅特勒-托利多公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);800Y型高速多功能粉碎机(浙江省永康市铂欧五金制品有限公司)。
1.2 材料
乙腈、甲酸(美国ACS公司,色谱纯);甲醇(上海泰坦科技股份有限公司,分析纯);屈臣氏蒸馏水(北京屈臣氏蒸馏水有限公司)。毛蕊花糖苷(批号M-011-170315,质量分数>98.0%)和连翘酯苷B(批号L-013-170421,质量分数>98.0%)对照品均购于成都瑞芬思生物科技有限公司;木犀草苷(批号PR F8030242,质量分数>98.0%)和咖啡酸(批号PR F7102121,质量分数>98.0%)对照品均购于成都普瑞法科技开发有限公司;熊果酸对照品(批号PR F8002125,质量分数>98.0%)对照品购于宝鸡辰光生物科技有限公司;木犀草素-4'--β--吡喃葡萄糖苷、木犀草素-3'--β--吡喃葡萄糖苷、木犀草素和藿香黄酮醇对照品为实验室自制,质量分数均≥98%;83批不同产地和不同采收时间的裸花紫珠样品(S1~S83)经江西普正制药有限公司吴永忠研究员鉴定为马鞭草科裸花紫珠Hook. et Arn.的干燥叶,另外7批同属不同种紫珠属样品(S84~S90)也由吴永忠研究员鉴定为大叶紫珠Vahl.、广东紫珠Chun、杜虹花紫珠Rolfe、小叶紫珠(Lour.) K. Koch和枇杷叶紫珠Makino的干燥叶,密封后保存于阴凉干燥处,样品信息见表1。
2 方法与结果
2.1 溶液的配制
2.1.1 对照品溶液制备 精密称取咖啡酸、木犀草苷、连翘酯苷B、毛蕊花糖苷、木犀草素-4′--β--吡喃葡萄糖苷、木犀草素-3′-β--吡喃葡萄糖苷、木犀草素、藿香黄酮醇和熊果酸对照品一定量,溶于80%甲醇配制混标溶液。精密吸取混标溶液0.1、0.25、0.5、1、2.5、5 mL置于10 mL量瓶中,摇匀,经0.22 μm的微孔滤膜滤过,作为储备液,保存于4 ℃下。
2.1.2 供试品溶液制备 裸花紫珠样品粉碎,过40目筛,称取样品粉末约0.5 g,置具塞锥形瓶中,加入80%甲醇水溶液25 mL,称定质量,超声(功率500 W、频率40 kHz)提取45 min,放冷,80%甲醇补足质量,摇匀,过0.22 μm微孔滤膜,取续滤液,即得供试品溶液。
表1 裸花紫珠及7批同属不同种植物的样品信息
Table 1 Sample information of C. nudiflora and seven batches of different species of Callicarpa
编号种产地采收日期编号种产地采收日期编号种产地采收日期 S1裸花紫珠海南白沙2016-09-15S31裸花紫珠海南五指山2016-12-30S61裸花紫珠江西上犹2016-12-15 S2裸花紫珠海南白沙2016-10-15S32裸花紫珠海南五指山2017-03S62裸花紫珠广东2016-03-30 S3裸花紫珠海南白沙2016-10-20S33裸花紫珠海南五指山2017-04-15S63裸花紫珠广东惠东2014 S4裸花紫珠海南白沙2016-10-25S34裸花紫珠海南五指山2017-08-12S64裸花紫珠广东惠东2014-11 S5裸花紫珠海南白沙2016-11-18S35裸花紫珠海南五指山2017-08-20S65裸花紫珠广东惠东2016-07-30 S6裸花紫珠海南白沙2016-11-30S36裸花紫珠海南白沙2015-11-30S66裸花紫珠广东惠东2016-10-30 S7裸花紫珠海南白沙2016-12-15S37裸花紫珠海南白沙2015-12-15S67裸花紫珠广东惠东2017-04-22 S8裸花紫珠海南白沙2016-12-30S38裸花紫珠海南白沙2015-12-30S68裸花紫珠广东惠东2017-08-20 S9裸花紫珠海南白沙2017-01S39裸花紫珠海南白沙带杆2017-04-10S69裸花紫珠广东惠州2016-11 S10裸花紫珠海南白沙2017-01-12S40裸花紫珠海南白沙惠芬2016-09S70裸花紫珠广东惠州绿天然2016-11 S11裸花紫珠海南白沙2017-02S41裸花紫珠海南白沙智丰2016-09S71裸花紫珠广东惠州绿天然2017-01 S12裸花紫珠海南白沙2017-02-01S42裸花紫珠海南五指山2015-12-30S72裸花紫珠(带枝)广东惠州绿天然2016-11-21 S13裸花紫珠海南白沙2017-03-15S43裸花紫珠海南五指山机场2016-04-20S73裸花紫珠江西安福彭锦云2016-06 S14裸花紫珠海南白沙2017-03-20S44裸花紫珠江西普正药业菜园2016-09-14S74裸花紫珠江西赣州2016-07 S15裸花紫珠海南白沙2017-04S45裸花紫珠江西普正药业菜园2016-10-15S75裸花紫珠江西赣州2016-07-31 S16裸花紫珠海南白沙2017-04-01S46裸花紫珠江西普正药业菜地2016-11-15S76裸花紫珠江西峡江2015-11-01 S17裸花紫珠海南白沙2017-04-12S47裸花紫珠江西普正药业菜园2016-11-29S77裸花紫珠江西峡江2014-11-08 S18裸花紫珠海南白沙2017-04-15S48裸花紫珠江西普正药业菜地2016-12-15S78裸花紫珠江西峡江2016-10 S19裸花紫珠海南白沙2017-08-01S49裸花紫珠江西普正药业药园2016-12-29S79裸花紫珠江西峡江2016-11 S20裸花紫珠海南白沙2017-08-15S50裸花紫珠江西普正药业药园2016-09-14S80裸花紫珠江西峡江2016-11-29 S21裸花紫珠海南白沙2017-08-20S51裸花紫珠江西普正药业药园2016-10-15S81裸花紫珠江西峡江2016-12-15 S22裸花紫珠海南五指山2016-09-15S52裸花紫珠江西普正药业药园2016-10-31S82裸花紫珠江西峡江2017-07-25 S23裸花紫珠海南五指山2016-09-15S53裸花紫珠江西普正药业药园2016-11-15S83裸花紫珠江西峡江药园2017-06-06 S24裸花紫珠海南五指山2016-09-30S54裸花紫珠江西普正药业药园2016-11-29S84大叶紫珠带枝贵州2017-06 S25裸花紫珠海南五指山2016-10-25S55裸花紫珠江西普正药业药园2016-12-29S85大叶紫珠全叶贵州2017-06 S26裸花紫珠海南五指山2016-10-30S56裸花紫珠江西上犹2016-09-15S86杜虹花紫珠云南昭通2017-06 S27裸花紫珠海南五指山2016-11-15S57裸花紫珠江西上犹2016-10-15S87广东紫珠峡江药园2017-06-06 S28裸花紫珠海南五指山2016-11-30S58裸花紫珠江西上犹2016-11-01S88枇杷叶紫珠峡江药园2017-06-06 S29裸花紫珠海南五指山2016-12-15S59裸花紫珠江西上犹2016-11-10S89小叶紫珠大叶型峡江药园2017-06-06 S30裸花紫珠海南五指山2016-12-15S60裸花紫珠江西上犹2016-12-01S90小叶紫珠峡江药园2017-06-06
2.2 色谱条件
色谱分离采用Phenomenex kintex XB-C18色谱柱(150 mm×2.1 mm,1.7 μm)。流动相为(A)0.1%磷酸水溶液和(B)乙腈。梯度洗脱:0~5 min,8%~13% B;5~15 min,13% B;15~20 min,13~16% B;20~35 min,16%~22% B;35~45 min,22%~30% B;45~50 min,30%~50% B;50~55 min,50%~65% B;55~65 min,65%~100% B;65~75 min,100% B。体积流量为0.3 mL/min;柱温45 ℃,进样量2 μL。检测波长为332 nm和210 nm。混合对照品及样品的色谱图见图1。
2.3 方法学考察
2.3.1 线性范围、检测限(LOD)与定量限(LOQ) 分别精密吸取“2.1.1”项下7个不同质量浓度的混合对照品溶液各2 μL,按“2.2”项色谱条件进样,记录色谱图。以质量浓度为横坐标(),峰面积为纵坐标()绘制传统曲线。回归方程、相关系数及线性范围见表2。将混合对照品溶液逐步稀释,分别以信噪比(S/N)=3和S/N=10时各对照品的质量浓度作为LOD和LOQ,结果见表2。
2.3.2 精密度考察 精密称取S1样品粉末0.5 g,按“2.1.2”项制备供试品溶液,按“2.2”项色谱条件重复进样6次,记录色谱图,计算各组分峰面积的RSD,9个组分的RSD值依次为咖啡酸0.81%、木犀草苷0.35%、连翘酯苷B 1.24%、毛蕊花糖苷0.49%、木犀草素-4′--β--吡喃葡萄糖苷0.31%、木犀草素-3′--β--吡喃葡萄糖苷0.35%、木犀草素1.03%、藿香黄酮醇0.50%、熊果酸0.67%,表明仪器精密度良好。
2.3.3 重复性考察 精密称取S1样品粉末6份,每份0.5 g,按“2.1.2”项平行制备6份供试品溶液。每份供试品溶液按“2.2”项色谱条件进行测定,记录色谱图。测得各成分质量浓度的RSD值分别为咖啡酸1.29%、木犀草苷2.95%、连翘酯苷B 2.02%、毛蕊花糖苷1.20%、木犀草素-4′--β--吡喃葡萄糖苷2.24%、木犀草素-3′--β--吡喃葡萄糖苷2.27%、木犀草素1.27%、藿香黄酮醇1.18%、熊果酸2.89%,表明该方法重复性良好。
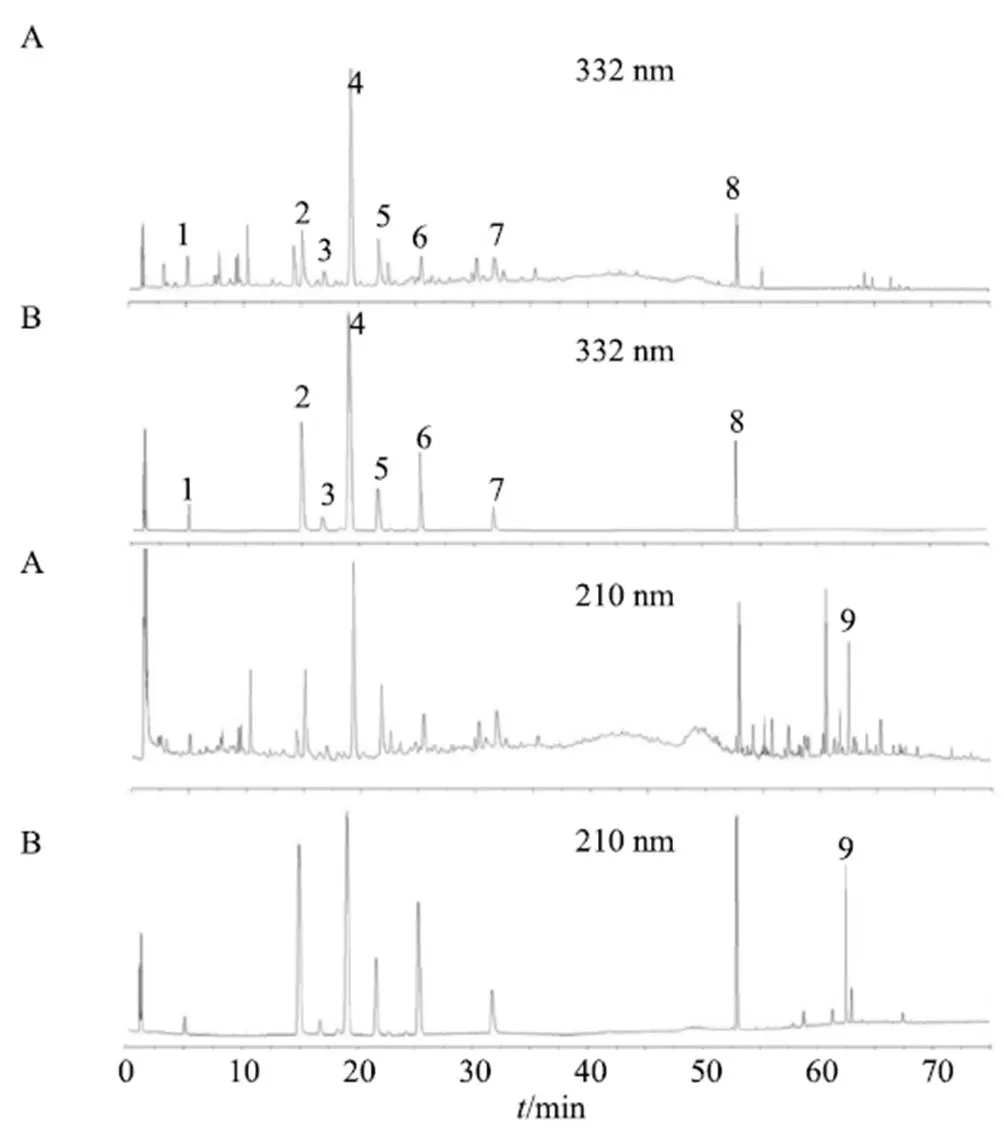
1-咖啡酸 2-木犀草苷 3-连翘酯苷B 4-毛蕊花糖苷 5-木犀草素-4′-O-β-D-吡喃葡萄糖苷 6-木犀草素-3′-O-β-D-吡喃葡萄糖苷 7-木犀草素 8-藿香黄酮醇 9-熊果酸,图3同
表2 裸花紫珠中9个成分的回归方程、相关系数和线性范围、LOQ和LOD
Table 2 Regression equations, correlation coefficients and linearity ranges, limit of quantitation and limit of detection of nine components in C. nudiflora
对照品标准曲线R2线性范围/(μg·mL−1)LOQ/(μg·mL−1)LOD/(μg·mL−1) 咖啡酸Y=31 210.60 X+12.190.999 81.240 0~124.000.0410.012 木犀草苷Y=14 012.38 X+10.820.999 52.040 0~204.000.1700.051 连翘酯苷BY=9 390.23 X+1.270.999 41.020 0~101.600.1710.051 毛蕊花糖苷Y=10 431.76 X+16.200.999 65.100 0~510.000.3410.102 木犀草素-4′-O-β-D-吡喃葡萄糖苷Y=14 428.02 X+2.310.999 50.904 0~90.400.1490.045 木犀草素-3′-O-β-D-吡喃葡萄糖苷Y=15 482.63 X+5.590.999 70.982 0~98.200.1650.049 木犀草素Y=21 512.33 X−4.970.999 90.872 0~87.200.1440.044 藿香黄酮醇Y=16 056.27 X+6.160.999 80.822 0~82.200.0550.012 熊果酸Y=3 127.13 X+7.480.999 4 2.280 0~228.000.1900.051
2.3.4 稳定性考察 精密称取S1样品粉末0.5 g,按“2.1.2”项制备1份供试品溶液。分别于0、2、4、6、12、24 h按“2.2”项色谱条件进样测定,记录色谱图,计算各组分峰面积的RSD。依次为咖啡酸2.50%、木犀草苷1.52%、连翘酯苷B 0.89%、毛蕊花糖苷2.37%、木犀草素-4′--β--吡喃葡萄糖苷1.39%、木犀草素-3′--β--吡喃葡萄糖苷0.90%、木犀草素2.45%、藿香黄酮醇1.26%、熊果酸0.62%,表明供试品溶液在24 h内能够保持稳定。
2.3.5 加样回收率试验 精密称取各指标成分含量已知的样品粉末6份,每份0.25 g,按照样品含量的100%水平分别加入咖啡酸、木犀草苷、连翘酯苷B、毛蕊花糖苷、木犀草素-4′--β--吡喃葡萄糖苷、木犀草素-3′--β--吡喃葡萄糖苷、木犀草素、藿香黄酮醇和熊果酸峰对照品,按“2.1.2”项制备供试品溶液,并按“2.2”项下色谱条件进样测定,计算各指标成分的回收率。计算得咖啡酸、木犀草苷、连翘酯苷B、毛蕊花糖苷、木犀草素-4′--β--吡喃葡萄糖苷、木犀草素-3′--β--吡喃葡萄糖苷、木犀草素、藿香黄酮醇和熊果酸的平均加样回收率分别为101.60%、101.35%、97.30%、98.38%、100.64%、95.58%、98.14%、101.37%和97.43%。对应的RSD分别为2.02%、1.83%、2.50%、1.78%、1.87%、0.83%、1.69%、1.70%和1.88%。
2.4 供试品溶液提取条件的优化
采用单因素变量法,精密称取7份裸花紫珠样品粉末0.5 g,进行提取溶剂优化(溶剂分别为25 mL纯水、20%甲醇、40%甲醇、50%甲醇、60%甲醇、80%甲醇、纯甲醇,40 kHz、500 W超声提取30 min)、超声时间优化(40 kHz、500 W分别超声提取15、30、45、60、75、90 min)、提取液固比的优化(分别加入10、25、40、50、65、75 mL 50%甲醇,40 kHz、500 W超声提取30 min),按“2.2”项色谱条件进样测定,分别对峰面积进行比较,评价提取效果。最终确定最佳提取条件为0.5 g裸花紫珠样品粉末加入25 mL 80%甲醇,超声45 min。结果如图2所示。
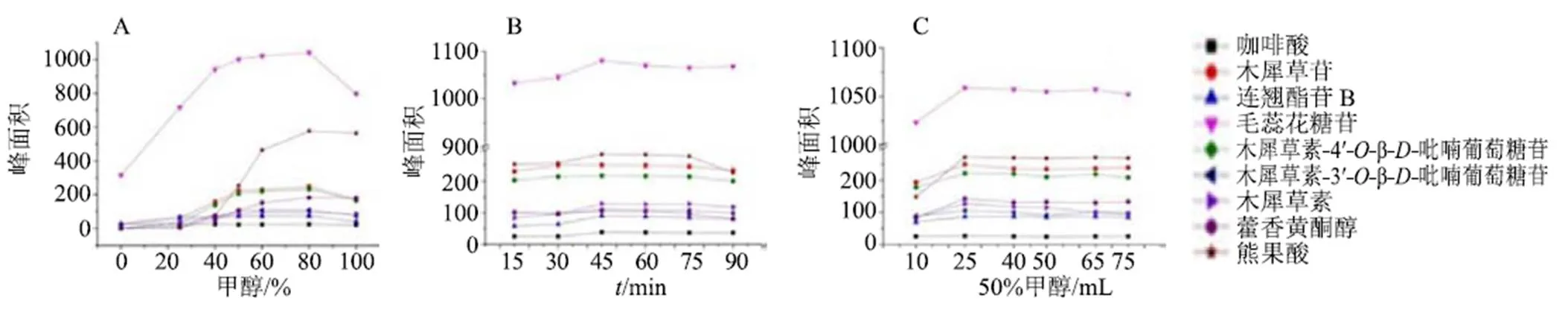
图2 供试品溶液提取条件提取溶剂(A)、超声时间优化(B) 不同提取液固液比(C) 优化
2.5 化学模式识别分析
2.5.1 主成分分析 使用SPSS21.0软件对83批裸花紫珠药材中9种活性成分进行主成分分析,得到 83×9阶数据矩阵,以主成分特征值>1为标准,提取得到了2个主成分,其累积贡献率为77.33%。第1主成分特征值为3.53,方差贡献率为49.20%,根据因子载荷矩阵反映各主成分与原始变量之间的相关系数,可知第1主成分主要反映了毛蕊花糖苷、连翘酯苷B和咖啡酸的信息,表明其对第1主成分的影响较大,可为裸花紫珠的质量评价提供参考依据;第2主成分特征值为1.63,方差贡献率为28.13%,主要反映了熊果酸和木犀草素的信息。分析结果表明,裸花紫珠的前2个主成分可概括原有数据的绝大部分信息。计算83批裸花紫珠样品的主成分得分,以各主成分对应的贡献率为权重系数计算综合得分(1为第1主成分得分,2为第2主成分得分,为综合得分),并进行排序,结果见表3。综合得分较高的前4位分别为批次S19、S83、S77和S55,其综合得分均大于1,说明这4个批次的裸花紫珠样品质量较好,与其他样品差异较大。
2.5.2 正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)以83批裸花紫珠的9个活性成分峰峰面积为变量,使用SIMCA 14.1软件进行OPLS-DA分析,结果如图3-A所示。OPLS-DA 载荷图中的每个圆点代表一个化合物,化合物越远离原点,表示其在组间的差异性越大。从图中可以看出,化合物1(咖啡酸)、化合物3(连翘酯苷B)、化合物4(毛蕊花糖苷)和化合物9(熊果酸)明显偏离主化合物群,与主成分分析结果一致。通过设置VIP值大于1筛选出影响裸花紫珠成分差异的标志性成分,结果见图3-B。初步筛选出咖啡酸、连翘酯苷B、毛蕊花糖苷和熊果酸4个差异成分,这与载荷图的结果相一致。表明以上成分可能是导致裸花紫珠质量产生差异的关键因素。
表3 83批裸花紫珠的主成分因子得分和排序
Table 3 Factor scores and sorting of principal component factors of 83 batches of C. nudiflora
编号Y1Y2Y排名编号Y1Y2Y排名 S10.35 0.230.1850S430.42 0.230.2143 S20.35 0.180.1754S440.81 0.120.3429 S30.22 0.290.1458S450.21 0.040.0973 S40.28 0.260.1655S460.59−0.140.2145 S50.07 0.310.0875S470.58 0.100.2540 S60.23 0.010.0971S481.28−0.260.4520 S70.29 0.010.1263S491.78−0.470.6114 S80.30 0.000.1262S500.57 0.230.2737 S91.32 0.150.5416S510.41 0.250.2144 S100.59 0.220.2735S520.28 0.030.1264 S111.08 0.110.4421S530.78 0.110.3331 S121.14 0.100.4719S541.29 0.030.5117 S130.35 0.260.1848S552.74−0.231.03 4 S140.44 0.220.2142S560.53 0.150.2341 S150.39 0.260.2046S570.69−0.080.2638 S160.36 0.220.1849S580.73−0.080.2734 S171.01 0.100.4124S590.71 0.090.2933 S180.34 0.240.1851S601.27−0.170.4718 S194.17−0.481.55 1S611.94−0.110.7411 S200.32 0.260.1753S622.16−0.300.79 8 S210.82 0.180.3527S630.20 0.230.1261 S220.17 0.220.1168S640.18 0.330.1359 S230.19 0.300.1360S651.88−0.030.7313 S240.13 0.030.0678S660.81 0.170.3528 S250.11 0.010.0483S670.40 0.210.1947 S260.13 0.030.0678S680.94 0.190.4025 S270.11 0.040.0582S690.47 0.340.2539 S280.15 0.280.1166S700.81 0.280.3726 S290.12 0.030.0580S712.04 0.040.81 6 S300.12 0.030.0580S722.23 0.010.88 5 S310.22 0.300.1457S730.27 0.240.1556 S321.08 0.110.4421S740.07 0.270.0876 S331.99−0.030.77 9S750.11 0.240.0974 S341.05 0.170.4423S760.72−0.080.2736 S350.33 0.240.1752S773.07−0.251.16 3 S361.90−0.060.7312S780.14 0.260.1070 S371.50 0.020.5915S790.17 0.230.1167 S382.09−0.080.80 7S800.18 0.230.1165 S390.72 0.110.3032S810.12 0.320.1169 S400.06 0.240.0777S821.98−0.090.7610 S410.09 0.310.0972S833.33−0.321.25 2 S420.80 0.130.3430
2.6 裸花紫珠多成分含量测定
按照已验证的定量方法,对83批不同产地和不同采收时间的裸花紫珠样品(S1~S83)进行比较分析,结果见表4。通过比较海南白沙和五指山8月采收的样品可知,海南白沙9个成分总质量分数为9.492 1%,毛蕊花糖苷占比86.22%,熊果酸占比4.53%,木犀草苷占比3.16%,连翘酯苷B苷占比2.40%,木犀草素- 4′--β--吡喃葡萄糖苷占比1.80%,木犀草素- 3′--β--吡喃葡萄糖苷占比1.10%,其他3个成分共占比0.78%,毛蕊花糖苷量高达8.1842%。而海南五指山9个成分总含量为4.921 2%,毛蕊花糖苷占比74.28%,熊果酸占比11.87%,连翘酯苷B苷占比4.56%,木犀草苷占比3.66%,木犀草素- 4′--β--吡喃葡萄糖苷占比2.74%,其他4个成分共占比2.89%。海南白沙8月份总含量比其他采集时间明显更高,此时毛蕊花糖苷含量达到峰值,且均高于海南五指山的含量。由以上分析可知海南白沙裸花紫珠的品质总体比海南五指山高出许多。
表4 83批裸花紫珠样品的含量测定结果
Table 4 Results of determination of content of 83 batches of C. nudiflora
编号质量分数/% 咖啡酸木犀草苷连翘酯苷B毛蕊花糖苷木犀草素-4′-O-β-D-吡喃葡萄糖苷木犀草素-3′-O-β-D-吡喃葡萄糖苷木犀草素藿香黄酮醇熊果酸总量 S10.005 10.106 60.018 50.452 60.099 30.042 80.020 10.046 80.542 81.334 6 S20.001 90.088 50.021 90.498 40.097 00.032 60.018 80.048 40.461 41.268 9 S30.003 20.068 50.011 60.258 40.041 10.026 60.025 90.059 40.575 21.069 9 S40.004 40.070 80.014 80.367 10.067 10.022 40.025 20.050 80.581 01.203 6 S50.000 00.012 40.000 00.032 00.006 90.003 90.042 20.056 20.576 10.729 7 S60.002 30.079 60.014 70.360 20.066 40.027 40.020 20.050 00.038 40.659 2 S70.003 70.108 50.017 20.426 80.095 10.033 30.014 60.053 60.049 60.802 4 S80.004 90.102 70.019 90.442 50.102 30.034 70.020 60.059 00.037 70.824 3 S90.099 90.159 70.218 92.192 20.125 50.054 90.043 70.044 30.603 43.542 5 S100.010 30.081 30.039 50.979 80.077 50.026 60.022 60.057 50.594 51.889 6 S110.027 00.163 10.144 81.835 70.123 70.041 10.036 40.052 50.506 32.930 6 S120.026 20.284 90.135 91.844 30.140 70.042 40.040 40.051 60.488 13.054 5 S130.005 80.095 90.019 10.461 50.087 20.030 20.026 90.048 80.592 41.367 8 S140.011 30.097 80.024 90.650 00.094 30.031 00.023 50.046 80.559 01.538 6 S150.017 90.169 90.028 30.426 40.123 50.056 00.052 20.046 60.541 21.462 0 S160.018 10.096 60.028 00.448 90.156 20.035 90.037 80.046 00.544 71.412 2 S170.010 80.197 10.154 91.622 10.141 90.056 60.018 90.039 40.492 02.733 7 S180.004 60.076 70.053 60.454 80.070 70.027 00.025 40.035 60.552 51.300 9 S190.009 50.300 50.227 78.184 20.171 10.104 60.013 90.050 50.430 19.492 1 S200.003 40.131 70.023 00.351 40.114 50.049 40.028 40.067 70.547 61.317 1 S210.003 00.138 40.088 11.359 50.097 40.038 70.012 30.050 30.613 12.400 8 S220.001 20.043 20.004 70.188 10.051 10.015 30.018 20.046 40.478 80.847 0 S230.001 30.056 60.006 10.169 70.059 80.041 20.019 80.051 00.607 51.013 0 S240.001 70.059 60.005 70.181 00.053 10.019 70.018 70.047 60.049 10.436 2 S250.001 40.044 80.004 60.174 20.042 50.015 50.017 70.047 50.000 00.348 2 S260.001 30.053 10.006 30.189 80.049 60.018 10.019 80.049 20.044 80.432 0 S270.000 90.050 20.004 90.137 90.057 10.017 20.022 40.054 60.048 40.393 6 S280.001 10.049 10.002 90.126 50.056 30.017 00.023 90.047 20.584 10.908 1 S290.001 30.050 20.004 90.164 30.057 70.017 10.020 60.048 80.042 30.407 2 S300.001 30.050 20.004 90.164 30.057 70.017 10.020 60.048 80.042 30.407 2 S310.002 90.064 60.005 00.211 50.069 80.050 40.026 20.054 20.593 91.078 5 S320.034 00.189 60.118 51.792 20.154 20.055 80.062 60.036 00.498 92.941 8 S330.025 60.180 00.224 53.655 60.134 70.058 60.016 50.041 50.584 24.921 2 S340.014 80.217 10.097 21.708 40.150 80.062 40.029 20.057 60.615 92.953 4 S350.004 30.119 10.012 40.401 80.098 30.041 30.027 00.054 50.525 51.284 2 S360.046 40.211 30.214 83.422 60.187 60.062 20.026 70.045 70.482 44.699 7 S370.042 90.186 90.136 32.673 90.153 20.046 00.004 70.048 10.520 53.812 5 S380.054 40.234 60.158 23.833 00.193 60.069 10.038 50.046 90.494 95.123 2 S390.009 60.129 20.217 51.051 40.119 80.041 40.026 30.030 90.403 02.029 1 S400.000 00.016 20.000 00.039 80.009 20.006 60.044 70.048 10.433 90.598 5 S410.000 20.014 90.002 10.068 00.010 60.004 30.016 50.052 60.617 20.786 4 S420.026 10.129 70.044 81.351 60.131 00.038 40.017 90.048 70.514 92.303 1 S430.011 00.106 10.043 70.577 10.095 80.039 00.029 60.040 30.559 11.501 7 S440.005 10.148 10.102 11.359 00.061 10.039 50.007 50.048 00.457 82.228 2 S450.005 00.093 30.008 00.302 70.063 90.037 50.034 30.051 90.037 80.634 4 S460.005 10.091 90.025 10.987 30.316 10.042 60.005 80.044 50.042 91.561 3 S470.004 80.066 90.010 31.056 70.018 20.033 00.003 20.031 10.345 91.570 1 S480.003 00.075 10.041 22.238 70.701 40.042 20.002 10.032 30.363 03.499 0 S490.001 10.091 80.084 63.075 91.128 60.028 50.005 70.030 20.447 14.893 5 S500.015 60.280 10.097 90.626 50.125 00.074 60.018 90.057 00.509 11.804 7 S510.009 00.219 50.028 00.400 60.153 20.080 00.022 00.054 00.546 61.512 9 S520.006 10.129 70.021 00.363 40.111 80.044 00.048 70.060 00.047 40.832 1 S530.009 40.153 40.071 81.275 80.146 40.039 00.004 10.050 40.480 72.231 0 S540.009 20.179 80.083 62.289 00.162 30.051 00.005 20.047 20.493 03.320 3
续表4
将江西地区同年9月到12月样品进行比较分析可知,12月样品其总含量比其它采集时间明显更高,江西普正药业菜园、药园和江西上犹9个成分总含量分别为4.893 5%、6.431 8%和4.613 8%,且毛蕊花糖苷、木犀草素-4′--β--吡喃葡萄糖苷、熊果酸和木犀草苷这4个成分含量比其他采集时间明显更高。且海南白沙11~12月9个成分总含量与江西上犹和普正药业药园11~12月9个成分总含量趋势相似。12月在海南白沙中9个成分总含量为5.123 2%。
此外,本实验还测定了另外22批其他产地的裸花紫珠样品(S62~S83),按“2.1.2”项下方法制备供试品溶液,按“2.2”项下色谱条件测定,计算样品含量,测定结果均在线性范围内(除咖啡酸、连翘酯苷)。且江西峡江2016年10月到12月样品中9中活性成分的总含量与江西以南其它地区吉安、上犹不尽相同,而2017年和2014年总含量变化也基本遵循吉安、上犹规律。
通过对5种紫珠属其他样品的9种活性成分进行初步比较分析(表5),其咖啡酸、木犀草苷、连翘酯苷B、毛蕊花糖苷、木犀草素-4′--β--吡喃葡萄糖苷、木犀草素-3′--β--吡喃葡、木犀草素、藿香黄酮醇和熊果酸的质量分数分别为0~0.034 1%、0.000 6%~0.322 9%、0.0070%~1.549 4%、0.541 0%~6.563 1%、0.001 3%~1.140 0%、0.001 6%~0.0527%、0.002 3%~0.031 2%、0~0.059 9%和0.143 1%~0.648 9%。可知同属不同种紫珠属植物所含化学成分种类基本一致,但成分含量存在一定差异性。与其他同属不同种紫珠属药用植物相比裸花紫珠药材中9种活性成分的总含量和毛蕊花糖苷含量均相对较高。
表5 紫珠属其他药用植物的9种成分的含量测定结果
Table 5 Results of content determination of nine components of other plants of Callicarpa
编号质量分数/% 咖啡酸木犀草苷连翘酯苷毛蕊花糖苷木犀草素-4′-O-β-D-吡喃葡萄糖苷木犀草素-3′-O-β-D-吡喃葡萄糖苷木犀草素藿香黄酮醇熊果酸总量 S840.000 00.009 10.172 10.849 60.001 60.007 20.005 80.020 00.143 21.208 6 S850.001 20.046 30.066 93.303 70.007 90.017 70.010 10.024 80.212 93.691 5 S860.003 90.224 00.032 31.802 00.509 20.026 50.006 60.001 00.557 63.163 1 S870.000 00.000 61.549 40.541 00.001 30.001 60.004 30.005 80.350 32.454 3 S880.000 00.001 40.008 40.751 90.095 90.003 70.002 30.025 00.326 61.215 2 S890.000 10.322 90.007 02.501 51.140 00.003 00.009 90.000 00.579 74.564 1 S900.000 00.177 00.196 75.321 81.027 90.008 80.002 50.012 80.648 97.396 4
3 讨论
采用Waters UHPLC系统,用梯度洗脱法在较短的时间内同时进行裸花紫珠中咖啡酸、木犀草苷、连翘酯苷B、毛蕊花糖苷、木犀草素-4′--β--吡喃葡萄糖苷、木犀草素-3′--β--吡喃葡萄糖苷、木犀草素、藿香黄酮醇和熊果酸共9个活性成分含量同时测定的方法。本实验在进行前期色谱条件优化实验时,通过采集200~400 nm全波长色谱图并比较各化合物的紫外吸收强度,发现除熊果酸外其它化合物的最大吸收峰均在332 nm附近,并且在332 nm的色谱图中这些化合物分离最好。而熊果酸在210 nm附近的吸收峰最高,但在332 nm波长下无紫外吸收。因此本实验最终采用双波长进行定量,即在332 nm波长下定量除熊果酸外的8个指标成分,在210 nm波长下定量熊果酸。在进行提取溶剂比例优化、超声时间优化、提取液固比的优化预试验后,比常用的HPLC[31]节省时间,大大提高了工作效率且减少了溶剂的消耗。并进行了方法学考察,结果表明9个活性分在各自的线性范围内线性良好(2>0.9993),精密度、重复性和稳定性的RSD值均小于3.00%,平均加样回收率在95.58%~101.73%,回收率的RSD值均小于2.50%。
采用本方法对不同产地及采收期的83批裸花紫珠药材进行比较分析。以9种活性成分含量为基础构建裸花紫珠的质量评价函数进行了主成分分析,可知江西峡江和海南白沙综合评分较高,裸花紫珠质量较好,其中丙烯酸类占总含量的85%以上,黄酮类占7%左右。但江西地区裸花紫珠药材的数据只有9月到12月的数据,因此对于江西地区裸花紫珠药材质量的变化规律有待进一步研究。此外,活性成分的积累规律与采收时间相关,毛蕊花糖苷等在春夏两季积累较多,秋冬两季较少,藿香黄酮醇、熊果酸含量随采收时间变化不大。
综上所述,产地和采收时间对活性成分含量影响极大,在不同样本间活性成分虽然大致相同,但各成分含量相距甚远。为了确保裸花紫珠产品及新药研发一致性,必须从药材源头严把关,建立药材产地GAP种植基地及饮片加工GMP建设及相关配套设施。而本研究建立的活性成分含量测定方法灵敏、稳定、准确,可用于裸花紫珠药材的质量分析。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志(第四十一卷)[M]. 北京: 科学出版社, 2006: 263.
[2] 宋潇, 黄胜, 袁莉, 等. 裸花紫珠资源、化学成分及药理作用研究近况 [J]. 中国医药导报, 2017, 14(6): 45-48.
[3] 张绮玲, 庞玉新, 杨全, 等. 裸花紫珠的本草考证 [J]. 广东药学院学报, 2014, 30(5): 667-671.
[4] 陈学武, 姜靖雯, 张永杰, 等. 裸花紫珠对结肠癌细胞上皮间质转化、增殖及迁移的影响 [J]. 中国临床药理学杂志, 2021, 37(16): 2155-2158.
[5] 胡高文, 张荣珍, 黄昊. 酒精中毒的中医药治疗最新研究进展 [J]. 中国中医急症, 2016, 25(1): 110-113.
[6] 杨建琼, 李亚梅, 杨义芳, 等. 裸花紫珠叶的化学成分研究 [J]. 中药材, 2020, 43(7): 1617-1621.
[7] 孔凤利. 阿昔洛韦联合裸花紫珠分散片治疗带状疱疹40例 [J]. 中国药业, 2010, 19(5): 50-51.
[8] 李晓为. 裸花紫珠分散片联合复方多粘菌素B软膏治疗寻常痤疮临床疗效观察 [J]. 山西卫生健康职业学院学报, 2020, 30(5): 24-26.
[9] 杨帆, 邓慧鸣, 倪盼丽, 等. 飞机草-裸花紫珠联合用于止血抗炎的药效学研究 [J]. 广州化工, 2017, 45(5): 44-46.
[10] 杜梦斐, 窦欣, 陈勇. 裸花紫珠颗粒联合注射用哌拉西林钠他唑巴坦钠治疗下肢丹毒的效果及对炎性因子水平的影响 [J]. 中国民间疗法, 2021, 29(12): 93-95.
[11] 刘静瑛. 裸花紫珠胶囊治疗儿童EB病毒感染临床观察 [J]. 河北医学, 2016, 22(7): 1217-1218.
[12] 李亚梅, 杨扬, 杨义芳, 等. 裸花紫珠抗菌作用的谱效学研究 [J]. 中国现代应用药学, 2021, 38(11): 1294-1301.
[13] 颜小捷, 谷陟欣, 卢凤来, 等. FOLIN-酚比色法测定裸花紫珠中总酚含量 [J]. 中国实验方剂学杂志, 2013, 19(18): 74-78.
[14] 王红刚, 潘利明. 分光光度法测定5种紫珠属中药总黄酮的含量 [J]. 四川中医, 2013, 31(3): 57-58.
[15] 宋永强, 谌乐刚. 分光光度法测定裸花紫珠片中总黄酮含量 [J]. 海南医学, 2005, 16(6): 152.
[16] 谌乐刚, 宋永强. 分光光度法测定裸花紫珠药材水提物中总黄酮的含量 [J]. 华西药学杂志, 2005, 20(5): 449-450.
[17] 李俊, 陈红波, 王英瑛, 等. GC-MS测定坎地沙坦酯中微量的-亚硝基二甲胺和-亚硝基二乙胺 [J]. 中国现代应用药学, 2020, 37(13): 1615-1620.
[18] 颜祥云, 毛忠华, 黄文新, 等. HPLC同时测定裸花紫珠叶中金石蚕苷、阿克苷和木犀草苷含量 [J]. 哈尔滨医科大学学报, 2017, 51(2): 127-130.
[19] Shi Y T, Wu C Y, Chen Y H,. Comparative analysis of threeherbs using high performance liquid chromatography with diode array detector and electrospray ionization-trap mass spectrometry method [J]., 2013, 75: 239-247.
[20] Huang H, Tang C P, Ke C Q,. 3, 4-seco-isopimarane and 3, 4-seco-pimarane diterpenoids from[J]., 2021, 19(8): 632-640.
[21] 李亚梅, 杨扬, 杨义芳, 等. 基于UPLC-Q-TOF MS/MS技术的裸花紫珠不同溶剂提取物的成分分析 [J]. 中药材, 2020, 43(11): 2707-2712.
[22] 李亚梅, 杨扬, 杨义芳, 等. 裸花紫珠抗菌作用的谱效学研究 [J]. 中国现代应用药学, 2021, 38(11): 1294-1301.
[23] 李亚梅, 杨义芳, 康兴东, 等. 基于降低血管通透性的裸花紫珠收敛作用的谱效关系研究 [J]. 中华中医药杂志, 2021, 36(9): 5589-5594.
[24] Fu H Z, Ma Y Y, Ma S C,. Two new iridoid glycosides from[J]., 2020, 22(3): 264-270.
[25] 冯世秀, 张旻, 易博, 等. 裸花紫珠化学成分与药理活性研究进展 [J]. 中草药, 2017, 48(5): 1015-1026.
[26] Huang B, Fu H Z, Chen W K,. Hepatoprotective triterpenoid saponins from[J].(), 2014, 62(7): 695-699.
[27] 邓杰仁, 杨义芳, 李小锋, 等. 裸花紫珠UPLC指纹图谱的建立 [J]. 中成药, 2020, 42(7): 1926-1930.
[28] Li Y M, Yang Y F, Kang X D,. Study on the anti-inflammatory effects ofbased on the spectrum-effect relationship [J]., 2022, 12: 806808.
[29] 何艳, 胡小祥, 胡雯婷, 等. HPLC同时测定裸花紫珠系列制剂中6种成分的含量 [J]. 中国现代应用药学, 2021, 38(22): 2815-2819.
[30] 李秀敏, 王勇, 张俊清, 等. HPLC法同时测定裸花紫珠中3种苯乙醇苷类成分的含量 [J]. 广州化工, 2019, 47(11): 104-106.
[31] Zheng D K, Chen W K, Ma S C,. Study on HPLC fingerprint ofand determination of ten components [J]., 2015, 40(9): 1776-1782.
Quality evaluation offrom different origins, picking stages and other plants ofbased on simultaneous determination of nine active components by UHPLC
YANG Zu-fan1, 2, YANG Yang3, YANG Yi-fang3, KANG Xing-dong4, LI Xiao-feng4, WU Yong-zhong4, XIAO Jun-ping4, WANG Wen1, JIA Qiang-qiang1, ZHOU Bin3
1. State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining 810016, China 2. Medical College of Qinghai University, Xining 810001, China 3. Shanghai Institute of Pharmceutical Industry, Shanghai 201203, China 4. Jiangxi Puzheng Pharmaceutical Co., Ltd., Ji’an 331409, China
An UHPLC-UV method was established for simultaneously determination of nine active components in, and compare samples from different origins and picking stages.Phenomenex Kintex XB-C18column were performed on HPLC analysis, the mobile phase was acetonitrile (A)-0.1% phosphoric acid (B) for gradient elution. The flow rate was 0.3 mL/min, the wavelength was 280 nm and 332 nm and the column temperature was 45 ℃. The contents of nine active components in 83 batches ofand seven batches of different species of medicinal plants ofwere measured simultaneously, combined with principal component analysis and orthogonal partial least squares discriminant analysis (OPLS-DA), which were applied in the comprehensive analysis of.A method for simultaneous quantification of nine active components inwas established. Caffeic acid, luteoloside, forsythoside B, acteoside, luteolin-4'--β--glucopyranoside, luteolin-3′--β--glucopyranoside, luteolin, pachypodol and ursolic acid had good linearity in the range of 1.240—124.0 μg/mL, 2.040—204.0 μg/mL, 1.020—101.6 μg/mL, 5.100—510.0 μg/mL, 0.9040—90.40 μg/mL, 0.9820—98.20 μg/mL, 0.8720—87.20 μg/mL, 0.8220—82.20 μg/mL and 2.280—228.0 μg/mL, respectively. The RSD of precision, repeatability and stability was less than 3.00% and the average recovery value was between 95.58%—101.73%, with RSD less than 2.50%. Principal component analysis screened out two ingredients, and the cumulative variance contribution rate was 77.33%, indicating that the main ingredients contained the most information of the raw statistics. OPLS-DA screened out four differential components, including caffeic acid, forsythoside B, acteoside and ursolic acid.The established method of multi-component quantitative analysis can be applied to the quality assessment of, which also can provide reference for the quality control and the development of related prescriptions of.
Hook. et Arn.; UHPLC-UV; principal component analysis; multi-component quantitative analysis; phenylacrylic acids; flavonoids; caffeic acid; luteoloside; forsythoside B; acteoside; luteolin-4'--β--glucopyranoside; luteolin-3′--β--gluco- pyranoside; luteolin; pachypodol; ursolic acid
R286.2
A
0253 - 2670(2023)14 - 4631 - 10
10.7501/j.issn.0253-2670.2023.14.024
2022-12-06
国家自然科学基金资助项目(31460082);国家自然科学基金资助项目(R1402824);国家中医药管理局(ZYBZH-C-JX-40);青海省科技厅国际合作项目(2022-HZ-812)
杨祖凡(1998—),女,硕士研究生,主要从事药物分析。E-mail: 1011724401@qq.com
贾强强,男,博士,副教授,主要从事药物分析。E-mail: jia1108029@163.com
周 斌,男,博士,研究员,主要从事医药产业经济政策与医药政策法规策略。E-mail: zhoubin@sinopharm.com
[责任编辑 时圣明]
