乙唑螨腈亚致死剂量对二斑叶螨解毒酶系的影响
2023-07-20聂鹏成杨若兰王菲菲尚素琴
聂鹏成,杨若兰,袁 绍,白 欣,王菲菲,尚素琴
(甘肃农业大学 植物保护学院,兰州 730070)
二斑叶螨(TetranychusurticaeKoch)作为一种世界性害螨,寄主植物超过1 000种,包括农作物、蔬菜、果树、林木、花卉、杂草及药材等[1]。二斑叶螨的取食活动会导致作物质量降低,严重时致使作物减产甚至绝收,给农业生产造成巨大损失,但因其体型小、发育历期短、短期内易爆发、扩展速度快、寄主广泛,易产生抗性等特点[2],防治极其困难。
目前,二斑叶螨的防治主要依靠化学药剂,但由于新型杀螨剂更新慢或者普及度较差,以及药剂使用不科学,二斑叶螨对许多化学药剂产生较强的抗性[3]。害螨对化学药剂产生抗性的机制包括忌避、代谢、储存、排出和降低敏感度等[4],在代谢抗性中,主要依赖羧酸酯酶(carboxylesterase CarE)、谷胱甘肽-S-转移酶(glutathione S-transferase GSTs)、多功能氧化酶(multifunctional oxidase MFO)[5],其中CarE能与进入螨体内的杀螨剂迅速结合并将其降解,使杀螨剂失去原有作用;GSTs能与杀螨剂中具有毒理作用的亲电基团结合并将其排出体外;MFO负责各类氧化代谢作用,可通过脱甲基作用代谢杀虫剂,参与多种杀螨剂的代谢分解[6]。当害螨遭受化学药剂胁迫时,会提高解毒酶的活性,或者增强代谢能力以减小化学药剂对自身带来的损害[7]。
田间施药后,由于时间的延长和个体接受到的剂量不同,部分害螨会接触到药剂亚致死剂量,亚致死剂量是指不导致昆虫死亡但可以影响昆虫正常活动或生理行为,甚至导致种群增长率升高或降低的剂量[8],亚致死剂量还会对害螨体内解毒酶系的活性产生影响,而解毒酶系活性的增强与减弱关乎害螨代谢化学药剂的能力,其中解毒酶系活性的增强是害螨产生代谢抗性的根本原因[9],因此,杀螨剂不同亚致死剂量与处理时间的长短对害螨体内解毒酶活性的影响是亟需探究的一个问题。
乙唑螨腈属新型高效杀螨剂,与现有杀螨剂无交互抗性,有良好的速效性与持效性,对蜜蜂、鱼、鸟、蚕等非靶标生物均表现低毒。对害螨包括卵在内的各个时期均有较好防效[10],且短时间内对种群抗性增长无显著影响[11]。对常见害螨的防治效果及对植物与天敌的安全性优于市面常见杀螨剂,如丁氟螨酯、联苯菊酯、螺螨酯、乙唑螨和哒螨灵等,但当前的研究主要集中在防效等方面,对于进入二斑叶螨体内的代谢机制尚无报道[12-16]。
本试验测定并分析乙唑螨腈亚致死剂量LC10和LC30对二斑叶螨体内3种解毒酶的比活力、米氏常数(Km)和最大反应速率(Vmax)随时间变化的情况,旨在从生理水平揭示二斑叶螨对乙唑螨腈的代谢抗性机理,并以此为乙唑螨腈的安全、合理使用及二斑叶螨的防治与抗药性治理提供参考。
1 材料与方法
1.1 材料来源
供试虫源:二斑叶螨源自长期室内饲养的敏感种群,饲养条件为:温度(25±1)℃,相对湿度(60±5)%,光周期L∶D=16 h∶8 h。在不接触任何化学药剂的情况下培养多代后,取雌成螨备用。寄主植物选择室内盆栽1周左右的豇豆(Vignaunguiculata(Linn.)Walp)幼苗。
供试药剂与试剂:30%乙唑螨腈悬浮剂(沈阳中化农药化工研发有限公司),考马斯亮蓝 G-250,≥99%α-萘酚(1-naphthol),还原性谷胱甘肽(reduced glutathione,GSH),>98%还原型辅 酶Ⅰ(NADPH,北京索莱宝科技有限公司),固蓝B盐(上海源叶生物科技有限公司),毒扁豆碱(甘肃金博研生物科技有限公司),牛血清白蛋白(bovine serum albumin,BSA),≥99% 1-氯-2,4-二硝基苯(CDNB),十二烷基磺酸钠(sodium laurylsulfonate,SDS,上海中秦化学试剂有限公司), α-乙酸萘酯,≥99.5%乙二胺四乙酸(EDTA,天津市光复科技发展有限公司),≥99.5%对硝基苯酚(德州科析化工产品有限公司),甲醇溶液(西安化学试剂厂),对硝基苯甲醚(安庆圣阳化学有限公司)。
供试仪器: S·HH·W21·420S 型电热恒温水浴锅,H1850R 型高速冰冻离心,ELX800UV 酶标仪,AR224CN 电子天平,UPD-I-20T 超纯水器,RXZ智能型光照培养箱。
1.2 实验方法
1.2.1 乙唑螨腈对二斑叶螨的室内毒力测定 采用叶片浸渍法测定乙唑螨腈对二斑叶螨的毒力。选取直径为9.5 cm,高为1.0 cm的培养皿,将直径为9 cm的圆海绵放入培养皿,然后将直径9 cm滤纸平铺于海绵表面,加水至海绵与滤纸充分浸湿并有余水。取新鲜的豇豆叶片,置于培养皿中,使叶背朝上叶面紧贴滤纸,将叶缘和叶柄用完全浸水的脱脂棉覆盖。每片叶片接雌成螨30头左右,置于养虫室中30~60 min后,在双目解剖镜下观察并剔除死亡(触之不动者视为死亡)与不活泼的个体,记载实际的螨头数,作为供试 基数。
将乙唑螨腈悬浮剂稀释为0.05、0.1、0.2、0.4、0.8 mg·L-15个不同浓度的药液,并采用相同溶剂配比的甲醇水溶液作为对照。将带有雌成螨的叶片完全浸入配置好的药剂并轻轻摇动 5 s后取出,用吸水纸快速吸干多余的药液,最后将叶片平放回培养皿,重新用浸水脱脂棉包围叶缘和叶柄。每个浓度设3个重复。48 h后,记录螨的死亡数。以校正死亡率为基础拟合毒力回归方程,并由此计算出其亚致死浓度LC10和LC30。
1.2.2 亚致死剂量浓度处理 在温度(25± 1)℃、相对湿度(60±5)%、光周期L∶D= 16 h∶8 h的人工气候箱里使用盆栽豇豆繁殖二斑叶螨,待二斑叶螨繁殖2~3代后备用。将乙唑螨腈LC10和LC30分别配置成1.5 L药液,对照为相同溶剂配比的甲醇水溶液,将带有二斑叶螨的叶片浸渍5 s,置于光照培养箱,分别于6、12、24、36、48、60 h挑取150头雌成螨至1.5 mL离心管,用液氮冷冻后放入-80 ℃冰箱,备用。采用相同配比的甲醇水溶液作为对照组。每个处理在各时间点重复3次。
1.2.3 酶源的制备及蛋白含量测定 将收集的试虫分别用1.5 mL预冷的66 mmol·L-1(pH 7.0)、0.04 mol·L-1(pH 7.0)、0.1 mol·L-1(pH 7.8)PBS缓冲液匀浆,4 ℃下12 000g离心15 min,取上清液即为GSTs、CarE、MFO酶液, 4 ℃保存,备用。参照Bradford[17]考马斯亮蓝 G-250法测定酶源蛋白含量。
1.2.4 二斑叶螨解毒酶比活力的测定 CarE比活力测定采用何恒果[18]的方法。以α-乙酸萘酯作为反应底物,在30 ℃下经酯酶水解反应10 min后,加入显色剂(1%固兰B水溶液∶5%十二烷基磺酸钠=2∶5),用酶标仪测600 nm处OD值。然后根据α-萘酚标准曲线和酶源蛋白含量,将OD值换算成酶比活力(μmol·μg-1·min-1)。
GSTs比活力测定采用何恒果[18]、Clark等[19]的方法。37 ℃条件下,以CDNB为底物,经GSTs作用与GSH反应,用酶标仪在340 nm处以30 s为间隔测定5 min内OD值,参照Habig等[20]方法计算GSTs比活力(μmol·μg-1·min-1)。
MFO比活力测定采用Kim等[21]、何恒果[18]的方法。以对硝基苯甲醚为底物,氧和 NADPH 作电子供体,37 ℃下水浴反应30 min,经MFO催化发生氧脱甲基反应生成对硝基苯酚,用1 mol·L-1盐酸终止反应。然后用氯仿和0.5 mol·L-1NaOH溶液萃取,用酶标仪在400 nm处测OD值。最后将OD值按照对硝基苯酚标准曲线和酶源蛋白含量换算成酶比活力(μmol·μg-1·min-1)。
酶动力学常数测定参照文献[22],将CDNB稀释成0.75、1.5、3、6、12、24 mmol·L-1作为GST的底物,将α-乙酸萘酯(含毒扁豆碱)稀释成0.075、0.15、0.3、0.6、1.2 mmol·L-15个浓度作为CarE底物,将对硝基苯甲醚稀释成3.144、4.192、5.240、6.288、7.336、8.384 mmol·L-1作为MFO底物,酶活性测定的方法同上,以Lineweaver-Burk 双倒数作图法原理为基础,利用 Excel线性回归分析计算出Km和Vmax。
1.3 数据分析
对试验数据均采用Excel 2013和SPSS 22.0进行统计分析,采用Duncan氏新复极差法进行显著性差异检验。
2 结果与分析
2.1 亚致死浓度的确定
乙唑螨腈处理二斑叶螨48 h后,毒力回归方程为y=0.99+1.11x,R=0.995,其中x代表剂量对数,y代表死亡百分率,LC50为0.127 mg·L-1,由此计算得到LC40、LC30、LC20和LC10分别为0.075、0.043、0.022和0.009 mg·L-1。并选择LC30、LC10做为亚致死浓度。
2.2 解毒酶比活力
2.2.1 羧酸酯酶(CarE)比活力 如图1所示,二斑叶螨雌成螨经乙唑螨腈亚致死剂量LC10和LC30处理后,其体内的羧酸酯酶比活力较对照组都有显著提高(P<0.05),二者均在6~12 h降低,12~24 h上升至最大值,此时LC10和LC30分别是对照的1.46和1.85倍,在24~36 h快速降低,在36~60 h缓慢降低的趋势,且LC10处理组羧酸酯酶比活力显著低于LC30处理组(P< 0.05)。对照组羧酸酯酶比活力则在6~24 h缓慢上升,24~36 h缓慢下降,36~60 h再次缓慢上升至最大值。LC10处理CarE比活力较对照在各时间点分别增长49.03%、20.18%、45.66%、24.50%、9.52%、2.97%,LC30分别增长 87.41%、37.02%、84.72%、35.30%、20.61%、11.43%,这说明乙唑螨腈亚致死浓度对羧酸酯酶的比活力均有影响,且不同的浓度和处理时间对羧酸酯酶的比活力产生的影响会有差异。
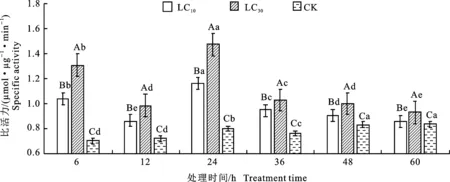
数据为平均数±标准误。不同大小写字母表示同一时间不同处理或同一处理不同时间解毒酶比活力经Duncan氏新复极差法检验在 P<0.05 水平差异显著。下同
2.2.2 谷胱甘肽-S-转移酶(GSTs)比活力 如图2所示,经乙唑螨腈亚致死剂量LC10和LC30处理后,LC30处理组GSTs活性在6~12 h升高至最大值,是对照的1.24倍,在12~48 h逐渐降低至与6 h无显著差异(P>0.05),最后在48~60 h再次升高;而LC10比活力则在6~24 h降至最低且低于对照,24~36 h升高至最大值,此时为对照的1.26倍,然后在36~48 h降低,最后在 48~60 h再次升高。LC10处理组GSTs比活力在12 h、24 h时低于对照组,GSTs处于抑制状态,其他时间点LC10、LC30处理组的比活力较对照组有显著升高(P<0.05),且除36 h外,LC30处理组GSTs比活力都显著高于LC10(P< 0.05)。LC10处理GSTs比活力较对照在各时间点分别增长18.70%、-7.39%、-3.53%、25.95%、13.23%、6.72%,LC30分别增长 22.79%、24.24%、35.67%、18.12%、18.30%、15.27%,这说明乙唑螨腈对谷胱甘肽S-转移酶比活力的诱导作用存在浓度和时间效应。
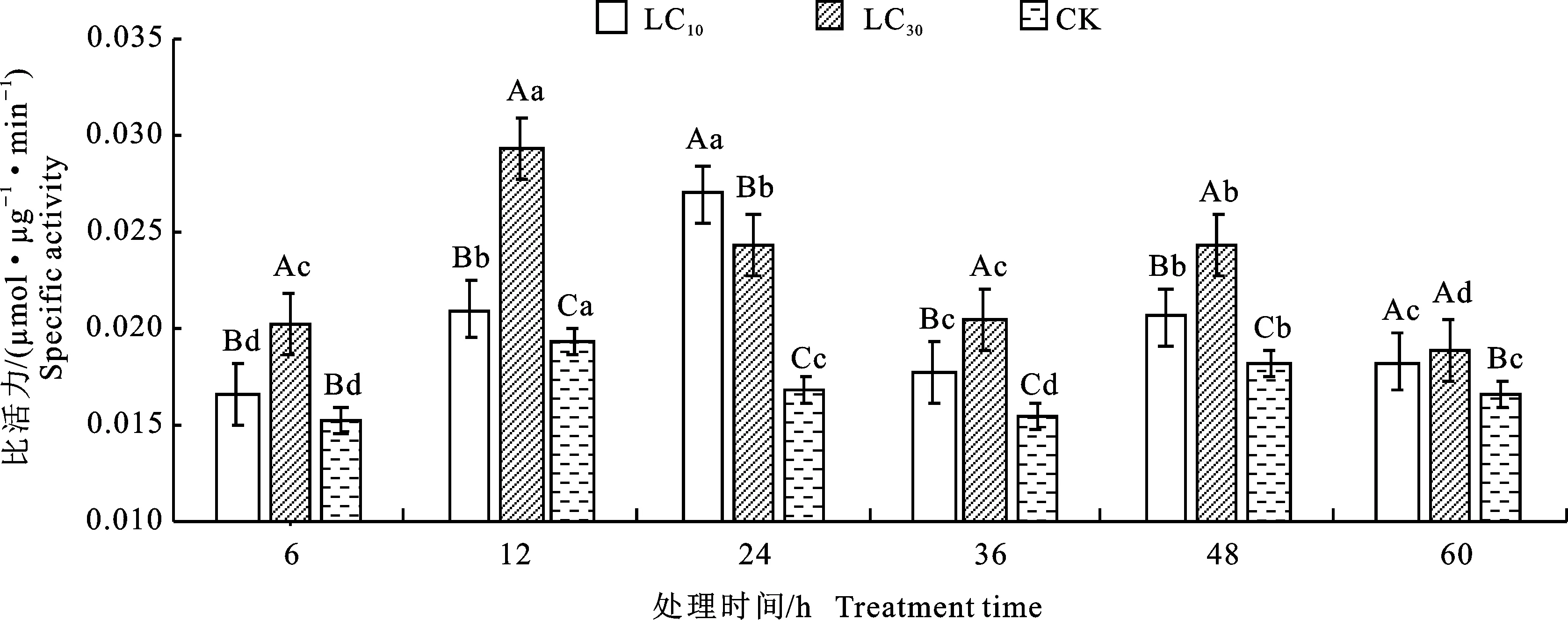
图2 乙唑螨腈亚致死剂量下二斑叶螨雌成螨体内谷胱甘肽S-转移酶(GSTs)比活力
2.2.3 多功能氧化酶(MFO)比活力 由图3可知,经乙唑螨腈亚致死剂量LC10、LC30处理后,二斑叶螨体内MFO比活力显著高于对照组(P<0.05)。LC30处理组除24 h低于LC10处理组外,其他时间都显著高于LC10(P<0.05),且变化趋势与对照组相似,呈现出 6~12 h上升至最大值,此时LC30为对照的1.52倍,在12~36 h下降至与6 h无显著差异,然后在36~48 h再次上升,最后在48~60 h下降的趋势。LC10处理组MFO比活力在6~24 h上升至最大值,此时为对照的1.61倍,在24~36 h下降,然后在36~48 h再次上升,最后在48~60 h下降。LC10处理MFO比活力较对照在各时间点分别增长 8.63%、8.43%、61.31%、14.35%、13.22%、9.66%,LC30分别增长33.05%、52.12%、45.68%、31.82%、33.53%、14.23%,说明乙唑螨腈的浓度和处理时间不同,对多功能氧化酶比活力的影响也不同。
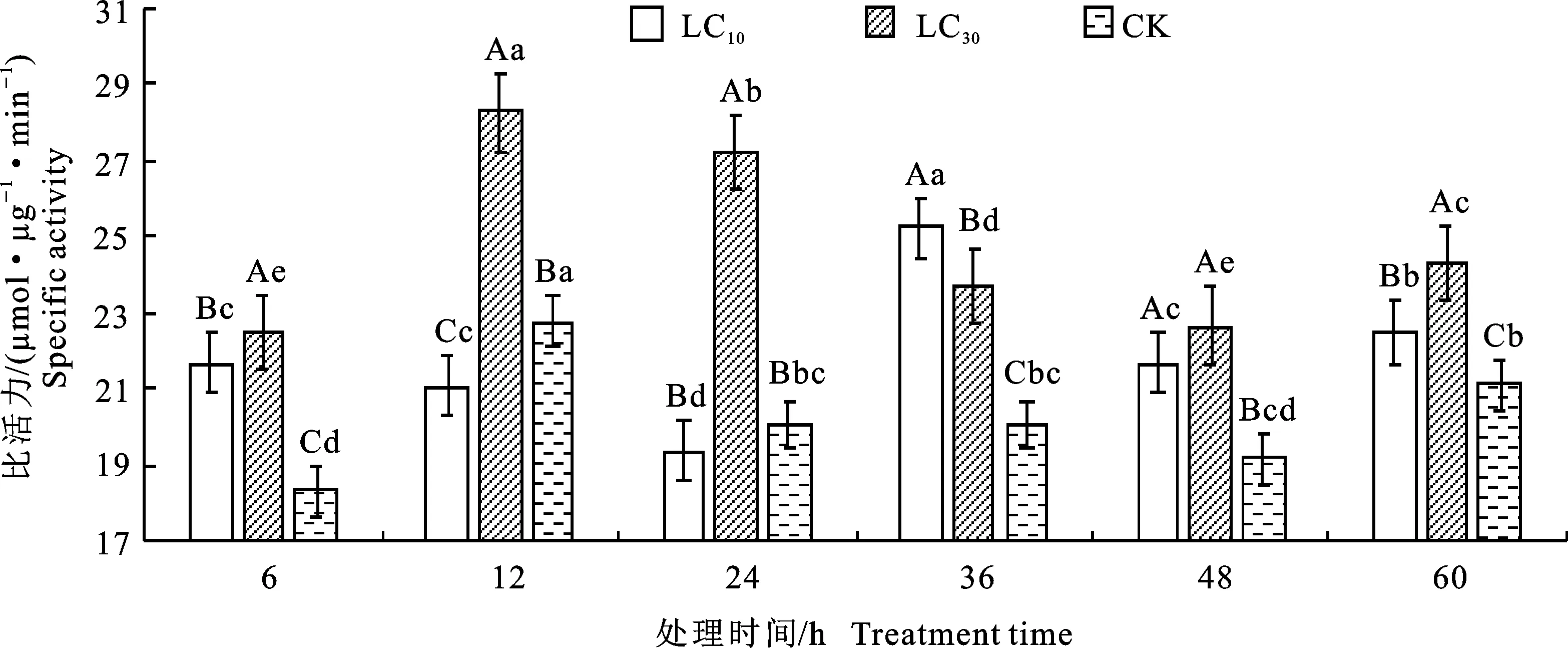
图3 乙唑螨腈亚致死剂量下二斑叶螨雌成螨体内多功能氧化酶(MFO)比活力
2.3 解毒酶动力学常数
2.3.1 谷胱甘肽-S-转移酶(GST)动力学常数 二斑叶螨雌成螨经乙唑螨腈亚致死剂量处理后体内GST的Km和Vmax的变化如表1所示。除12、24和48 h时LC10与对照无显著差异外(P>0.05),LC10与LC30的Km均显著高于对照组(P<0.05),处理组Km除36 h外其他时间点无显著差异,且LC30显著高于LC10(P<0.05);LC10组的Vmax除12 h、36 h时与对照无显著差异(P>0.05),24 h时显著高于对照(P<0.05)外,其他时间点对照都显著高于LC10处理组(P<0.05)。LC30处理Vmax在6、12、24、48和 60 h显著低于对照(P<0.05),而24 h与36 h时与对照无显著差异(P>0.05),且除36 h外的其他时间点都显著低于LC10(P<0.05)。
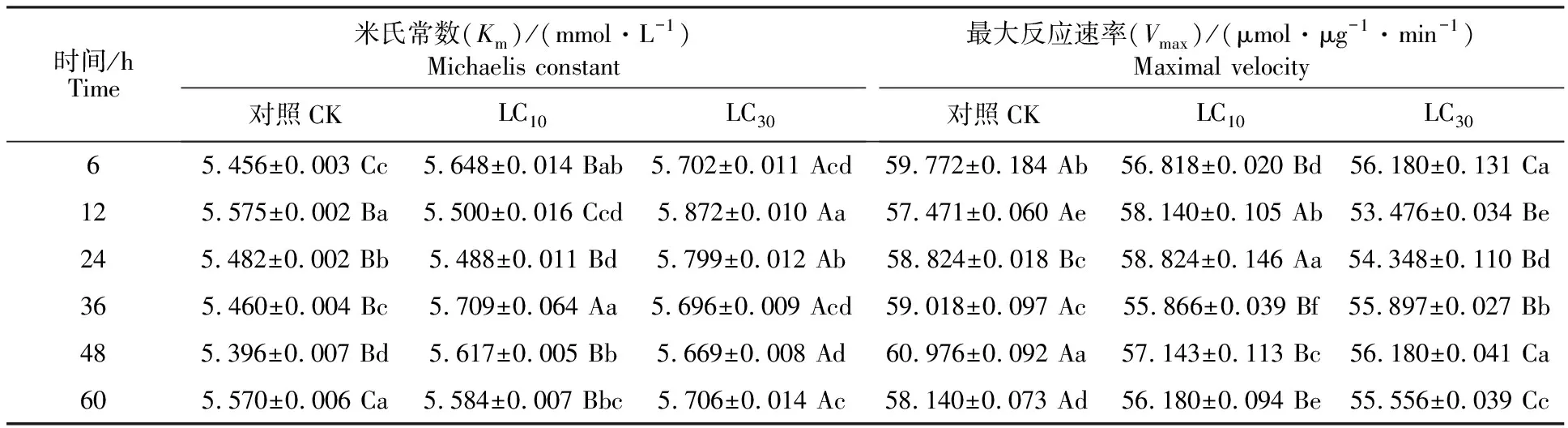
表1 乙唑螨腈亚致死剂量对二斑叶螨GST的动力学常数
2.3.2 羧酸酯酶(CarE)动力学常数 二斑叶螨雌成螨经乙唑螨腈亚致死剂量处理后,体内CarE的Km和Vmax的变化如表2所示。LC10、LC30两个处理的Km都显著低于对照(P<0.05),另外,LC30除6、48和60 h与LC10无显著差异外,其余时间点都显著低于LC10;LC10处理的Vmax于6、36和60 h时显著高于对照(P<0.05),其他时间点与对照无显著差异。LC30处理的Vmax在各个时间点都显著高于对照(P<0.05),且除6 h外的时间点都显著高于LC10(P<0.05)。
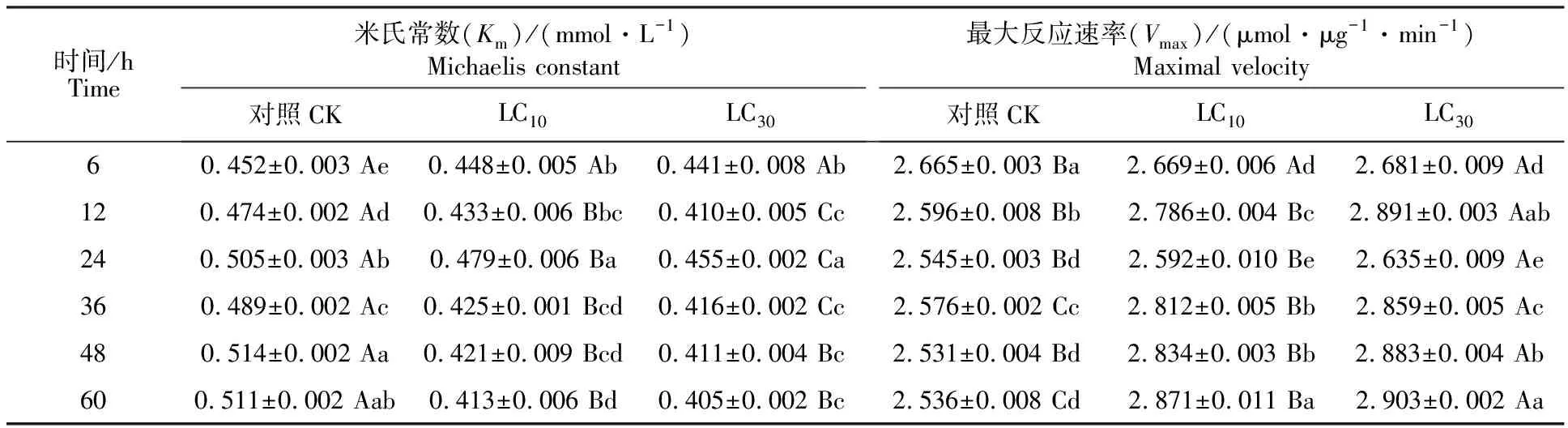
表2 乙唑螨腈亚致死剂量对二斑叶螨CarE的动力学常数
2.3.3 多功能氧化酶(MFO)动力学常数 二斑叶螨雌成螨经乙唑螨腈亚致死剂量处理后,体内MFO的Km和Vmax的变化如表3所示。LC10处理的Km在24、36和48 h时显著高于对照(P<0.05),其他时间点与对照无显著差异。LC30处理的Km在各个时间点都显著高于对照(P< 0.05),且除24 h与36 h外,显著高于LC10(P<0.05);LC10与LC30处理的Vmax在各个时间点都显著低于对照(P<0.05),且LC10在6、12和 48 h时显著高于LC30(P<0.05),其他时间点二者无明显差异。
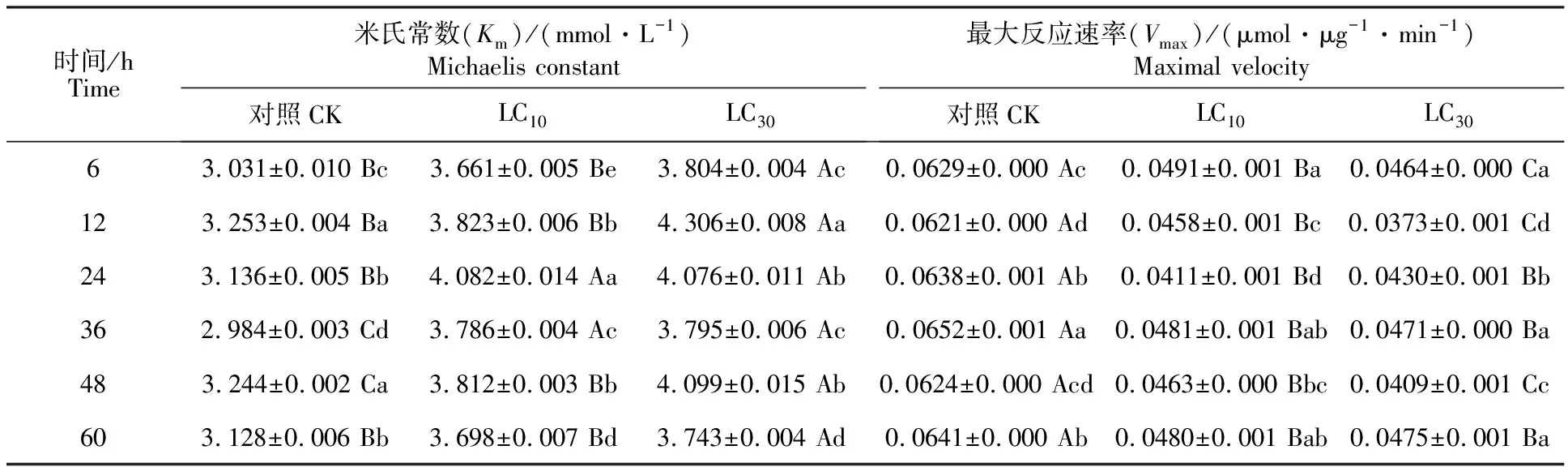
表3 乙唑螨腈亚致死剂量对二斑叶螨MFO的动力学常数
3 结论与讨论
羧酸酯酶(CarE)、谷胱甘肽-S-转移酶(GSTs)和多功能氧化酶(MFO)是害螨对杀螨剂产生代谢抗性的重要酶系[23]。本研究中乙唑螨腈亚致死剂量对二斑叶螨雌成螨体内解毒酶有诱导作用,且具有时间效应和剂量效应,说明二斑叶螨会对进入其体内的乙唑螨腈产生一定程度的应激反应,具体表现为通过提高解毒酶活力,加强对乙唑螨腈的降解和排出,从而提高二斑叶螨对乙唑螨腈的抗性。动力学研究中发现CarE在二斑叶螨代谢乙唑螨腈时起主导作用。
乙唑螨腈亚致死剂量处理二斑叶螨后,其体内解毒酶比活力呈上升趋势,这与金晶等[24]及Khan等[25]报道一致,即化学药剂亚致死剂量会使害螨体内的解毒酶活性提高,进一步导致害螨对化学药剂产生抗药性。也有研究发现杀螨剂亚致死剂量对害螨体内解毒酶有抑制作用,如谷清义[26]报道3种药剂的亚致死浓度LC10与LC20会抑制土耳其斯坦叶螨(TetranychusturkestaniUgarov et Nikolski)CarE的活性;胡琴[27]发现,阿维菌素亚致死剂量会抑制巴氏新小绥螨体内GSTs的活性,造成此差异的原因可能是杀螨剂的作用机理与方式的不同,另外同类或同一杀螨剂在个体摄入量、个体抗性强弱以及接触药剂时间长短的影响下,对解毒酶活性的影响亦会存在差异。
乙唑螨腈LC10和LC30处理二斑叶螨后,其体内解毒酶比活力受到的诱导程度随着处理时间的延长存在差异,说明乙唑螨腈亚致死剂量对二斑叶螨体内的解毒酶比活力的诱导存在时间效应,这与汝阳等[28]及尚素琴等[9]报道一致。本试验在个别时间点,出现对照组的比活力显著高于LC10或者LC10显著高于LC30的情况,可能是乙唑螨腈亚致死剂量对二斑叶螨某些生理活动,如取食、睡眠和排泄等造成影响,进而影响到解毒酶活性,至于二斑叶螨生理活动对其体内解毒酶活性的影响有待进一步考究。
处理时间一致时,乙唑螨腈亚致死剂量LC10与LC30对解毒酶比活力的诱导程度显著高于对照,且LC30显著高于LC10,即存在剂量效应,这与汝阳等[28]发现阿维菌素和哒螨灵高浓度的亚致死剂量对巴氏新小绥满GSTs的诱导作用显著高于对照和低浓度处理组的结果一致;与胡琴[27]报道阿维菌素亚致死剂量对巴氏新小绥螨不同温度品系的MFO与CarE活性的影响存在剂量效应的结果一致;剂量效应可能是二斑叶螨对不同药剂浓度采取的一种生存对策[29]。
酶动力学常数Km、Vmax的值分别表示解毒酶和底物亲和力的强弱与反应速度的快慢,常用来衡量解毒酶在昆虫抗药性中的量变与质变。二斑叶螨雌成螨经乙唑螨腈亚致死剂量LC10、LC30处理后,CarE的Km值与对照组相比皆减小,Vmax值皆增大,而GSTs和MFOs的Km值均增大,Vmax均减小,其中Km值与酶和底物的亲和力成反比,Vmax值与反应速率成正比。结果表明CarE与底物的亲和力与反应速率要大于GSTs和MFO,可推测出二斑叶螨在代谢乙唑螨腈时CarE起主导作用,这与常芸等[30]的研究结论一致。也有部分研究报道起主导作用的解毒酶并非CarE[31],这是因为不同害虫或害螨对不同药剂的代谢机制不完全相同,具体的代谢机制可能与虫体本身的生理状态、药剂类型以及药剂作用时间有关。
实际生产中,将乙唑螨腈与阿维菌素、哒螨灵和螺螨酯等[26]抑制羧酸酯酶活性的药剂混合使用,即可提高乙唑螨腈对二斑叶螨防治效果。但本研究仅探讨乙唑螨腈亚致死剂量对二斑叶螨体内解毒酶活性即酶动力学常数的影响,至于抗性种群以及二斑叶螨对乙唑螨腈的分子抗性机制有待进一步探究。
