花色苷对糖尿病视网膜病变模型大鼠视网膜氧化应激损伤拮抗作用研究
2023-07-19钟绍金韩珊颖黄裕昌
钟绍金,韩珊颖,黄裕昌
(1.上海市第六人民医院-海口市骨科与糖尿病医院 药学部,海南 海口 570300;2.中南大学湘雅医学院附属海口医院 药学部,海南 海口 570208;3.海南省药物研究所,海南 海口 570311)
糖尿病视网膜病变(DR)是发生于眼部的糖尿病最常见的并发症,其致盲具有不可逆性,是导致工作年龄人群视力损害的重要原因之一[1]。多项流行病学证据表明,DR 增加了糖尿病死亡率的风险[2-3]。糖尿病各种异常代谢产物积聚所生成的活性氮(RNS)和活性氧(ROS)诱导所致氧化应激,是导致DR 的关键因素已被广泛接受,氧化应激通过直接或间接方式潜在攻击视网膜神经元,导致细胞损伤和死亡,最终影响组织及器官正常功能[4-5]。因此,了解视神经的变性机制有助于DR 的有效防治。花青素是一类天然色素,广泛分布于植物界,花色苷是水果和蔬菜中最常见的花青素,由于其多种生物学益处,如神经保护、抗炎、抗氧化、抗肿瘤、糖尿病预防等,对健康具有积极影响[6]。多项临床研究发现,花色苷可改善多种眼部疾病,证实其具有视网膜保护作用,然而,目前尚无其在DR 方面的应用及机制相关研究[7]。本研究选取植物界花色苷含量较高的蓝莓进行花色苷提取,评估花色苷对DR 大鼠的干预效果,探讨花色苷对DR 的影响作用及机制。
1 材料
1.1 实验动物
SPF 级健康SD 大鼠40 只,雄性,8 周龄,体质量为(193.36±8.11)g,由湖南斯莱克景达实验动物有限公司提供,实验动物许可证号:SCXK(湘)2016-0005。大鼠饲养在温度为20 ~ 26℃,相对湿度为(55±15) %的安静环境下,避免强光照射,按需饮水、摄食。实验前均经1 周基础饲料适应性喂养。
1.2 药物与试剂
蓝莓(购于本地水果市场);链脲佐菌素(STZ,批号:S0185,美国Sigma 公司);中性树胶、HE 染色试剂盒、TUNEL 细胞凋亡检测试剂盒(武汉赛培生物科技有限公司);小鼠抗β-actin(美国Sigma 公司);一抗:兔Anti-SREBP1 抗体、兔Anti-SREBP2(美国abcam 公司);山羊抗兔IgG 抗体、山羊抗小鼠IgG 抗体(北京中杉金桥生物有限公司);BCA 蛋白测试试剂盒(上海碧云天公司);2,7-二氯二氢荧光素二乙酸酯(DCFH-DA,美国Sigma 公司)。
1.3 主要仪器
VFD-21S 型冷冻干燥仪(日本SHINKKU VD);SFE-650M 型超临界萃取仪[适安佳(北京)生物科技有限公司];11BS25 型食品粉碎机(德国IKA 公司);One Touch 型血糖仪(美国强生公司);DKB-8A 型电热恒温水槽(上海精宏实验设备有限公司);BYR320 型低速冷冻离心机(北京白洋医疗器械有限公司);Synergy2 型多功能酶标仪(美国BIOTEK 公司);BK400 型全自动生化分析仪(山东博科生物产业有限公司);7500 型实时荧光定量PCR 仪(美国应用生物系统公司);Invitrogen E-Gel Imager 型凝胶成像仪(美国Thermo Scientific);CytoFlex S 型流式细胞仪(美国Beckman 公司)。
2 方法
2.1 花色苷提取
采用CO2超临界萃取法。提取步骤:取冷冻干燥好的蓝莓适量,充分粉碎成浆,经冷冻干燥后,过5 号筛(80 目),即得蓝莓粉;称取蓝莓粉约5 g,置于萃取釜,加入7 倍量的80%乙醇密闭萃取60 min,萃取条件:温度为40 ℃,压力为28 MPa;萃取结束后,可得到花色苷;再经大孔树脂纯化后,即得纯度为78.6%的花色苷[8]。
2.2 分组、建模及给药
首先,将40 只大鼠依体质量进行随机分组,随机抽取8 只为健康组,维持基础饲料喂养;其余32只为模型复制组,以高糖高脂的饲料连续喂养4 周后,提前禁食12 h,空腹称重,于左腹下侧单次注射STZ(溶媒为0.1 mol/L 的柠檬酸-柠檬酸钠缓冲液),剂量为35 mg/kg,72 h 后经尾部取血检测空腹血糖(FPG),测得FPG 超过16.7 mmol/L 并持续至少10 d 则认为建模成功。最后,32 只大鼠全部造模成功。持续饲养两周后,通过荧光素眼底血管造影筛选出符合DR 诊断标准的大鼠27 只。随机抽取DR 大鼠24 只,分为模型组8 只、低剂量组8 只和高剂量组8 只。低剂量组和高剂量组分别给予花色苷250 mg/kg、500 mg/kg 连续灌胃治疗4 周,每日2 次。健康组、模型组以等剂量0.9%氯化钠溶液灌胃,1个月后进行各项指标检测。
2.3 一般状态观察及FPG 测定
观察并记录大鼠的精神状态、毛发光泽度、摄食、饮水及尿量的变化情况;在空腹条件下(禁食至少12 h,但不禁水),经尾静脉取血,采用血糖仪检测其FPG。
2.4 大鼠视网膜组织获取
以2%戊巴比妥钠溶液注射对大鼠进行腹腔麻醉后取眼球,解剖镜下除去角膜、玻璃体及晶状体,获取视网膜组织用于后续研究。
2.5 视网膜病理学检查
以0.9%氯化钠注射液漂洗视网膜组织,用滤纸吸干残液,置于4%多聚甲醛中固定48 h,然后进行脱水,常规进行石蜡包埋切片,切片厚度4 μm。将切片放入烘箱,65℃烘2 h,经二甲苯浸泡20 min 后,依次放入100%、95%、90%、85%、75%及50%乙醇各处理5 min。苏木精-伊红(HE)染色顺序:苏木精染液5 s,1%盐酸-乙醇30 s,纯水返蓝,伊红染液5 s,再经梯度脱水,以中性树胶封片,通过显微镜检查所有大鼠的视网膜病理情况。
2.6 大鼠视网膜活性氧簇(ROS)的检测
取大鼠视网膜组织,以PBS 清洗3 次后,在室温下用3%过氧化氢孵育处理10 min,再以10%山羊血清封闭处理60 min,滴加一抗,4℃存放过夜,第二天以PBS 清洗3 次,按(1 ∶200)滴加山羊抗兔并孵育60 min,再次用PBS 冲洗3 次后,加入DAPI 溶液孵育10 min,封片。置于荧光显微镜下,选择最佳视野,检测视网膜组织中ROS 表达水平。
2.7 视网膜氧化应激水平检测
2.7.1 样品制备 取视网膜组织,加入适量PBS,于冰上制成匀浆,以10 000 r/min 离心10 min,取上清液,存于-80 ℃冰箱中,待测[9]。
2.7.2 超氧化物歧化酶(SOD)活性检测 取上述样品20 μL,依次加入检测SOD 的缓冲液、WST-8及反应启动工作液,37 ℃条件下孵育30 min,设置检测波长为450 nm,测定其吸光度A,计算抑制率。以标准曲线法计算待检样品的SOD 酶活力。
2.7.3 丙二醛(MDA)检测 取上述样品100μL,依次加入蒸馏水、工作液适量,进行水浴处理60 min,设定温度为100 ℃,置于冰浴中冷却,常温下以10 000 r/min 离心10 min,留存上清液;吸取该上清液200 μL 加入玻璃比色皿中,所有样品分别在600、532 及450 nm 处测定A值,计算ΔA=A测定-A空白。MDA 含量= 5×[12.9× (ΔA532-ΔA600)- 2.58 ×ΔA450]。
2.8 大鼠视网膜组织Notch1、Hes-1 蛋白表达
采用蛋白印迹法检测。取大鼠视网膜组织,用眼科镊剪碎,加入裂解液进行组织蛋白提取,并用BCA 蛋白测定试剂盒检测总蛋白表达;加入loading buffer,混合均匀后放入沸水中处理5 min 致蛋白变性。取蛋白适量进行SDS-PAGE 电泳,先以80 V 电泳2 h,之后以60 V 转膜处理2 h,再以5%脱脂牛奶封闭2 h,随后将条带放入10 mL 稀释1 000 倍的Notch1、Hes-1、三磷酸甘油醛脱氢酶(GAPDH)兔源一抗溶液中,4 ℃孵育12 h 后,用TBST 缓冲液清洗10 min,重复3 次,然后加入稀释2 000 倍的羊抗兔二抗溶液中,以37 ℃孵育2 h,再次重复上述清洗步骤。最后,经ECL 化学发光试剂显色处理,进行蛋白电泳系统及凝胶成像。内参物为GAPDH,用Image J 软件分析各蛋白灰度值,蛋白相对表达量=待检物灰度值/内参物灰度值。
2.9 统计学方法
用SPSS 25.0 软件进行数据分析。计量资料用均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用方差分析。以P<0.05 为差异有统计学意义。
3 结果
3.1 各组大鼠一般状态及空腹血糖情况
给药结束后,各组大鼠一般状态出现明显差异,其中,状态最差为模型组。相较于模型组,花色苷低、高剂量组状态明显恢复,其FPG 均低于模型组(P<0.05),且高剂量组FPG 改善更加明显(P<0.05)。结果见表1。
表1 各组大鼠一般状态及空腹血糖情况(±s,n = 8)Tab.1 General status and fasting blood glucose of rats in each group(±s,n = 8)

表1 各组大鼠一般状态及空腹血糖情况(±s,n = 8)Tab.1 General status and fasting blood glucose of rats in each group(±s,n = 8)
注:与健康组相比,*P < 0.05;与模型组相比,#P < 0.05;与低剂量组相比,△ P <0.05。表2、3 同。
组别一般状态FPG/(mmol/L)健康组 行动敏捷,饮食及二便正常,皮毛顺滑有光泽。4.43±0.30模型组行动迟缓,精神萎靡,多饮、多食、多尿现象明显,皮毛枯黄无光泽,出现掉毛现象。24.49±1.97*花色苷低剂量组精神状态改善,行动较模型组敏捷,多饮、多食、多尿现象明显改善,皮毛略有光泽。16.83±1.78*#花色苷高剂量组精神状态较好,行动较低剂量组敏捷,多饮、多食、多尿现象明显改善,皮毛有光泽。13.53±1.01*#△F 270.824 P<0.001
3.2 大鼠视网膜病理学检查
HE 染色可知,健康组大鼠的视网膜具有规则的组织结构,层次明显;与健康组视网膜相比,模型组组织结构明显紊乱,界限不明,神经节细胞层可见明显空泡型变化;相较于模型组,尽管花色苷低、高剂量组大鼠视网膜的组织结构仍显疏松,但层次相对清晰,神经节细胞明显增加并基本规则排列,新生血管生成较少,见图1。
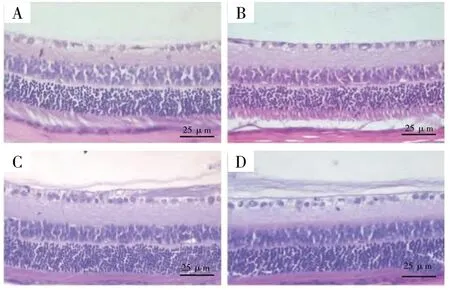
图1 大鼠视网膜病理学检查(HE×400)Fig.1 Pathological examination of rat retina(HE×400)
3.3 各组大鼠视网膜的ROS 水平
与健康组大鼠相比,模型组的荧光强度更高,ROS 水平明显升高(P<0.05);与模型组相比,花色苷低剂量组和高剂量组荧光强度明显更低,ROS水平明显降低(P<0.05),且高剂量组较低剂量组下降幅度更加明显(P<0.05),见图2、3。
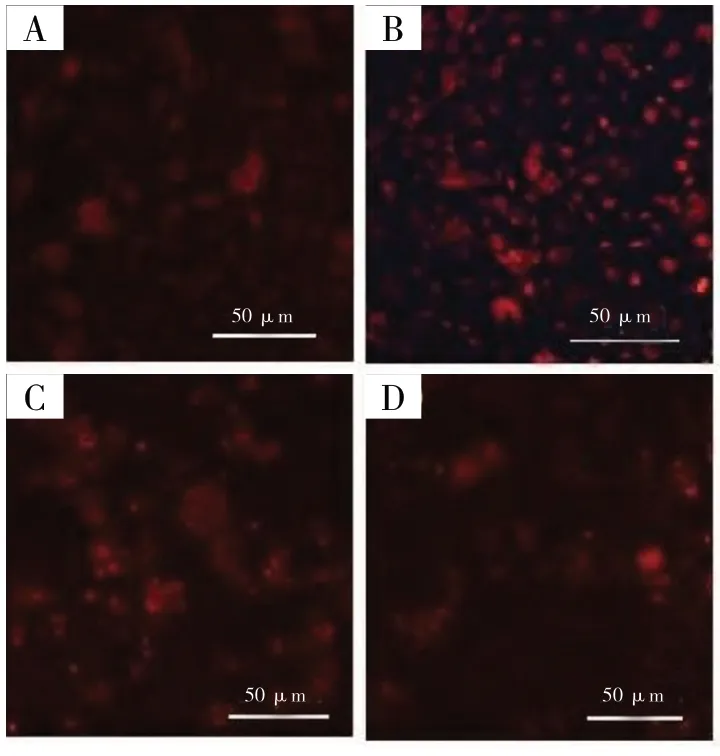
图2 各组大鼠视网膜的ROS 表达图(×200)Fig.2 ROS expression in retina of rats in each group(× 200)
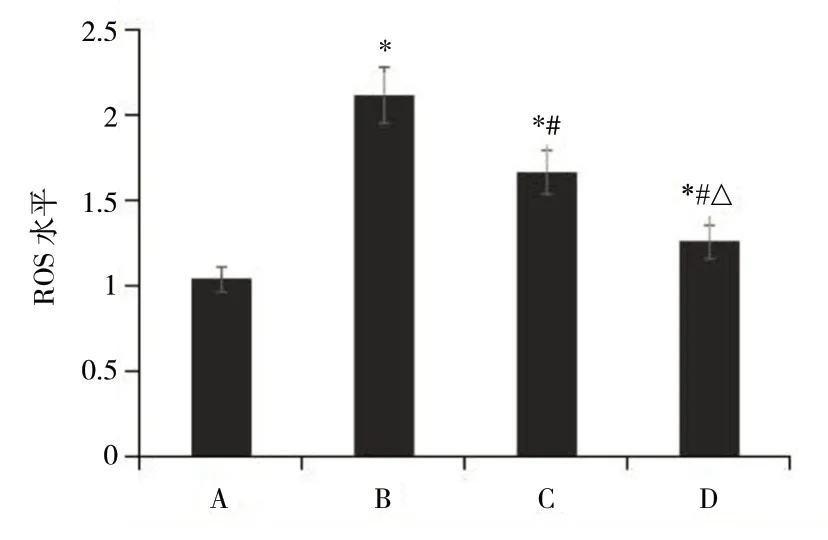
图3 各组大鼠视网膜的ROS 水平Fig.3 ROS level of rat retina in each group
3.4 各组大鼠视网膜组织的SOD 活性和MDA 水平
与健康组大鼠相比,模型组的视网膜SOD 活性更低,MDA 水平更高(P<0.05);与模型组相比,花色苷低、高剂量组大鼠视网膜SOD 活性更高,MDA 水平更低(P<0.05),且高剂量组较低剂量组差异幅度更加明显(P<0.05)。结果见表2。
表2 各组大鼠视网膜组织的SOD 活性和MDA 水平(±s,n = 8)Tab.2 SOD activity and MDA level of rat retina in each group(±s,n = 8)

表2 各组大鼠视网膜组织的SOD 活性和MDA 水平(±s,n = 8)Tab.2 SOD activity and MDA level of rat retina in each group(±s,n = 8)
组别SOD/(U/mg)MDA/(nmol/mg)健康组47.72±4.480.95±0.09模型组 19.67±2.01* 2.86±0.27*花色苷低剂量组 28.26±2.25*# 1.84±0.19*#花色苷高剂量组 36.25±2.48*#△ 1.46±0.09*#△F 129.061167.095 P<0.001<0.001
3.5 大鼠视网膜组织Notch1、Hes-1 蛋白表达
与健康组大鼠相比,模型组及观察组的视网膜Notch1、Hes-1 蛋白表达更低(P<0.05);相比于模型组大鼠,花色苷低、高剂量组的视网膜具有更高的Notch1、Hes-1 蛋白表达(P<0.05)。结果见表3、图4。
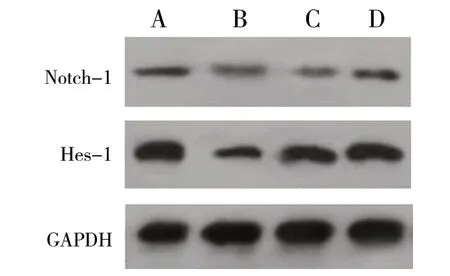
图4 各组大鼠视网膜组织Notch1、Hes-1 蛋白表达Fig.4 Expression of Notch1 and Hes-1 protein in retina of rats in eachgroup
表3 各组大鼠视网膜组织Notch1、Hes-1 蛋白表达(±s,n = 8)Tab.3 Expression of Notch1 and Hes-1 protein in retina of rats in each group(±s,n = 8)

表3 各组大鼠视网膜组织Notch1、Hes-1 蛋白表达(±s,n = 8)Tab.3 Expression of Notch1 and Hes-1 protein in retina of rats in each group(±s,n = 8)
组别Notch1Hes-1健康组1.06±0.111.13±0.15模型组 0.35±0.04* 0.28±0.03*花色苷低剂量组 0.57±0.05*# 0.55±0.05*#花色苷高剂量组 0.74±0.08*#△ 0.84±0.06*#△F 47.611 54.698 p<0.001<0.001
4 讨论
本研究建模采用了高脂高糖联合STZ 诱导法,该法应用广泛、易于成模、操作简单,可随糖尿病病程发展而变化,与临床DR 的相关病理改变十分相似,是DR 研究的理想动物模型[10]。模型组大鼠出现DR 典型症状,MDA 和ROS 水平明显增加,SOD 活性下降,提示造模成功,确保了后续研究的顺利进行。
糖尿病高血糖刺激下易导致视网膜组织产生过量的ROS,进而产生系列组织功能损伤[4,11]。人体中的SOD 具有阻断氧自由基细胞损害并保护受损细胞的作用,而MDA 通过脂质过氧化反应损害视网膜结构[5]。因此,当视网膜病变时,常表现为ROS、MDA 水平增加,SOD 活力降低。本研究中使用花色苷的大鼠的视网膜的损伤程度明显改善,其视网膜ROS、MDA 水平明显降低,SOD 活性明显增加,表明花色苷能改善DR 大鼠的氧化应激反应状态,且从各项指标可知,高剂量的花色苷具有更强活性。这可能缘于花色苷在眼组织中的大量分布(明显高于脑部和肝脏)[12]及其多途径的视网膜保护作用,如抑制A2E 光氧化和光裂解、降低脂质过氧化产物毒性、激活其他抗氧化通路、抑制炎症反应等[13]。
Notch 信号通路(如Notch1/Hes-1)主要参与机体的新陈代谢,激活后能够减少机体因氧化应激所致损伤,Hes-1 是该信号通路的关键靶基因[14-15],有研究证实该通路可调节新生血管的退化或重构,是DR 治疗的潜在靶点[16]。田勇等[9]发现,治疗恢复期的DR 大鼠的视网膜中存在Notch1 和Hes-1 蛋白高表达,而本研究中经花色苷治疗的DR 大鼠视网膜亦检测到Notch1、Hes-1 蛋白水平增高,提示花色苷可能通过激活Notch1/Hes-1 通路,发挥视网膜保护作用。其作用机制可能是:(1)高血糖状态下,Notch1和Hes-1 蛋白表达可能受到抑制[17],花色苷通过改善高糖状态而上调Notch1 和Hes-1 蛋白水平,改善机体新陈代谢,进而产生抑制细胞凋亡和氧化应激损伤的作用;(2)DR 状态下眼中易产生大量的ROS,引起细胞中的氧化应激[18-19],花色苷可能通过激活Notch1/Hes-1 通路,清除视网膜中的ROS,改善氧化应激状态,从而发挥视网膜保护作用;(3)可能与被激活的Notch1/Hes-1 通路强化视神经保护作用亦存在相关性,因为DR 早期就已出现神经变性[4]。
5 结论
花色苷可能通过激活DR 大鼠视网膜的Notch1/Hes-1 信号通路,保护其视神经并改善氧化应激。但影响DR 氧化应激的因素较多,目前相关研究较少,且研究未对花色苷进行更多剂量方面的考察,存在一定的局限,有待后续研究进行补充。
