利用离体小孢子培养技术培育叶用芥菜耐抽薹新品系研究
2023-07-18付文苑赵利芬王青青吴康云
唐 兵,付文苑,赵利芬,杨 巍,王青青,瞿 飞,吴康云,邓 英
(1.贵州省园艺研究所,贵州 贵阳 550006;2.贵州大学,贵州 贵阳 550025)
小孢子培养技术是单倍体育种重要手段之一,是将处于单核靠边期植物未成熟花粉通过一定外在条件诱导改变花粉发育途径,使其发育途径从配子体转向孢子体进而形成胚状体。在异花授粉作物中,通过常规育种连续自交的方法获得一个纯合的亲本,需要5~8 a。而利用小孢子培养技术可快速获得单倍体或纯合双单倍体(Double haploid,DH)材料,一般只需要1~2 a 就可纯化育种材料,大大缩短了育种年限。自GUHA 等[1]首次发现花粉粒可以在体外诱导由孢子途径发育产生再生植株后,小孢子培养进入了科学家热衷研究的领域,1982 年LICHTER[2]首次利用小孢子培养技术在甘蓝上获得再生植株;此后,小孢子培养技术逐渐应用到蔬菜领域,在大白菜、芥菜、甘蓝、菜心、芥兰等[3-11]多种芸薹属蔬菜中获得了再生植株。与白菜、菜心、甘蓝等其他芸薹属蔬菜相比,芥菜小孢子培养体系建立较困难,直到1995 年HIRAMATSU 等[12]才在叶用芥菜上建立了游离小孢子培养体系。此后几十年,对叶用芥菜小孢子培养技术体系方面的研究较少,仅在结球芥、金丝芥、独山大叶芥等[13-14]品种上有报道。近年来,顾祥昆等[15]在9 个叶用芥菜品种上成功诱导出胚,吴慧敏等[16]和邓英等[17]对叶用芥菜小孢子培养条件进行了研究,叶用芥菜小孢子培养技术已日渐成熟。
叶用芥菜(Brassica junceavar.foliosa)在西南地区俗称青菜,是当地主栽的芥菜类蔬菜之一,栽培历史悠久,保留了很多优良的地方品种资源。其营养含量丰富,宜加工和鲜食[18],是人们餐桌上的主要蔬菜种类之一。叶用芥菜喜冷凉湿润的环境,忌炎热干旱,不耐霜冻,特别适宜在高山地区栽培,生长过程中极易受低温影响而出现先期抽薹的现象,影响叶用芥菜的产量和品质。所以,耐抽薹是芥菜育种中的主要目标之一。由于西南地区各地气候差异较大,以前交通运输不发达,各地在叶用芥菜的长期种植过程中,通过自然和人工选择保留优良种质资源,如独山大叶青、黔东南鸡冠青菜、威宁青菜等地方品种。但是,叶用芥菜种质资源基本都是当地农民在无隔离的情况下自交留种保存下来,留种技术粗糙,不仅品种严重混杂,而且种性退化严重,严重影响品种产量和质量。特别是耐抽薹叶用芥菜地方品种,耐抽薹性不一,经常出现个别植株先期抽薹,导致大规模生产出现产品不一。近年来,在国家扶贫政策大力扶持下,西南地区的交通得到飞速发展,促使当地叶用芥菜逐渐走向国内外市场,市场需求量逐渐增大。由于品种不纯,面临不能大规模生产,同时还要面临外来品种对当地品种的冲击,所以对当地品种优良性状进行选择和纯化迫在眉睫。以西南地区2个优质的耐抽薹地方品种威宁青菜和修文青菜为供体材料,利用成熟的叶用芥菜小孢子培养技术对2个供体材料进行优良性状选择和提纯,以期获得其优良DH 系,培养耐抽薹叶用芥菜新品系。
1 材料和方法
1.1 材料
以威宁青菜和修文青菜2个地方耐抽薹叶用芥菜品种为供体材料。于2019 年9 月中旬播种,10 月中旬移栽,地膜覆盖栽培,按照生产水平进行肥水管理。2020 年3—5 月第10 朵花开以后,取主花序上的花蕾进行小孢子培养。
培养基:B5-13(蔗糖质量浓度为130 g/L)培养基、MS 固体培养基(含3.00%蔗糖,8.00%琼脂,添加0.2 mg/L 6-BA 和0.02 mg/L NAA),pH 值均调至5.9,在116 ℃下灭菌30 min;NLN-13(蔗糖质量浓度为130 g/L)培养基pH 值调至5.9,用0.22 μm 孔径微孔滤膜过滤灭菌。
1.2 方法
1.2.1 小孢子培养 小孢子培养参照邓英等[17]的方法进行微调。晴天9:30—10:00取植株主花序上的花蕾,冰箱4 ℃低温处理24 h。每次试验取花瓣长/花药长为3/4、花药为黄绿色的花蕾40 个,75%乙醇浸泡30~60 s,无菌水冲洗3 次,12.00%次氯酸钠消毒10 min。然后将花蕾置入15 mL试管中,加入B5-13 提取液5 mL,玻璃棒挤破花蕾散出小孢子,用孔径0.05 mm 过滤网过滤小孢子悬浮液,将滤液置于15 mL 离心管中,加入提取液至10 mL,1 000 r/min离心,去上清液,重复离心3 次。最后加入NLN-13培养基,按每皿10 个花蕾的密度分装到直径为60 mm的培养皿中,每皿6 mL的NLN-13培养基,用Parafilm 膜封口。33 ℃恒温热激2 d,转入25 ℃培养箱黑暗静置培养,直至长出胚状体,20 d 后统计胚的数量。
1.2.2 小孢子胚诱导形成再生植株 将获得的子叶形胚接种于MS 固体培养基上,置于25 ℃光照培养箱中培养,昼夜连续光照16 h循环(光强3 000 lx),经过1~3 代继代培养分化出丛生芽,将丛生芽切下后转入到装有生根培养基(MS+0.1 mg/L NAA+3%蔗糖+7%琼脂)的三角瓶中生根,培养10~15 d 长成幼苗。当植株长到3~6 cm 且长出的根系较多时,将其移植于含泥炭+蛭石(3∶1)混合基质的营养钵(直径10 cm)中,将营养钵放置专门用来保湿的塑料盒中保湿,在人工气候箱内(昼夜温度25 ℃/18 ℃、光照强度3 000 lx、光照12 h)驯化5~7 d,然后将保湿盒去除,继续在人工气候箱生长,10 d 后移栽至试验田。
1.2.3 倍性鉴定 利用流式细胞仪(FCM)检测再生植株倍性,将再生植株幼嫩叶片切1.0 cm×0.5 cm的小块,置于6 cm 干净的玻璃培养皿中,滴加0.3 mL 细胞核裂解液(Sysmex Cystain® UV precise P Nuclei Extraction Buffer)将其浸没;用双面刀片将叶片切成小块,速度要快,避免产生钝口,产生叶片组织杂质,影响检测效果;加入1.2 mL 染色液(Sysmex Cystain® UV precise P Staining Buffer)染色,再用30 μm 过滤器过滤,上机测定倍性(Partec CyFlow,荧 光 源500 nm UV-LED,Sysmex Partec GmbH),测定细胞数设置为10 000 个。用FCS Express 5(De Novo Software,Glendale,CA,美国)采集数据并进行分析。
1.2.4 结实性调查 选取具有代表性的单倍体、双单倍体、嵌合体和非正倍体再生植株进行挂牌标记,开花期选取较好的花序,摘除已开的花然后套袋,让其进行自交,2个月后调查套袋花序的结荚情况、种子籽粒大小和饱满程度。
1.2.5 单倍体加倍技术 经倍性鉴定后,从每个品种单倍体再生株系中随机选取60株组培苗(每20株一组,3 次重复),用0.1%的秋水仙素浸泡植株幼苗茎尖1 h,无菌水清洗3~5次,接种于MS培养基上培养,间隔15 d 取茎尖转接培养,重复转接3 次后,用流式细胞仪检测植株倍性。
1.2.6 双单倍体自交后代优良DH 系田间性状调查 2020 年10 月—2021 年5 月,将2 个材料获得的小孢子DH 系组培苗经过驯化后移栽至贵州省园艺所试验地,进行自交繁种,当年秋季种植在园艺所试验地,调查其性状特性,选取优良DH 系。2021—2022 年进行品比试验,以贵州省园艺研究所青菜课题组自育品种黔青2号为对照,比较选取的优良DH系抽薹性并观察品种田间表现。将2个材料获得的小孢子DH 系组培苗经过驯化后移栽至贵州省园艺所试验地,进行自交繁种,当年秋季种植在园艺所试验地,调查其特性,选取优良DH 系。以黔青2 号为对照比较优良DH 系耐抽薹性,并对2 个优良DH系新品系进行田间表现观察。
1.3 数据分析
用Olympus BX51 荧光显微镜观察小孢子胚发育过程及进行胚统计,用DPS 6.5 软件对数据进行方差分析,用Photoshop处理图片。
2 结果与分析
2.1 耐抽薹叶用芥菜离体小孢子胚状体发育过程
以威宁青菜和修文青菜为供体材料进行离体小孢子培养,2 个基因型均诱导出了胚(图1),通过显微镜跟踪观察到了小孢子胚发育过程中各个时期形态。单核靠边期小孢子经33 ℃热激2 d 后,细胞膨大,细胞壁开始破裂,细胞内骨架重组,分裂出2~8 个细胞原胚(图1A)。转入25 ℃继续培养,7 d后可观察到多细胞团(图1B),继续培养相继观察到球形胚(图1C)、心形胚(图1D)、鱼雷形胚(图1E),20 d后形成子叶形胚(图1F)。
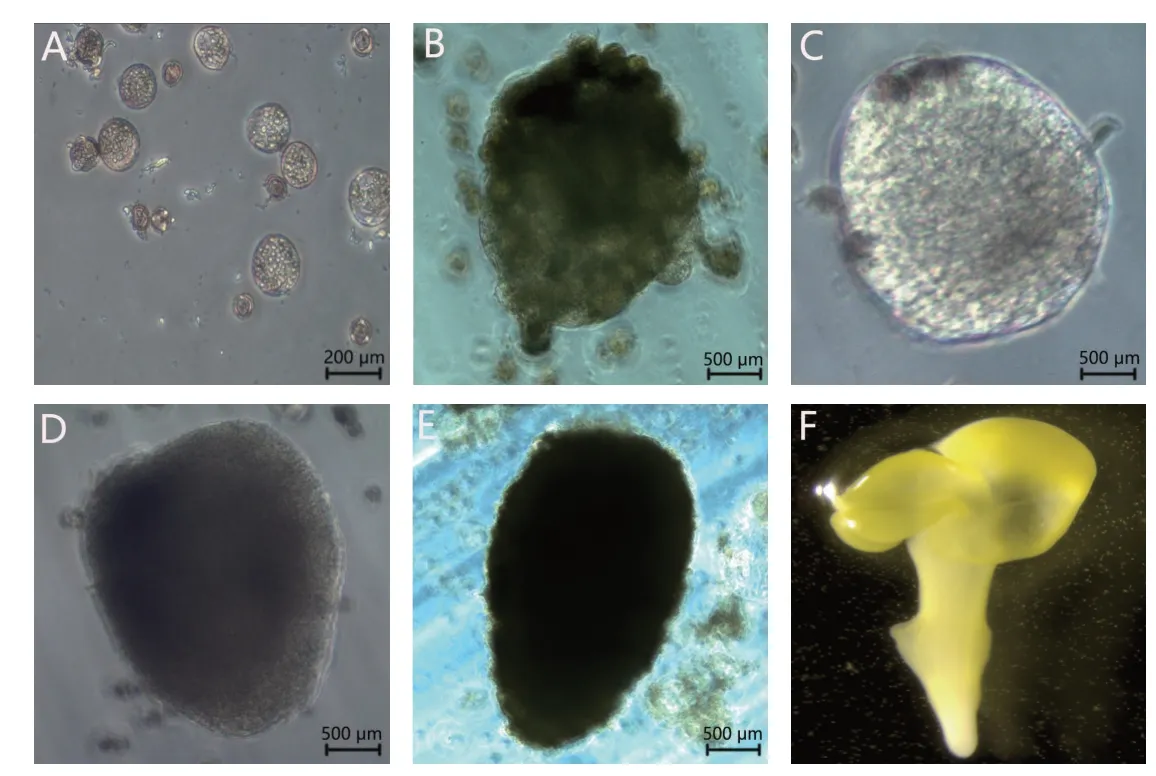
图1 耐抽薹叶用芥菜离体小孢子胚状体发育过程Fig.1 Development process of microspore embryoids in vitro of leaf mustard with tolerance to bolting
2.2 耐抽薹叶用芥菜不同基因型小孢子胚诱导
经过高温热激后,同一批小孢子胚发育启动时间不一,导致最后形成子叶形胚的时间不同。培养20 d 后统计子叶形胚的数量[16]。由表1 可知,威宁青菜和修文青菜胚产量分别为29.5、15.6 胚/蕾,威宁青菜胚产量显著高于修文青菜。表明叶用芥菜小孢子胚诱导产量跟基因型相关,不同基因型胚产量差异明显。
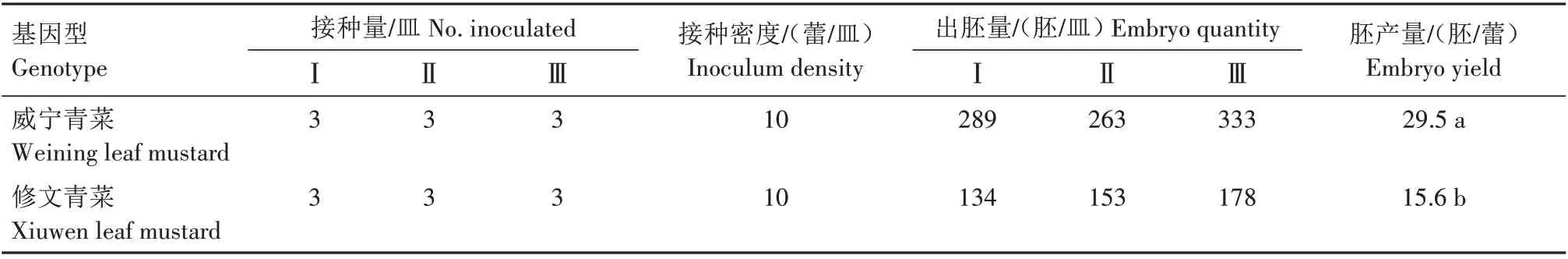
表1 不同基因型耐抽薹叶用芥菜小孢子胚诱导Tab.1 Induction of microspore embryos of leaf mustard with different genotypes for bolting tolerance
2.3 耐抽薹叶用芥菜小孢子植株再生
随机选取子叶形胚转接至MS 固体培养基上,2个基因型各150 个,共300 个子叶形胚,7 d 后子叶变绿(图2A),部分开始分化长出幼芽,其中约40.00%的子叶形胚在当代即可分化出幼芽,60.00%需要通过1~2 代继代才能分化成幼芽,幼芽一般1~8 个(图2B)。待幼芽长至茎长为2 cm 以上后,将其切下转至生根培养基上,诱导生根(图2C),7~14 d后可成苗移栽。2 个基因型共获得265 个生根株系,795 株,每个株系1~6 株,子叶形胚转接后成活率高达88.33%。生根组培苗经练苗,通过人工气候培养箱保温保湿驯化后,成活植株718株,移栽成活率90.31%(图2D)。本试验中共获得260 个再生株系,其中,威宁青菜135 个、修文青菜125 个,平均每个再生株系约3个植株。

图2 耐抽薹叶用芥菜小孢子植株再生Fig.2 Regeneration of leaf mustard microspore plants for bolting tolerance
2.4 耐抽薹叶用芥菜再生植株倍性鉴定结果
以正常的威宁青菜供体材料为对照组,从260个再生株系中随机各选取1 株,采用FCM 检测倍性。叶用芥菜为异源四倍体,将对照组DNA 在相对荧光强度调整在400 处出峰。根据测试结果,再生株系出现单倍体(图3a)、非整倍体(图3b)、双单倍体DH系(图3c)、单倍体和二倍体嵌合体(图3d)、二倍体和四倍体嵌合体(图3e)这5种倍性。
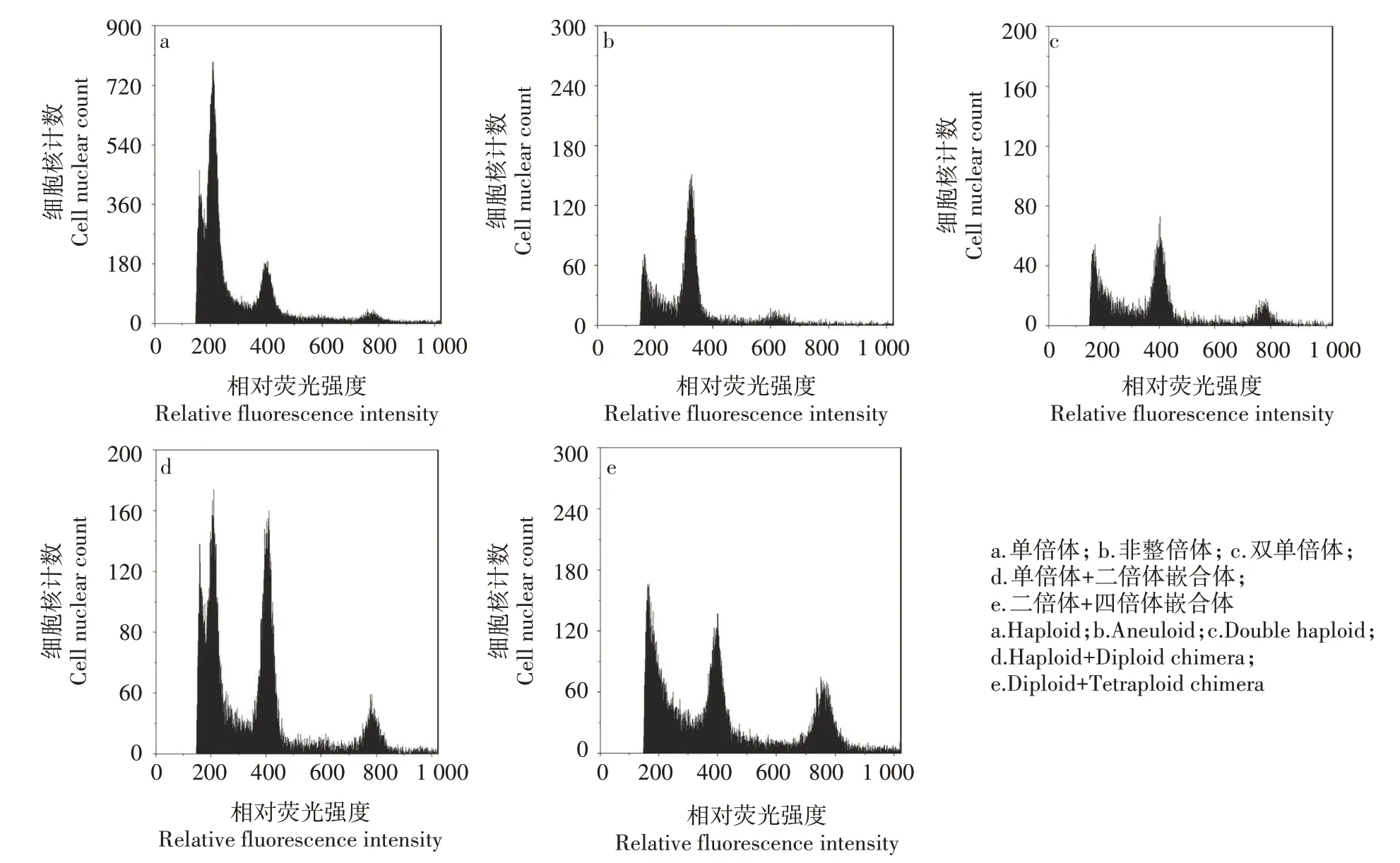
图3 耐抽薹叶用芥菜再生植株幼叶DNA的FCM 检测Fig.3 FCM detection of DNA in young leaves of regenerated plants of bolting tolerant leaf mustard
2.5 耐抽薹叶用芥菜单倍体加倍结果
由于耐抽薹叶用芥菜2种基因型小孢子培养自然加倍较低,获得单倍体较多,因此,为了获得较多基因型双单倍体,需要对单倍体进行加倍处理。利用不同质量浓度秋水仙素处理2种基因型小孢子单倍体,加倍结果如表2 所示,2 个基因型均在秋水仙素质量浓度为100.0 mg/L 时加倍效率最佳,分别为67.40%、52.00%,浓度过高、过低加倍效果均不佳。在相同秋水仙素浓度条件下2种基因型小孢子单倍体植株加倍效率差异明显,修文青菜加倍效率显著高于威宁青菜。表明叶用芥菜单倍体加倍效果不仅受诱导激素浓度影响,同时与基因型相关。
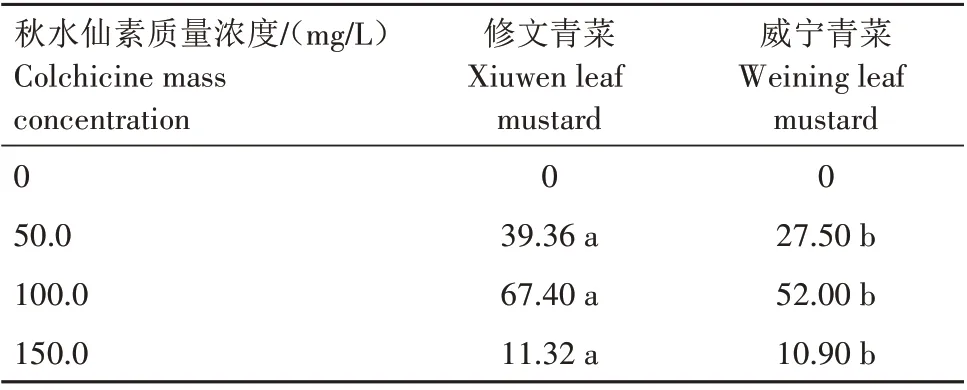
表2 不同质量浓度秋水仙素对耐抽薹叶用芥菜单倍体植株加倍效率的影响Tab.2 Effect of different mass concentrations of colchicine on the doubling efficiency of bolting resistant leaf mustard haploid plants %
2.6 耐抽薹叶用芥菜不同倍性材料性状表现
通过花期有无花粉,对植株倍性进一步判断可知,在132 株无花粉再生植株中DNA 只出现在200峰处,确定为单倍体;在28株有花粉的再生植株中,4 株表现为花序上有花粉和无花粉相间开放,DNA分别在200和400各有1个峰,为单倍体和二倍体的嵌合体;在24 株花序全部有花粉的再生植株中,21株DNA 出峰与对照一致,均在400 处,为双单倍体(DH),2株DNA在300处出峰,为非整倍体,另外1株DNA 在400 和800 处出峰,为二倍体和四倍体的嵌合体。从表3 可知,修文青菜的自然加倍率明显高于威宁青菜,分别为17.50%、8.75%。而威宁青菜产胚能力明显高于修文青菜(表1)。由此表明,小孢子产胚能力越强其自然加倍率越低。
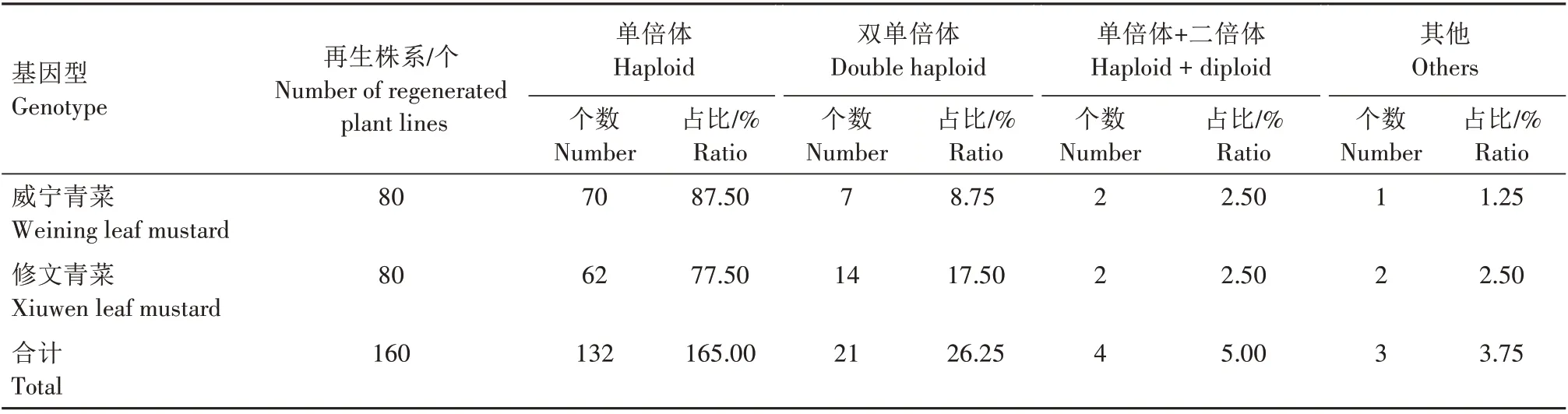
表3 不同基因型耐抽薹叶用芥菜小孢子再生株系的倍性Tab.3 Ploidy of different genotypes of microspore regeneration strains in leaf mustard with bolting tolerance
将倍性检测完的植株花期套袋,隔离自交授粉,后期观察结实性。结果发现,单倍体植株均不结实为空荚;单倍体和二倍体的嵌合植株有部分空荚、部分结实;非整倍体结实少;双单倍体(DH 系)和二倍体+四倍体嵌合体均结实,并且结荚量多。从外部形态看,单倍体植株长势较弱,植株矮小,花蕾小,无花粉;非整倍体虽有花粉,但是植株长势较弱,结荚小,种子较小、不饱满;其他几个倍性植株均长势较好,有花粉,并且种子很饱满,量多。
2.7 耐抽薹叶用芥菜DH系植株自交后代性状表现
挑选正常的二倍体植株进行移栽,花期套袋单株留种,获得自交一代种子。秋季对自交后代株系进行田间性状鉴定,与供体植株相比,DH 系出现了多种性状分离(表4、图4—5)。以威宁青菜为供体获得的DH 系有4 种不同的类型,以DH4 性状与供体最接近,并且分蘖性减弱、耐抽薹性增强;以修文青菜为供体的DH 系出现了5 种不同的类型,其中,以DH4 性状与供体差异最大,DH5 性状最接近,并且分蘖性减弱、抽薹性增强、叶面无刺毛,使品种的商品性得到了提高。DH 系自交后代性状调查结果表明,2 个地方品种DH 系后代出现多性状表现,可能是由于农民长期自留种,导致品种严重不纯。
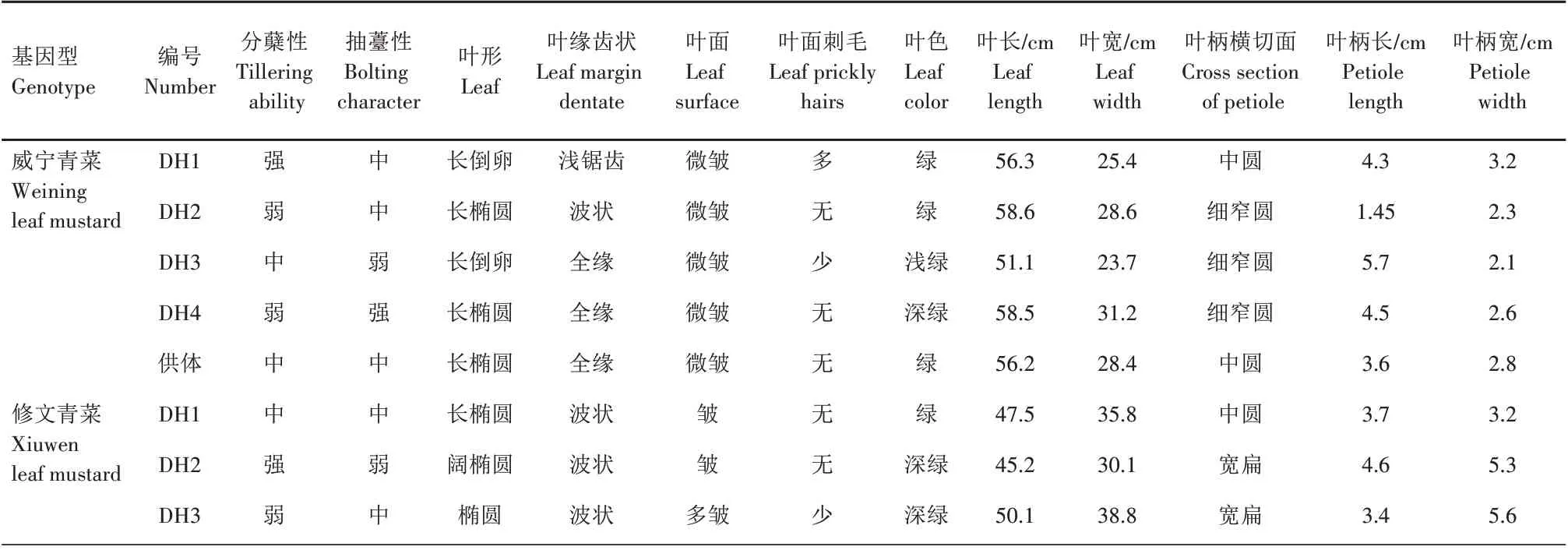
表4 耐抽薹叶用芥菜DH系田间鉴定结果Tab.4 Field identification results of DH lines of bolting resistant leaf mustard

图4 威宁青菜小孢子培养DH系自交后代Fig.4 Microspore cultured DH lines inbred progenies of Weining leaf mustard

图5 修文青菜小孢子培养DH系自交后代Fig.5 Microspore cultured DH lines inbred progenies of Xiuwen leaf mustard
2.8 耐抽薹叶用芥菜优良DH系田间表现
2.8.1 耐抽薹性鉴定 以黔青2号为对照组比较抽薹性,2个品种优良DH 系耐抽薹性均较明显(图6),修文青菜DH 系比对照组晚抽薹15 d,威宁青菜DH系比对照组晚抽薹10 d。结果表明,小孢子获得的优良DH系材料同样耐抽薹,并且耐抽薹性较强。2.8.2 田间表现鉴定 将获得的优良DH 系自交繁种,大面积种植在试验大棚中(图7),从田间表现可知,2 个品种的优良DH 系植株整齐度均非常高,没有出现杂株和不整齐的现象。表明利用离体小孢子培养技术可以获得纯度100.00%的耐抽薹叶用芥菜株系。

图6 耐抽薹叶用芥菜优良DH系耐抽薹性鉴定Fig.6 Identification of bolting resistance of superior DH lines of bolting resistant leaf mustard
3 结论与讨论
叶用芥菜是我国西南地区栽培最为普遍的芥菜类蔬菜,基本以地方常规品种为主,品种纯度一直是困扰育种的难题。本试验利用游离小孢子培养技术,获得了威宁青菜和修文青菜优良DH 系再生植株,其纯度100.00%,并与供体材料性状一致,耐抽薹性强,改良了供体分蘖性强的问题,提高了品种的商品性。在叶用芥菜育种中,关于利用小孢子培育新品种报道较少,本试验为小孢子培养在叶用芥菜育种中应用打下了基础。目前,利用小孢子培养技术进行品种选育在其他类芸薹十字花科作物中也有相关报道,如张丽等[19]利用小孢子培养纯化了心里美萝卜品种,耿建峰等[20]利用小孢子培养纯化亲本材料育成大白菜新品种豫新50,张晓伟等[21]利用小孢子培养育成甘蓝新品种豫生1号。
本试验以耐抽薹叶用芥菜地方品种修文青菜和威宁青菜为供体材料,并均诱导出了小孢子胚,威宁青菜为29.5 胚/蕾,修文青菜为15.6 胚/蕾,2 个基因型产胚量差异显著,表明叶用芥菜小孢子胚发生受基因型影响,这与吴康云等[4]、吴慧敏等[16]、邓英等[17]的研究结果一致。
本试验诱导出的耐抽薹叶用芥菜再生株系经FCM 倍性鉴定,有单倍体、双单倍体(DH 系)、单倍体+二倍体嵌合体、非整倍体、二倍体+四倍体嵌合体,并且威宁青菜双单倍体占比8.75%、修文青菜占比17.50%,表明耐抽薹叶用芥菜小孢子培养胚诱导过程中会自然加倍成二倍体、多倍体、嵌合体,这在其他植物小孢子培养中得到了证实。如韩阳等[22]、成妍等[23]在大白菜研究中发现自然加倍率最高达到90.00%,最低也达到了36.00%;庞强强等[24]在3种基因型菜心中研究发现,小孢子胚加倍率62.22%~71.11%;李智军等[25]报道,在150 株未经秋水仙素诱导的芥兰再生株系中鉴定出多倍体占比13.00%~71.00%。表明在不同的植物之间,小孢子胚诱导自然加倍率差异较大,同为十字花科作物,本研究的叶用芥菜小孢子胚自然加倍率明显比白菜低。同时在同一作物中不同基因型之间自然加倍率也不同,本试验中修文青菜明显高于威宁青菜,但是远低于邓英等[17]研究的3 个基因型叶用芥菜的自然加倍率(82.00%),可能与叶用芥菜耐抽薹性基因型相关。此外,通过对产胚量和加倍率比较发现,2个基因型之间产胚量越高其自然加倍率越低,呈负相关,这一结果在甘蓝、油菜、芥兰研究中也有类似报道[26-28]。
本试验在小孢子培养直接获得再生株系过程中,双单倍体DH 系占比较低,单倍体占70%左右,因此想要获得较多类型的DH 系,需要对单倍体进行加倍处理。经不同质量浓度秋水仙素处理,2 个基因型小孢子胚再生植株加倍率最高分别达67.40%、52.00%,浓度过高或过低对加倍率都有影响,这与高宁宁等[29]研究秋水仙素对甜瓜单倍体加倍影响的结果一致。本试验中获得再生株,通过隔离自交授粉,田间表现为单倍体无花粉,植株长势弱小;单倍体+二倍体嵌合体间隔花序才有花粉;双单倍体DH 系花粉量大,结实性好,植株长势较好;非整倍体及多倍体嵌合体虽有花粉,但是结荚较小,结实性差,植株长势也较弱。因此,可根据植株田间表现,初步判断植株倍性,然后再用FCM 进一步确认,大大减少了鉴定的工作量,同时可节约鉴定成本。
本试验对所获得双单倍体DH 系进行田间性状鉴定,威宁青菜有4 种表型,修文青菜有5 种表型,各种表型之间差别较大,每个基因型只有一种表型比较接近供体材料。再生株系DH 系出现和供体不一样的表型,一方面主要是供体材料基因型不纯,DH 系出现多种性状分离;另一方面是在小孢子胚诱导过程中发生了变异。
本试验2 个基因型小孢子均获得优良DH 系,其商品性都得到了提高。威宁青菜优良DH 系的分蘖性比供体材料减弱很多,基本无分蘖,植株叶片也比供体要大;修文青菜的分蘖性也减弱很多,基本无分蘖,同时植株上叶片刺毛消退。以贵州常栽品种黔青2 号为对照,进行抽薹性比较发现,2 个DH 系耐抽薹性均较强,自交后代大面积种植于试验田,植株整齐度高,未发现性状分离的植株和个别先期抽薹的现象,表明2 个耐抽薹品种均获得了100.00%纯系。
