酵母菌菌株4-41 的分类属性鉴定及其对灰霉菌的防病机制研究
2023-07-18朱露露刘金丽柴春月
朱露露,刘金丽,卢 丹,柴春月
(南阳师范学院 生命科学与农业工程学院,河南 南阳 473061)
拮抗酵母菌具有抗菌谱广、不产生对寄主和人有毒有害的毒素类物质、易在较干燥的果蔬表面生存、可以与物理方法或化学杀菌剂结合使用等优点,是一类较为理想的生防保鲜菌[1-3]。拮抗酵母菌通过营养竞争、诱导寄主产生抗性、产生抑菌物质等[4-5]等多重作用共同发挥其抑菌特性,而在这一过程中,往往涉及环境、寄主、病菌及其他微生物等多种因素,致使其抑菌机制复杂多变,严重限制其推广应用[6-7]。到目前为止,国内外研究者已经分离筛选出多种对果蔬采后病害有抑制作用的酵母菌,国际上已有拮抗酵母菌生防制剂,并开始了商品化应用[8]。我国也已分离得到多株拮抗酵母菌,对这些酵母菌的研究主要集中在柑橘、苹果、葡萄等大宗果蔬的生物保鲜方面,但目前尚处于实验室研究阶段[9],缺乏商品化的拮抗酵母菌菌株,因此,我国在生防酵母菌资源挖掘以及开发应用方面还有很大的空间和潜力。
果蔬在采后的贮藏运输过程中极易受到病原菌的侵染,从而引起果蔬腐烂,目前以化学防治为主,但使用化学农药极易引起农药残留,造成环境污染的同时还影响人体健康,因此,筛选并研究绿色、高效、广谱、安全的生防微生物,开展生物防治,成为果蔬采后病害防治的研究热点之一。鉴于此,以前期分离保存的一株酵母菌4-41为出发菌株,通过形态和26S rDNA序列分析确定其分类地位,通过抗菌谱试验以及在圣女果上的抑菌试验,检测其抑菌活性,进一步研究该菌株的抑菌机制,为拮抗酵母菌的应用提供科学依据。
1 材料和方法
1.1 材料
供试菌株:酵母菌4-41 和20 株植物病原菌均为南阳师范学院生命科学与农业工程学院微生物实验室前期分离保存的菌株。
1.2 培养基
马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖液体(PDB)培养基、酵母膏葡萄糖琼脂(YPD)培养基、玉米粉琼脂(YM)培养基均采用常规方法配制。
溶 磷 培 养 基:(NH4)2SO40.5 g/L、MgSO4·7H2O 0.1 g/L、FeSO4·7H2O 0.002 g/L、Ca3(PO4)25.0 g/L、NaCl 0.2 g/L、MnSO40.002 g/L、KCl 0.2 g/L、葡萄糖10.0 g/L、酵母粉0.5 g/L、琼脂粉15.0 g/L,pH值7。
溶锌培养基:ZnO 12.0 g/L、(NH4)2SO40.5 g/L、KCl 0.2 g/L、MgSO40.1 g/L、MnSO40.002 g/L、FeSO4·7H2O 0.002 g/L、葡萄糖10.0 g/L、酵母粉0.5 g/L、琼脂17 g/L。
产铁载体(CAS)培养基:CaCl3溶液1.0 mL/L、MgSO4·7H2O 溶液20.0 mL/L、10%酸水解酪素30.0 mL/L、20% 葡 萄 糖 溶 液10.0 mL/L、CAS 检 测 液100.0 mL/L、M9 盐 缓 冲 液100.0 mL/L、去 离 子 水750.0 mL/L、哌嗪-N,N′-二(2-乙磺酸)32.24 g/L,pH值6.8。
蛋白胨-水培养基:蛋白胨10 g、NaCl 5 g、蒸馏水1 L。
无氨基酵母氮源基础培养基(YNB 培养基)购于Biosharp公司。
1.3 方法
1.3.1 形态观察 将酵母菌4-41 接种在YM 培养基上,25 ℃培养,观察菌落形态。挑取单菌落,在光学显微镜下观察酵母细胞形态。在YM 培养基上接种酵母菌4-41,25 ℃培养15 d,光学显微镜下观察假菌丝。
1.3.2 系统发育分析 参考左瑞娟[10]的方法提取酵母菌4-41 基因组DNA,采用26S rDNA 通用引物NL1(5′-GCATATCGGTAAGCGGAGGAAAAG-3′ )和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)进 行PCR 扩增,扩增程序:94 ℃5 min;94 ℃30 s,55 ℃30 s,72 ℃1 min,循环30 次;72 ℃10 min。将PCR产物送上海生工生物工程公司测序,测序结果在NCBI在线数据库(http://www.ncbi.nlm.nih.gov/blast)中进行BLAST 比对,利用MEGA 7.0 软件[11]构建NJ系统发育树。
1.3.3 离体防病试验 平板对峙试验采用划线接种法,在PDA 培养基上距离平板边缘约15 mm 处,划线接种酵母菌4-41,25 ℃恒温培养24 h 后,在平板中央分别接种20株病原菌,同时以只接种病原菌的平板作为对照,25 ℃恒温共培养,分别在培养后不同时间测量并统计抑菌直径。根据初筛结果,采用十字交叉法进行复筛,在培养后不同时间观察抑菌效果,统计抑菌直径。参考陈超等[12]的方法并稍加修改,将酵母菌4-41 接种于PDB 培养基中,25 ℃、180 r/min 振 荡 培 养7 d,12 000 r/min 离 心10 min,取上清液,将上清液与PDA 培养基混匀倒入平板,在平板中央接种灰霉菌菌丝块,以加入无菌水的PDA培养基培养灰霉菌作为对照,25 ℃恒温培养4 d后观察记录灰霉菌菌落直径。
1.3.4 活体防病试验 参考巩文峰等[13]的方法,挑选新鲜成熟、大小均一、无病无腐的圣女果果实,在70%乙醇中浸泡1 min,无菌水冲洗3 次,0.5%次氯酸钠(NaClO)浸泡1 min,无菌水冲洗3次,进行果实表面消毒。在超净工作台中风干表面水分,用无菌针在每个果实表面制造一个2 mm×2 mm 的伤口,在伤口位置接种20 μL 酵母菌细胞悬液(108个/mL),接种后1 h,在接种点再接种20 μL 灰霉菌孢子悬液(105个/mL)。用同样的方法在果实上先后接种20 μL 无菌ddH2O 和灰霉菌孢子悬液(105个/mL),作为阴性对照。每个处理设置6个重复。将接种果实在相对湿度90%~95%、恒温25 ℃的人工气候箱中培养,每24 h 观察一次,记录果实发病情况和灰霉菌菌丝生长情况。
1.3.5 酵母菌生长动态测定 采用与1.3.4 中相同的果实造伤方法,在伤口处接种10 μL 酵母菌悬液(108个/mL),置超净工作台中风干,将果实放入无菌组培瓶中,置于恒温25 ℃、相对湿度90%~95%的人工气候箱中,参考耿鹏等[14]的方法,每24 h 切取10 mm×10 mm 的接种点果实组织,放入无菌研钵中,加入3 mL磷酸盐缓冲液(0.05 mol/L,pH值7.0),研磨匀浆,用无菌水稀释为10-1~10-6浓度梯度,最终取100 μL 10-6稀释液涂布在YPD培养基上,置25 ℃恒温培养48 h,菌落计数,以菌落数的lg 为参数,统计酵母菌细胞在果实伤口处的生长动态。每组试验重复3次。
1.3.6 酵母菌挥发性物质抑菌活性检测 采用双平板倒扣法[15],制备酵母菌悬液,涂布在YPD 培养基上,25 ℃恒温培养24 h,倒扣在相同直径并接种有灰霉菌菌苔的PDA 平板上,封口膜密封,25 ℃恒温培养,以单独培养的灰霉菌为对照,每天统计病原菌菌落直径。
1.3.7 产生氨气、铁载体以及溶磷、溶锌能力检测
参考NUTARATAT 等[16]的方法,对酵母菌产生氨气、溶磷、溶锌能力进行测定。产氨气能力检测:将100 μL 酵母菌悬液(108个/mL)接种于5 mL 蛋白胨水液体培养基中,25 ℃、180 r/min 培养5 d,加入1 mL Nessler’s reagent 溶液,观察培养基颜色变化,判断酵母菌是否产氨气,以未接种酵母菌的培养基为对照。溶磷、溶锌能力检测:分别将酵母菌悬液接种于溶磷、溶锌培养基中,25 ℃恒温培养5 d,观察其生长过程中是否产透明圈或显色圈,判断菌株是否具有溶磷、溶锌的能力,以未接种酵母菌的培养基为对照。
产铁载体检测:参考LOUDEN 等[17]的方法,在CAS 培养基上滴加酵母菌悬液,25 ℃培养12 d,观察酵母菌落周围是否产生透明圈,判断拮抗酵母菌能否产铁载体,以未接种酵母菌的CAS 培养基为对照。
1.3.8 生物膜形成观察及成膜能力动态测定 参考VANNGUYEN 等[18]的方法并稍作修改,将酵母菌接种在含有100 mmol/L 葡萄糖的YNB 培养基中,25 ℃、180 r/min 过夜振荡培养,收集酵母菌细胞悬液并分装于24 孔细胞培养板中,每孔2 mL。25 ℃静置培养3 d,弃培养液,用无菌水冲洗细胞板3次,观察是否有生物膜形成,以不接菌的空白培养基作为对照。
参考CHEN 等[19]的方法,取10 μL 酵母菌悬液,接种到添加100 mmol/L 葡萄糖的YNB 培养基中,25 ℃、180 r/min 过夜振荡培养,收集酵母菌细胞,用磷酸盐缓冲液(PBS,pH 值7.2)洗涤2 次,用相同的培养基重悬浮,制备成107个/mL 的菌悬液,分装于96 孔聚苯乙烯板中,每孔100 μL,在25 ℃、75 r/min的摇床中振荡培养,分别在培养后3、24、48、72 h 取样,PBS 冲洗2 次,加入100 μL 0.4%结晶紫水溶液染色45 min。无菌水冲洗4 次,再加入200 μL 95%乙醇脱色45 min,直接测定脱色液在波长为590 nm处的吸光值,以OD 值为纵坐标,培养时间为横坐标,制作生物膜形成能力曲线。
1.3.9 诱导植物抗病性相关酶活性测定 为检测拮抗酵母菌4-41是否诱导植物产生抗性,选用圣女果与灰霉菌互作体系,采用异伤接种的方法,在圣女果果实上同时造2 个伤口,果实造伤处理方法同1.3.4,在2个伤口处分别接种酵母菌悬液(108个/mL)和灰霉菌孢子悬液(105个/mL),以无菌水代替酵母菌4-41为对照,每天观察记录果实的发病情况。同时取1 g病健交接处果实组织,参考刘树英等[20]的方法检测果实中过氧化物酶(POD)活性;参考HASSAN 等[21]的方法检测果实中多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)的活性;参考DE MELO PEREIRA 等[22]的方法检测几丁质酶(CHI)、β-1,3-葡聚糖酶(GLU)的活性。
2 结果与分析
2.1 酵母菌4-41的形态特征及分类地位
酵母菌4-41 在YM 培养基上培养3 d,形成白色菌落,边缘整齐,中部突起(图1A)。酵母菌细胞呈卵圆形,能出芽生殖(图1B),培养至4 d,能观察到酵母菌产子囊孢子,每个子囊有2~4个子囊孢子,子囊孢子呈圆形(图1C)。酵母菌4-41 在YM 培养基上培养15 d后,可观察到假菌丝的形成(图1D)。
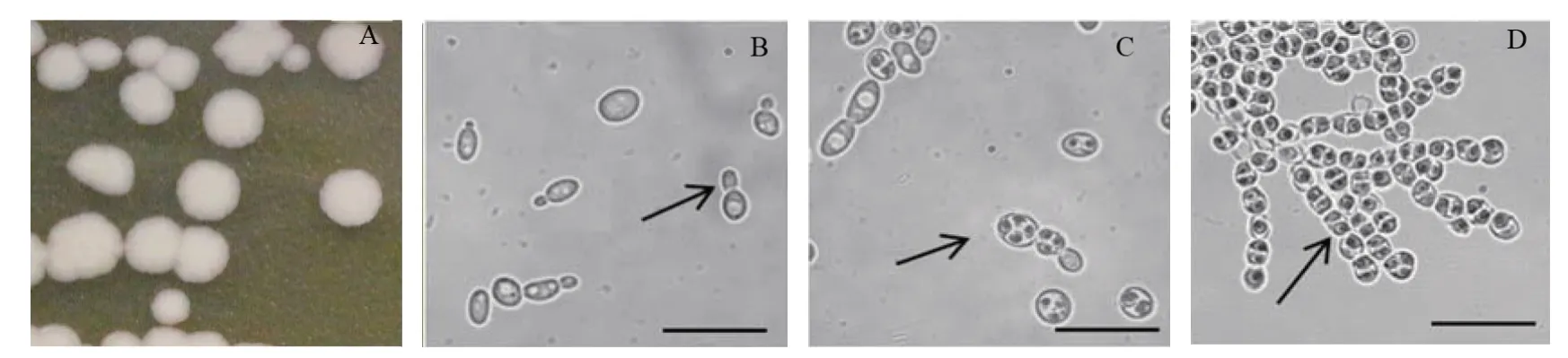
图1 酵母菌4-41的形态特征Fig.1 Morphological characteristics of the yeast strain 4-41
以NL1/NL4 为引物,PCR 扩增酵母菌4-41 的26S rDNA 序列,获得470 bp 扩增产物,将序列上传NCBI(GenBank Acc.No.ON514189),经BLAST 比对分析,发现该序列与Cyberlindnera saturnus(GenBank Acc.No.MH 595068)菌株的相似性为100%。根据比对结果,选择同源性较高的相关菌株,构建NJ 系统进化树(图2),Pichia mississippiensisCECT 11463 为外群,拮抗酵母菌4-41 与Cyberlindnera saturnus在同一分支。依据形态和分子鉴定结果,将4-41 菌株鉴定为Cyberlindnera saturnus。
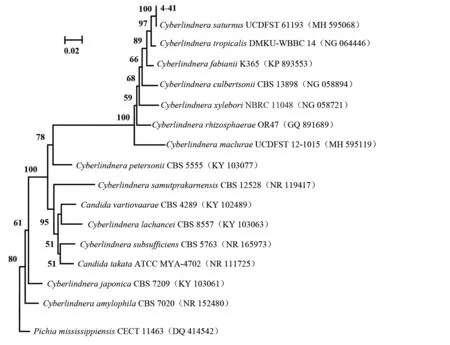
图2 酵母菌4-41的系统发育树Fig.2 Phylogenetic tree of the yeast strain 4-41 and related species
2.2 酵母菌4-41的拮抗活性
以实验室保存的20 种常见植物病原菌为靶标菌,采用平板对峙法,检测酵母菌4-41的抗菌谱,结果显示,酵母菌4-41 对灰霉菌(Botrytis cinerea)、石榴 垫 壳 孢 菌(Coniella granati)、白 地 霉(Galactomyces genomic)、尖 孢 镰 刀 菌(Fusarium oxysporum)、变红镰刀菌(Fusarium incarnatum)和隐地腐霉(Phytophthora cryptogea)6 种植物病原菌(抑菌直径分别为0.5、0.4、0.3、0.2、0.1 cm 和0.1 cm)表现出较强的抑菌活性(图3),其中对灰霉菌的抑菌效果最强。进一步检测酵母菌4-41 发酵上清液对灰霉菌的抑菌效果,结果显示,在含有上清液的平板上培养4 d 后,灰霉菌菌落直径为5.7 cm,在不含上清液的平板中培养的灰霉菌菌落直径为6.0 cm(图4),说明酵母菌4-41 的发酵液中可能含有非挥发性抑菌物质,能抑制灰霉菌菌丝的生长。
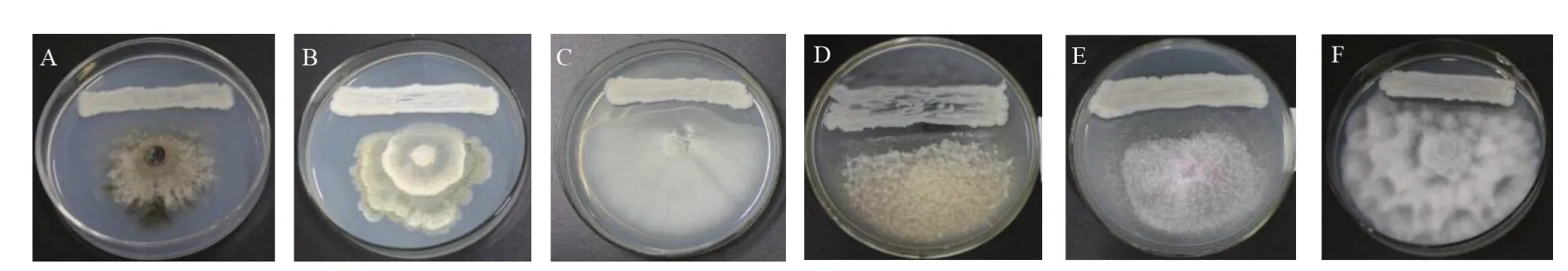
图3 酵母菌4-41与6种病原菌的平板对峙结果Fig.3 Dual cultures showing antagonism of the yeast strain 4-41 against six pathogens
图4 酵母菌4-41发酵上清液对灰霉菌的抑制效果Fig.4 Inhibition of mycelial growth of B.cinerea by the cultural supernatant of yeast strain 4-41
2.3 酵母菌4-41的防病效果
为了检测酵母菌4-41在果实上的抑菌效果,采用造伤接种的方法,在圣女果果实上接种灰霉菌作为对照组,同时以接种灰霉菌和酵母菌作为试验组,观察由灰霉菌侵染引起的果实腐烂情况和灰霉菌菌丝生长情况。结果显示,在接种后48 h,可明显观察到对照组圣女果果实全部发病,试验组的果实仅有少数出现发病症状。在接种后72~120 h,观察到对照组果实发病程度逐渐加重,灰霉菌菌丝围绕接种点附近快速生长和扩展,而接种有酵母菌的果实发病程度始终轻于对照组,且菌丝的生长和扩展也明显比对照组慢(图5)。可见,酵母菌4-41 能有效抑制灰霉菌对圣女果果实的侵染和灰霉菌菌丝的生长及扩展。

图5 酵母菌4-41在圣女果果实上的防病效果Fig.5 Efficacy of the yeast strain 4-41 against B.cinerea on cherry tomato fruit
2.4 酵母菌4-41在果实伤口处的定殖动态
为检测拮抗酵母菌4-41在植物上的定殖情况,采用造伤接种的方法,将拮抗酵母菌4-41接种在圣女果果实伤口处,每24 h 取样一次,统计酵母菌4-41 的细胞数量。结果(图6)表明,酵母菌4-41 在接种后48 h 内迅速生长,细胞数量快速增加,在72 h时细胞数量达到最大值,随后细胞数量基本维持在稳定的状态,但始终高于接种后1 h 的细胞数量。说明拮抗酵母菌4-41 能在圣女果果实上定殖并快速生长。

图6 酵母菌4-41在圣女果果实上的生长动态Fig.6 Growth dynamics of the antagonistic yeast 4-41 in cherry tomato fruit wounds
2.5 酵母菌4-41产生挥发性物质的抑菌活性
采用双平板倒扣法(图7),观察酵母菌是否产挥发性抑菌物质,将酵母菌4-41 与灰霉菌共培养24 h 后,观察到灰霉菌菌丝几乎没有明显生长和扩展,而单独培养的灰霉菌菌丝已经形成明显的菌落,共培养48 h 后,观察到灰霉菌菌丝有少量生长,形成较小的菌落,远远小于单独培养的灰霉菌菌落直径。在共培养72~96 h,单独培养的灰霉菌菌落已经逐渐布满平板,菌落直径达7.5~8.7 cm,而共培养的灰霉菌菌落直径仅为4.6~6.0 cm。结果表明,拮抗酵母菌4-41能产生挥发性抑菌物质,抑制灰霉菌菌丝的生长和扩展。
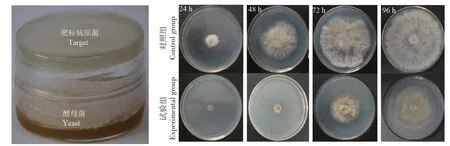
图7 酵母菌4-41产挥发性抑菌物质的检测Fig.7 Detection of volatile antifungal substances produced by the yeast strain 4-41
2.6 酵母菌4-41产生氨气和铁载体以及溶磷、溶锌的能力
将酵母菌4-41 悬液接种在产氨气发酵培养基中,振荡培养5 d 后,与不接种酵母菌的培养基相比,可明显观察到培养基黄色加深(图8A),说明该菌株具有产氨气的能力。将酵母菌4-41 分别接种在产铁载体(图8B)、溶锌(图8C)和溶磷(图8D)的鉴定培养基上,分别在培养后5 d 或12 d,在对应培养基上分别观察到了透明圈。以上试验表明,酵母菌4-41 能够产生氨气,具有溶磷和溶锌的能力,同时能产生铁载体。

图8 酵母菌4-41产代谢物质的测定Fig.8 Determination of metabolites produced by the yeast strain 4-41
2.7 酵母菌4-41的生物膜形成能力
拮抗酵母菌在果实伤口处形成生物膜能更好地阻止病原菌的入侵。本试验首先将酵母菌细胞悬液在24 孔细胞培养板中培养3 d,可明显观察到黏附在细胞板底部连接成膜状的酵母细胞(图9A),说明酵母菌4-41 能够形成生物膜。为进一步检测4-41 生物膜的形成能力,将酵母菌在YNB 培养基(含100 mmol/L葡萄糖)中振荡培养3 h,用PBS和无菌水反复冲洗酵母菌细胞,检测脱色液的OD590值为1.067,在培养24~72 h 时,OD 值无明显减小(图9B),说明该酵母菌细胞能稳定地依附在96 孔聚苯乙烯板内,具有较强的生物膜形成能力。

图9 酵母菌4-41生物膜形成的检测Fig.9 Detection of biofilms by the yeast strain 4-41
2.8 酵母菌4-41诱导的防卫反应
采用异伤接种法(图10A)检测拮抗酵母4-41是否能诱导植物产生抗性。结果表明,在接种后24 h,观察到灰霉菌与无菌水异伤接种的果实组织开始腐烂,并有少量菌丝生长,灰霉菌与酵母菌异伤接种的果实没有明显的腐烂症状;分别在接种后48、72、96 h 和120 h 连续观察,发现灰霉菌与无菌水异伤接种的果实组织腐烂逐渐加重,且灰霉菌菌丝快速生长、伸长,而接种有酵母菌和灰霉菌的果实上灰霉菌菌丝的生长速度减慢,菌丝积累量明显小于对照组,由灰霉菌侵染引起的果实腐烂症状较轻(图10B)。由此说明,酵母4-41 能够降低灰霉菌对圣女果果实的侵染程度,明显减轻由灰霉菌侵染造成的果实腐烂症状和灰霉菌菌丝的生长速度。
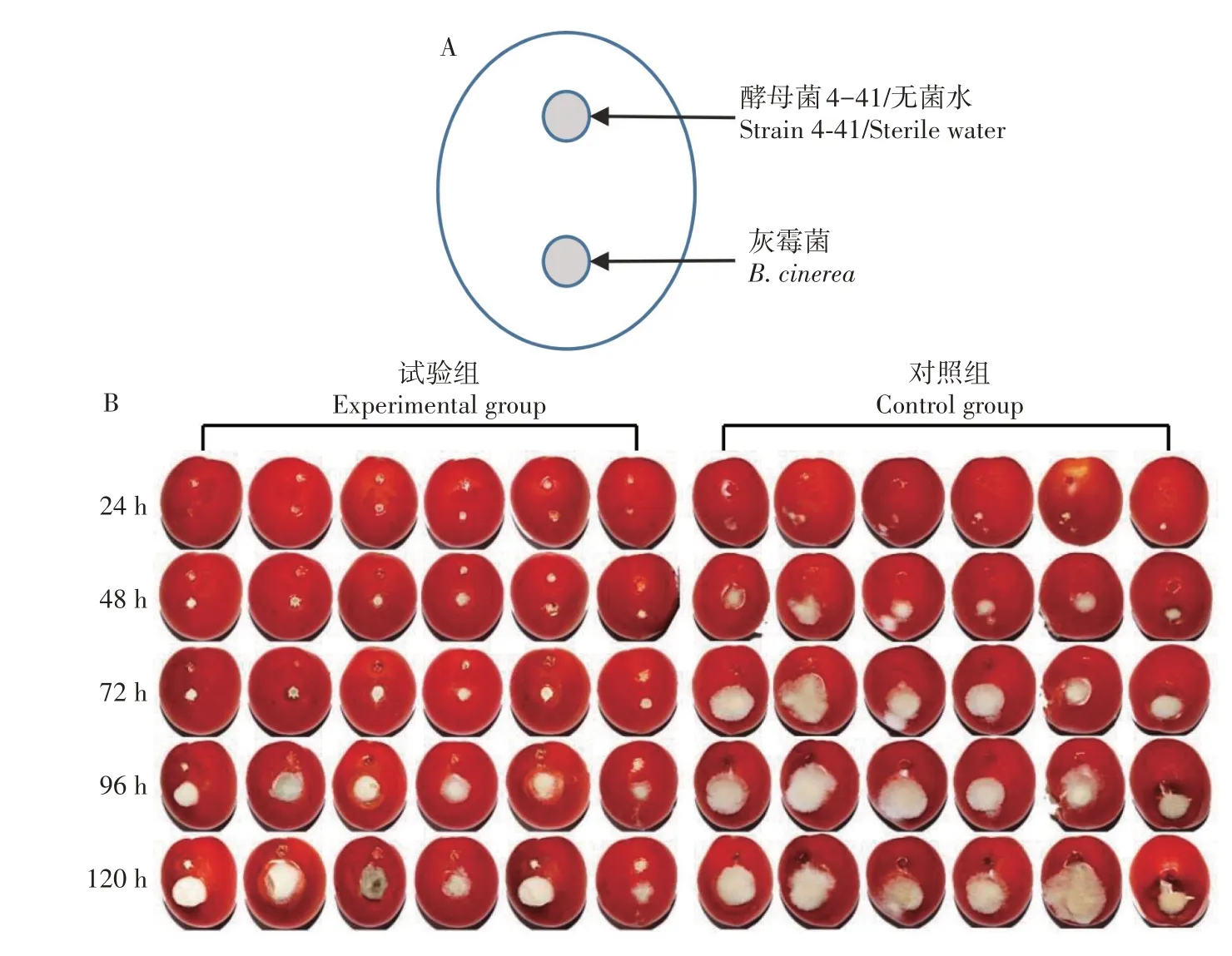
图10 酵母菌4-41诱导的防卫反应Fig.10 Induction of host resistance by the yeast strain 4-41
2.9 酵母菌4-41诱导的抗病性相关酶活性
拮抗酵母菌在诱导植物产生抗性的同时,往往能改变植物中抗性相关酶的活性。采用与2.8 相同的异伤接种法,每24 h 切取灰霉菌与酵母菌接种点之间的圣女果果肉组织,分别检测其POD、GLU、PPO、PAL 和CHI 的活性。结果表明,在接种后48 h内,接种有酵母菌的果实CHI 活性持续高于没有接种酵母菌的果实,随着培养时间的增加,CHI活性逐渐下降。说明该酵母菌能有效提高果实中CHI 活性(图11A)。检测POD 和GLU 活性发现,在接种后24~48 h,POD 和GLU 活性持续升高,且在48 h 达最大值,同时发现,接种有酵母菌的果实中POD 和GLU 活性均高于单独接种灰霉菌的果实,说明酵母菌4-41 能诱导果实中POD 和GLU 的活性升高(图11B、11C)。检测PPO 活性发现,从接种后24 h 开始,果实中PPO 活性逐渐降低,且接种有酵母菌的果实中PPO 活性明显低于没有接种酵母菌的果实,说明该酵母菌能有效抑制果实中PPO 活性(图11D)。检测果实中PAL 活性,结果显示,在接种后48 h,PAL 活性达最大值,且接种有酵母菌的果实中PAL 活性明显高于没有接种酵母菌的果实,说明该酵母菌能诱导果实中PAL活性升高(图11E)。
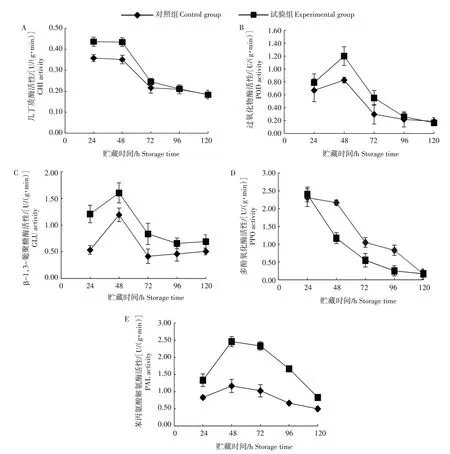
图11 酵母菌4-41对圣女果果实抗性相关酶活性的影响Fig.11 Effect of the antagonistic yeast 4-41 on activities of resistance-related enzymes in cherry tomato fruits
3 结论与讨论
果蔬采后病害是导致果蔬供应链中经济损失的主要因素之一,可发生在供应链的各个环节,如采收、分级、包装、运输、贮藏等[23]。应用微生物进行果蔬采后病害的生物防治是生防研究工作的一个新领域,拮抗酵母菌因其独特的生物学特点及作用方式在该领域的应用研究备受关注。由灰葡萄孢(Botrytis cinerea)引起的灰霉病又称灰腐病、白点病,该病原菌不仅是田间植物生产的重要病原之一[24-25],也是果蔬采后引起腐烂的主要病原之一,经常给果蔬保鲜行业带来巨大的经济损失[26]。本研究以灰霉菌与圣女果果实互作体系为模型,筛选鉴定到了1株对灰霉菌具有较强抑制效果的拮抗酵母菌Cyberlindnera saturnus4-41,该菌株在实验室条件下对圣女果果实表现出较强的防腐保鲜功能,为后续生防保鲜酵母菌的开发奠定了理论基础。
目前,由于拮抗酵母菌生防效果评价体系不健全,生防作用类型及机制研究不够全面和深入,从而导致生防制剂的货架期不能满足商业化的需求,社会对生防酵母菌的接受能力还需要逐渐提高。对酵母菌4-41抑菌机制的研究结果表明,该菌株能溶解培养基中的磷酸盐和氧化锌,这一机制可能有助于拮抗酵母菌将土壤中磷酸盐以及微量锌元素由难溶转化为易溶,促进植物对微量磷元素和锌元素的利用,增强植物自身的抗菌能力[16];铁载体是一类具有很强的特异螯合铁离子能力的小分子化合物,许多植物根际微生物可通过合成此类化合物来摄取环境中的铁,并将多余的铁提供给植物利用,还能与有害病原菌竞争铁元素,进而抑制病原菌的生长[27];该拮抗酵母菌能产氨气,将有机物质中的氮元素转化为氨进而有利于植物吸收,对植物表现出促生作用;通常情况,拮抗酵母菌通过产生生物膜,防止病原菌与植物表面直接接触,进而达到抑菌目的,该菌株能够稳定地黏附在96 孔聚苯乙烯板内,说明其具有生物成膜能力[18]。一直以来,人们普遍认为酵母菌不会产生抗生素,但越来越多的研究发现,酵母菌会产生抑菌物质,破坏病原菌的胞壁或菌丝结构,实现其抑菌作用[15]。本试验获得的拮抗酵母菌4-41能产生挥发性抑菌物质,抑制灰霉菌菌丝的生长和扩展。
多项研究表明,拮抗酵母菌可以与植物相互作用,诱导植物中防御酶的活性[28],其中POD、GLU、PAL和CHI被公认为是拮抗酵母菌诱导寄主产生系统抗性的重要酶。其中POD 属于植物防御酶的一种,能够清除活性氧,减少植物体内活性氧积累对植物造成的伤害,同时还参与木质素的合成,从而提高植物的抗病性,当植物受到病原菌的侵染时,该酶参与诱导产生可以直接作用于病原菌或者对抗性物质生成具有催化作用的一类蛋白质[29-30]。PAL 是植物体内苯丙烷类代谢的关键酶,在植物正常生长发育和抵御病菌侵染过程中起着重要作用[31]。几丁质是绝大多数真菌细胞壁的组成成分,CHI 可以通过降解病原菌细胞壁中的几丁质成分,破坏菌丝细胞壁,造成菌丝细胞壁变薄,破坏菌丝的生长发育。GLU 可通过降解病原真菌细胞壁的特定成分,使其原生质体膜破裂从而直接杀死病原菌,达到保护寄主的作用[32]。拮抗酵母菌通过提高圣女果果实中防御相关酶的活性,提高果实对灰霉菌的抗性。而PPO 可以催化番茄果实的内源性多酚物质转变为黑色素,造成番茄果肉褐变,导致番茄果实更容易腐烂,该酵母菌通过降低果实中PPO活性,在减慢果实腐烂速度的同时降低果实腐烂的程度[33]。
综上所述,拮抗酵母菌Cyberlindnera saturnus4-41 能通过产挥发性抑菌物质来抑制病原菌的生长,同时可以通过产氨气和铁载体、溶磷、溶锌以及形成生物膜和诱导寄主产生抗性等拮抗机制实现其抑菌目的。通过对拮抗酵母菌4-41 抗菌机制的研究,为该菌株的推广应用提供了试验依据和研究背景。
