Ghrelin 通过调节MAPK/ERK 通路对脂肪间充质干细胞神经元分化的影响
2023-07-18杨贺然李兴江胡嘉航李彦伟
杨贺然, 李兴江, 胡嘉航, 李彦伟
(1.牡丹江医学院附属红旗医院检验科,黑龙江 牡丹江 157000;2.牡丹江医学院解剖教研室,黑龙江 牡丹江 157000;3.牡丹江医学院附属红旗医院影像科,黑龙江 牡丹江 157000)
脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADSCs)是由脂肪组织中分离出的一种具有多种分化潜能的成体干细胞[1]。诱导ADSCs 向神经元分化对修复周围神经损伤有重要意义[2]。研究[3]显示:生长素释放肽等小分子在神经干细胞向神经元分化过程中起重要作用。Ghrelin 是在胃中产生的促生长激素释放多肽,具有较强的促进生长激素分泌和释放作用,可穿越血脑屏障,通过激活下丘脑促生长激素分泌启动食欲信号的传导和调节[4]。研究[5]显示:Ghrelin 可促进脑室下区增殖和增加脑嗅球中酪氨酸羟化酶表达以增加多巴胺神经元数量,还可促进脑神经干细胞增殖和增加脑神经干细胞中神经球直径及酪氨酸羟化酶表达,促进多巴胺能神经元分化。提示Ghrelin 可在下丘脑以外的中枢神经系统和神经元过程中发挥关键作用,高度分化的ADSCs 可在体外培养和诱导下向脂肪细胞及神经元分化[6]。研究[7]显示:10-9mol·L-1Ghrelin 作用于ADSCs,可促进ADSCs 向脂肪细胞分化,提示Ghrelin 有促进ADSCs 分化作用,但Ghrelin 促进ADSCs 向神经元分化尚未见报道。
丝裂素活化蛋白激酶(mitogen-activated protein kinase,MAPK)是生物体内重要的信号转导酶,参与介导细胞生长、发育、分裂和分化等多种生理过程。MAPK 可激活其亚族-细胞外信号调节 激 酶 (extracellular signal-regulated kinase,ERK)来调控细胞生存和增殖并介导胞外信号向胞内传导等[8]。研究[9]显示:MAPK 及ERK 是启动胚胎干细胞向神经元、脂肪细胞和成骨细胞定向分化及成熟的关键调控因子[9]。研究[10]证实:Ghrelin 可通过调控MAPK 和ERK 通路诱导骨髓来源的间充质干细胞向软骨分化,提示Ghrelin 有促进干细胞定向分化的作用,这可能与调控MAPK/ERK 促进增殖及分化通路有关。本研究从MAPK/ERK 通路方面,探讨Ghrelin 影响ADSCs 向神经元分化的可能机制,为Ghrelin 在干细胞组织修复领域的开发应用提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人ADSCs 购自上海雅吉生物科技有限公司。MTT 试剂盒(上海歌凡生物科技有限公司),Ghrelin(南京肽业生物科技有限公司),MAPK 抑制剂U0126(北京百奥莱博科技有限公司),Ghrelin 受体阻断剂D-赖氨酰3 生长激素释放肽6(D-Lys3-growth hormone releasing peptide-6,D-Lys3-GHRP-6)(北京孚博生物科技有限公司),MAPK、磷酸化MAPK(phosphorylated MAPK,p-MAPK)、ERK、磷 酸 化 ERK(phosphorylated ERK,p-ERK)、神经元特异性核蛋白(neuronal-specific nuclear protein,NeuN),微管蛋白(tubulin,Tuj-1)、神经丝蛋白(neurofilament protein,NF)、生长激素促分泌受体(growth hormone secretagogue receptor,GHSR)和神经元特异性烯醇化酶(neuron-specific enolase,NSE)抗体(美国Abcam 公司),NF-200(上海齐康生物科技有限公司),胎肝激酶1(fetal liver kinase 1,Flk1)购自美国Santa Cruz 公司。倒置显微镜和荧光显微镜均购自广州市明美光电技术有限公司,电转膜仪购于南京金斯瑞生物科技有限公司。
1.2 细胞培养、分组和处理ADSCs 于37 ℃水浴复苏后,置于含10%胎牛血清的DMEM (高糖)培养基中培养,细胞生长至80%~90%融合时开始传代。取第3 代ADSCs 细胞,以2×106mL-1的密度接种于6 孔细胞培养板中,并设置为空白组、神经分化诱导剂组、Ghrelin 组(给予600 μg·L-1Ghrelin)、U0126 组(给予40 ng·L-1U0126)、Ghrelin+U0126 组(给予600 μ g·L-1Ghrelin+40 ng·L-1U0126)和D-Lys3-GHRP-6 (给予10-10g·L-1D-Lys3-GHRP-6)组,每组6 个复孔。空白组正常培养;神经分化诱导剂组参照文献[11]采用含终浓度为40 μg·L-1碱性成纤维细胞生长因子的DF12 神经诱导培养基培养12 d;Ghrelin组和U0126 组参照文献[10]分别在神经分化诱导剂组基础上向培养基中加入终浓度为600 μg·L-1Ghrelin 和40 ng·L-1U0126 干预培养;Ghrelin+U0126 组在神经分化诱导剂组基础上向培养基中加入Ghrelin,并加入U0126 干预培养;D-Lys3-GHRP-6组在神经分化诱导剂组基础上参照文献[12]操作向培养基中加入终浓度为10-10g·L-1D-Lys3-GHRP-6培养,各组干预培养12 d 后进行后续试验。
1.3 倒置显微镜观察各组ADSCs 病理形态表现取处理后的各组ADSCs,采用4%多聚甲醛固定,于倒置显微镜下观察各组ADSCs病理形态表现。
1.4 免疫荧光法检测各组细胞中NF-200 和Tuj-1阳性表达率取处理后的各组细胞,弃去培养基,磷酸盐缓冲液清洗,采用4%多聚甲醛固定后,分别加入Tuj-1 和NF-200 一抗(1∶200)孵育过夜,次日滴加lexa-Flour488 标记的羊抗兔IgG 室温孵育3 h 后,滴加抗荧光淬灭封片液,然后置于荧光显微镜下观察并拍照,Image-Pro Plus 6.0 软件检测各视野下NF-200 和Tuj-1 阳性表达率。阳性表达率=Flour488 染色细胞数/4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole dihydrochloride,DAPI)染色细胞数×100%。
1.5 Western blotting 法检测各组细胞中MAPK/ERK 通路蛋白和细胞分化标志蛋白表达水平取处理后的各组细胞,弃去培养基,加入细胞裂解液匀浆后,取匀浆液提取蛋白,BCA 法测定蛋白浓度,取50 μg 蛋白,加入2 倍体积的电泳加样缓冲液,采用电转膜仪进行转膜反应,5%脱脂奶粉封闭及洗膜后,分别滴加1∶2 000 一抗(MAPK、p-MAPK、ERK、p-ERK、NSE、NeuN、Tuj-1、NF、GHSR、Flk1和CD29)抗体及1∶1 500 β-actin内参抗体,4 ℃孵育过夜,洗膜3次后,滴加羊抗兔辣根过氧化物酶二抗(1∶2 000)室温孵育120 min,洗膜后,滴加化学发光液显色,采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.6 统计学分析采用SPSS 24.0统计软件进行统计学分析。各组细胞中NF-200 和Tuj-1 阳性表达率,NSE、NeuN、Tuj-1、NF、GHSR、Flk1 和CD29蛋白表达水平及p-MAPK/MAPK 和p-ERK/ERK 比值均符合正态分布,以xˉ±s表示,多组间样本均数比较采用单因素方差分析,样本均数组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组ADSCs 病理形态表现细胞培养第10 天,空白组ADSCs 呈长梭形和螺旋状融合;神经分化诱导剂组细胞胞体收缩,长梭形胞体向类圆形转变,突起长度延长及类似神经元样细胞数增多。Ghrelin 组细胞胞体突起进一步增多,类圆形细胞数目进一步增多。U0126 组和D-Lys3-GHRP-6 组仅有少量细胞胞体收缩及类圆形转变。与Ghrelin 组比较,Ghrelin+U0126 组细胞胞体收缩及类圆形转变减少。见图1。
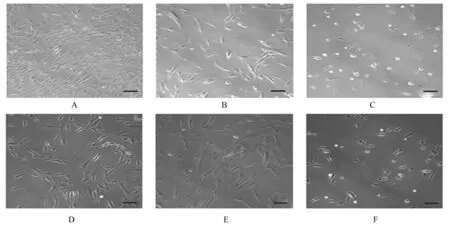
图1 各组ADSCs 病理形态表现(Bar=50 μm)Fig.1 Pathomorphology of ADSCs in various groups (Bar=50 μm)
2.2 各组ADSCs 中NF-200 和Tuj-1 阳性表达率绿色表示NF-200 和Tuj-1 阳性表达。与空白组比较,神经分化诱导剂组细胞中NF-200 和Tuj-1阳性表达率升高(P<0.05)。与神经分化诱导剂组比较,Ghrelin 组细胞中NF-200 和Tuj-1阳性表达率升高(P<0.05),U0126 组和D-Lys3-GHRP-6 组细胞中NF-200 及Tuj-1 阳性表达率降低(P<0.05)。与Ghrelin 组比较,U0126 组、D-Lys3-GHRP-6 组和Ghrelin+U0126 组细胞中NF-200 和Tuj-1 阳性表达率降低(P<0.05)。见图2 和表1。
表1 各组ADSCs 中NF-200 和Tuj-1 阳性表达率Tab.1 Positive expression rates of NF-200 and Tuj-1 in ADSCs in various groups (n=6,±s,η/%)

表1 各组ADSCs 中NF-200 和Tuj-1 阳性表达率Tab.1 Positive expression rates of NF-200 and Tuj-1 in ADSCs in various groups (n=6,±s,η/%)
*P<0.05 vs blank group;△P<0.05 vs neural differentiation inducer group;#P<0.05 vs Ghrelin group.
Group Blank Neural differentiation inducer Ghrelin U0126 D-Lys3-GHRP-6 Ghrelin+U0126 NF-200 0.61±0.06 4.43±0.26*Tuj-1 0.41±0.04 3.92±0.28*9.73±0.42△1.71±0.10△#1.92±0.16△#4.06±0.88#8.46±0.40△2.06±0.14△#2.07±0.16△#4.69±0.32#

图2 各组ADSCs 中NF-200 和Tuj-1 表达(免疫荧光,Bar=50 μm)Fig.2 Expressions of NF-200 and Tuj-1 in ADSCs in various groups(Immunofluorescence,Bar=50 μm)
2.3 各组ADSCs 中NSE、NeuN、Tuj-1 和NF 蛋白表达水平与空白组比较,神经分化诱导剂组细胞中NSE、NeuN、Tuj-1 和NF 蛋白表达水平升高(P<0.05)。与神经分化诱导剂组比较,Ghrelin 组细胞中NSE、NeuN、Tuj-1 和NF 蛋白表达水平升高(P<0.05),U0126 组和D-Lys3-GHRP-6 组细胞中NSE、NeuN、Tuj-1 及NF 蛋白表达水平降低(P<0.05)。与Ghrelin 组比较,U0126 组、D-Lys3-GHRP-6 组和Ghrelin+U0126 组细胞中NSE、NeuN、Tuj-1 及NF 蛋白表达水平降低(P<0.05)。见图3 和表2。
表2 各组ADSCs 中NSE、NeuN、Tuj-1 和NF 蛋白表达水平Tab.2 Expression levels of NSE, NeuN, Tuj-1, and NF proteins in ADSCs in various groups (n=6,±s)

表2 各组ADSCs 中NSE、NeuN、Tuj-1 和NF 蛋白表达水平Tab.2 Expression levels of NSE, NeuN, Tuj-1, and NF proteins in ADSCs in various groups (n=6,±s)
*P<0.05 vs blank group;△P<0.05 vs neural differentiation inducer group;#P<0.05 vs Ghrelin group.
Group Blank Neural differentiation inducer Ghrelin U0126 D-Lys3-GHRP-6 Ghrelin+U0126 NF 1.17±0.09 1.83±0.18*2.55±0.20△1.30±0.13△#1.31±0.14△#1.81±0.18#NSE 1.11±0.08 1.42±0.14*2.33±0.22△1.30±0.10△#1.29±0.12△#1.66±0.14#NeuN 1.07±0.08 1.77±0.17*2.44±0.21△1.24±0.14△#1.22±0.14△#1.79±0.15#Tuj-1 1.07±0.09 1.56±0.15*2.68±0.20△1.29±0.10△#1.26±0.11△#1.57±0.15#

图3 各组ADSCs 中NSE、NeuN、Tuj-1 和NF 蛋白表达电泳图Fig.3 Electrophoregram of expressions of NSE,NeuN, Tuj-1, and NF proteins in ADSCs in various groups
2.4 各组ADSCs 中GHSR、Flk1 和CD29 蛋白表达水平与空白组比较,神经分化诱导剂组细胞中GHSR 蛋白表达水平升高(P<0.05),Flk1 和CD29 蛋白表达水平降低(P<0.05)。与神经分化诱导剂组比较,Ghrelin 组细胞中GHSR 蛋白表达水平升高(P<0.05),Flk1 和CD29 蛋白表达水平降低(P<0.05),U0126 组和D-Lys3-GHRP-6 组细胞中GHSR 蛋白表达水平降低(P<0.05),Flk1 和CD29 蛋白表达水平升高(P<0.05)。与Ghrelin 组比较,U0126 组、D-Lys3-GHRP-6 组和Ghrelin+U0126 组细胞中GHSR 蛋白表达水平降低(P<0.05),Flk1 和CD29 蛋白表达水平升高(P<0.05)。见图4 和表3。
表3 各组ADSCs 细胞中GHSR、Flk1 和CD29 蛋白表达水平Tab.3 Expression levels of GHSR, Flk1,and CD29 proteins in ADSCs in various groups(n=6,±s)

表3 各组ADSCs 细胞中GHSR、Flk1 和CD29 蛋白表达水平Tab.3 Expression levels of GHSR, Flk1,and CD29 proteins in ADSCs in various groups(n=6,±s)
*P<0.05 vs blank group;△P<0.05 vs neural differentiation inducer group;#P<0.05 vs Ghrelin group.
Group Blank Neural differentiation inducer Ghrelin U0126 D-Lys3-GHRP-6 Ghrelin+U0126 CD29 1.18±0.07 0.50±0.04*0.12±0.01△0.99±0.09△#0.91±0.08△#0.49±0.04#GHSR 1.00±0.09 1.74±0.17*2.56±0.20△1.29±0.11△#1.28±0.13△#1.76±0.17#Flk1 1.04±0.08 0.55±0.14*0.17±0.01△0.97±0.09△#0.92±0.09△#0.51±0.05#
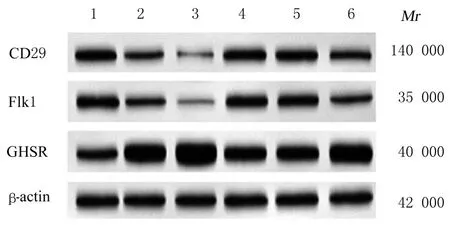
图4 各组ADSCs中GHSR、Flk1和CD29蛋白表达电泳图Fig.4 Electrophoregram of expressions of GHSR,Flk1,and CD29 proteins in ADSCs in various groups
2.5 各组ADSCs 中MAPK/ERK 通路蛋白表达水平与空白组比较,神经分化诱导剂组细胞中p-MAPK/MAPK 和p-ERK/ERK 比值升高(P<0.05)。与神经分化诱导剂组比较,Ghrelin 组细胞中p-MAPK/MAPK 和p-ERK/ERK 比值升高(P<0.05),U0126 组及 D-Lys3-GHRP-6 组细胞中p-MAPK/MAPK 和p-ERK/ERK 比值降低(P<0.05)。与Ghrelin 组比较,U0126 组、D-Lys3-GHRP-6 组和Ghrelin+U0126 组细胞中p-MAPK/MAPK 和p-ERK/ERK 比值降低 (P<0.05)。见图5 和表4。
表4 各组ADSCs 中p-MAPK/MAPK 和p-ERK/ERK 比值Tab.4 Ratios of p-MAPK/MAPK and p-ERK/ERK in ADSCs in various groups(n=6,±s)

表4 各组ADSCs 中p-MAPK/MAPK 和p-ERK/ERK 比值Tab.4 Ratios of p-MAPK/MAPK and p-ERK/ERK in ADSCs in various groups(n=6,±s)
*P<0.05 vs blank group;△P<0.05 vs neural differentiation inducer group;#P<0.05 vs Ghrelin group.
Group p-ERK/ERK p-MAPK/MAPK 1.00±0.09 1.84±0.18*2.66±0.22△1.21±0.10△#1.26±0.12△#1.80±0.18#1.04±0.08 1.65±0.16*2.47±0.25△1.37±0.13△#1.32±0.13△#1.69±0.15#Blank Neural differentiation inducer Ghrelin U0126 D-Lys3-GHRP-6 Ghrelin+U0126

图5 各组ADSCs中MAPK、p-MAPK、ERK 和p-ERK蛋白表达电泳图Fig.5 Electrophoregram of expressions of MAPK,p-MAPK, ERK and p-ERK proteins in ADSCs in various groups
3 讨 论
ADSCs 和骨髓间充质干细胞均存在干细胞分化潜能,具有多向分化能力且增殖速度快,在组织工程研究中具有重要作用。在周围神经系统损伤后,ADSCs 有促神经修复及再生潜能,可进行跨胚层分化,分化为星形胶质细胞或神经细胞,加速神经发育[13]。ADSCs 诱导神经元分化具有操作简单和无不良反应等特点,被认为在治疗神经系统疾病方面有较大的潜力,寻找促进ADSCs 向神经元分化的有效药物,对于提高干细胞移植和神经修复有重要意义。
Ghrelin 是GHSR 的内源性配体,在神经干细胞分化和神经修复方面发挥重要作用[14]。研究[15]显示:GHSR 可在体内神经干细胞膜上表达,GHSR 途径活化可诱导胚胎脊髓神经元前体细胞生长,提示作为GHSR 内源性配体的Ghrelin 也可能发挥促神经调控作用。HAN 等[16]采用Ghrelin 外源性干预,可使GHSR 基因敲除小鼠嗅球部分多巴胺能神经元数增加,且Ghrelin 基因敲除小鼠脑室室管膜下区和海马齿状回神经祖细胞的再生及增殖明显减少,外源性给予Ghrelin 可明显增加神经细胞数,提示Ghrelin 可作为神经再生调节因子,影响神经元分化。研究[17]显示:Ghrelin 可促进骨髓间充质干细胞向成骨和成脂分化,ADSCs 较骨髓间充质干细胞更易获得,但Ghrelin 促进ADSCs向神经元分化的研究尚未见报道。NF-200 和Tuj-1是与细胞骨架有关的蛋白,分别在成熟或未成熟神经元中表达。此外,NSE 和NeuN 也在成熟神经元中表达,这些蛋白均可作为神经元分化标志物。本研究结果显示:神经分化诱导剂诱导ADSCs 向神经元分化过程中,加入Ghrelin 后,ADSCs 向神经元分化增强,提示Ghrelin 可作为神经分化诱导剂的辅助药物而促进ADSCs 向神经元分化。
MAPK/ERK 通路是参与细胞分化的重要通路之一。研究[18]证实:MAPK 是将胞外信号传入胞内并启动胞内信号增殖和分化及转录的重要调节因子,胞外信号在激活酪氨酸激酶后,MAPK 可迅速感应胞外刺激信号,并迅速磷酸化同时刺激下游胞内调节因子ERK 活化。ERK 活化不仅可磷酸化胞内底物使微管相关蛋白2(microtubule-associated protein 2,MAP2)和突触蛋白(synapticprotein,tau)等蛋白表达促进神经突触再生,还可与糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)形成交叉串扰作用而促进Wnt 活化,发挥促分化作用[19]。WANG 等[20]发现MAPK/ERK 通路的活化可促进骨髓间充质干细胞向神经元分化。本研究结果显示:神经诱导培养基诱导ADSCs 向神经元分化过程中,MAPK/ERK 通路被激活,采用ERK 阻断剂U0126 阻断MAPK/ERK 通路活化后,ADSCs向神经元分化明显缓滞,提示MAPK/ERK通路活化参与ADSCs向神经元分化的调节。研究[10]显示:Ghrelin 的配体GHSR 可通过促进MAPK/ERK通路活化,促进骨髓间充质干细胞向神经元分化。本研究结果显示:采用Ghrelin 受体阻断剂D-Lys3-GHRP-6 阻断GHSR 表达后,ADSCs 中MAPK/ERK 通路被抑制,ADSCs 向神经元分化作用明显减弱,提示Ghrelin 可促进MAPK/ERK 活化和ADSCs 向神经元分化。MAPK 抑制剂U0126 可明显减弱Ghrelin 的促MAPK/ERK 活化及促ADSCs向神经元分化作用,提示Ghrelin促进ADSCs向神经元分化的作用可能与激活MAPK/ERK通路有关。
综上所述,Ghrelin 可通过激活MAPK/ERK 通路,促进ADSCs 向神经元分化。这可能为Ghrelin在干细胞组织修复工程领域的研究提供参考。
