铝胁迫下不同小麦基因型根尖多胺含量变化与耐铝性的关系
2023-07-17周茂润丁茂文岳文丽周可金孙成亮林咸永
余 燕,周茂润,董 嘉,丁茂文,岳文丽,周可金,孙成亮,林咸永
(1.安徽农业大学农学院,安徽合肥 230036;2.浙江大学环境与资源学院,浙江杭州 310058)
全球约30%的土地面积和50%的潜在可耕地是pH值低于5.5的酸性土壤,铝毒是酸性土壤上作物生长最主要的限制因子[1-3]。铝毒害后植物表现出的最典型症状是根系生长受阻,根尖是铝毒害的原初位点[4]。铝毒害会造成植物体一系列生理生化过程紊乱,如抑制养分吸收、干扰激素平衡和植物细胞信号转导[5-7]。铝胁迫会引起植物体内活性氧(reactive oxygen species,ROS)代谢失衡,对植物造成氧化损伤[7-9]。植物在铝胁迫下可通过诱导有机酸分泌、提高根际pH值、改变细胞壁特性和质膜功能等机制抵御铝的毒害[10-11],但目前关于在对铝胁迫的适应过程中植物体内多胺、一氧化氮等信号分子的调控机制尚不清楚[12-15]。
多胺是植物体中重要的生理活性物质,可对逆境胁迫作出快速反应,进而启动合成和分解过程,参与调节植物对逆境的适应性[16-18]。植物体内常见的多胺包括腐胺(putrescine,Put),亚精胺(spermidine,Spd)和精胺(spermine,Spm)[19-20]。外源添加适量多胺或者通过分子手段调控其代谢途径可在一定程度上缓解植物逆境损伤[21-24]。关于多胺对植物铝胁迫的响应也有一些研究报道。 研究发现,铝胁迫可诱导水稻根系中Put大量积累,这可能是其抑制水稻根系伸长的原因[25]。而西洋梨[12]和红芸豆[26]中Spd或Put的积累有助于增强植株耐铝性,但也有人认为Put与红云衫细胞悬浮液的耐铝性无关[27]。在番红花中,外源Put、Spd和Spm处理均能显著缓解铝对植株根系伸长的毒害作用[28]。由此可见,铝胁迫下植物体内多胺含量变化及其作用并不完全一致,在农作物上也多采用单一品种进行研究。本试验以前期筛选的耐铝性差异显著的2个小麦基因型为研究材料,分析了铝胁迫下小麦根尖多胺种类和含量的变化及其与铝耐性的关系,以期进一步阐明小麦耐铝性的生理生化机制。
1 材料与方法
1.1 植物材料与培养
本试验以前期筛选的耐铝性差异显著的2个小麦基因型西矮麦1号(耐性)和扬麦5号(敏感)为研究材料[29]。种子消毒清洗后用去离子水浸种过夜,然后用湿润的纱布包裹置于25 ℃培养箱中避光催芽过夜。将发芽的种子转移到悬浮于0.5 mmol·L-1CaCl2(pH 4.3 ± 0.1)溶液的塑料筐上进行培养。营养液的pH用浓度为0.1 mol·L-1的HCl或NaOH进行调节,且每天更换营养液。控制培养室的光照强度为300 μmol·m-2·s-1,光照和温度设置为白天12 h/25 ℃和夜晚12 h/22 ℃,相对湿度为70%。3 d后选取长势一致的小麦幼苗进行处理。试验设置无铝对照(CK)和30 μmol·L-1AlCl3处理(Al),在铝胁迫不同时间取根尖进行测定。
1.2 测定指标与方法
1.2.1 根系伸长量和铝含量的测定
将3 d苗龄且长势一致的小麦幼苗转移在含0或30 μmol·L-1AlCl3的0.5 mmol·L-1CaCl2(pH 4.3 ± 0.1)溶液中处理3、6、12和24 h。用直尺分别量取铝胁迫前后的小麦主根长度,各处理重复测定20株。根系伸长量即处理前后的根长度差。小麦根尖铝含量依据Yu等[14]的方法测定,将处理后的小麦根尖0~10 mm部分(约0.15 g)用刀片迅速切下,用0.5 mmol·L-1CaCl2(pH 4.3 ± 0.1)溶液冲洗3次后放入含10 mL 2 mol·L-1HCl溶液的离心管中震荡浸提24 h,然后用ICP-MS(Agilent 7500A,California,USA)测定。


1.2.3 根尖MDA含量和Evans Blue吸收量的测定
脂质过氧化程度通常以MDA含量为指标,细胞膜的完整性采用Evans blue吸收量的方法进行测定[31]。
1.2.4 组织染色和显微观察

1.2.5 多胺含量的测定
多胺采用高效液相色谱法进行测定[32-33]。小麦根尖用5%(w/v)预冷的高氯酸(perchloric acid,PCA)在冰上充分研磨成匀浆,冰浴浸提1 h后,12 000 g 4 ℃下离心20 min。沉淀用5% PCA进一步提取,离心,重复两次,分别收集三次所得上清液和沉淀。
取混匀的上清液1 mL装入安瓿瓶中,加入12 mol·L-1HCl封口,在110 ℃下酸解18 h。酸解后,在70 ℃下干燥后重溶于5% PCA中,然后取上清液加入1 mL 2 mol·L-1NaOH和10 μL苯甲酰氯原液进行衍生,涡旋20 s混匀,37 ℃反应25 min后加入2 mL饱和NaCl混匀中止反应,加入2 mL的乙醚萃取苯甲酰化的多胺,离心后取1 mL乙醚相真空干燥,再次加入1 mL乙醚混匀干燥(重复2~3次),直到没有明显的苯甲酰氯气味为止。最后,加入200 μL甲醇涡旋溶解。经0.22 μmol·L-1滤膜过滤后,放入棕色液相色谱瓶内用高效液相色谱仪(Agilent 1200,USA)检测。进样量为10 μL,色谱柱为Elipse XDB-C18反向色谱柱(4.6 mm × 150 mm 5 μm;Agilent,USA),柱温30 ℃,流动相为65%的甲醇,流速0.6 mL·min-1。用紫外检测器于254 nm处检测。以Put、Spd、Spm(Sigma-Aldrich)样品做标准曲线,检测方法同样品。沉淀用5% PCA反复洗涤(2~3次)除去残留的可溶性多胺,然后装入安瓿瓶中,加入12 mol·L-1HCl封口,110 ℃下酸解18 h。酸解后,过滤除去碳化物质,70 ℃下干燥后,重溶于5% PCA,然后按照上述方法进行衍生和测定。上清液和沉淀中含量相加即为多胺总量,单位为μmol·g-1FW。
1.3 数据分析与作图
使用DPS 18.10数据处理系统进行统计分析,处理间差异显著性运用LSD法比较,采用OriginPro 2022作图。
2 结果与分析
2.1 铝胁迫对小麦根系伸长和根尖铝积累量的影响
铝胁迫6 h可显著抑制两个小麦基因型的根系伸长,且随着铝胁迫时间的延长,两个基因型根系伸长的受抑程度均逐渐增大(图1)。扬麦5号的根系伸长量始终低于西矮麦1号,且基因型之间的差异随着铝胁迫时间的延长而逐渐增大。铝胁迫24 h后,扬麦5号和西矮麦1号的根系伸长量分别为对照的30.21%和47.15%。铝胁迫下,扬麦5号根尖的铝积累量及苏木精染色深度均显著高于西矮麦1号(图2)。这表明铝胁迫对小麦根系造成了毒害,且扬麦5号根系生长受抑制程度更严重。

图柱上不同字母表示处理间差异显著(P<0.05)。下图同。
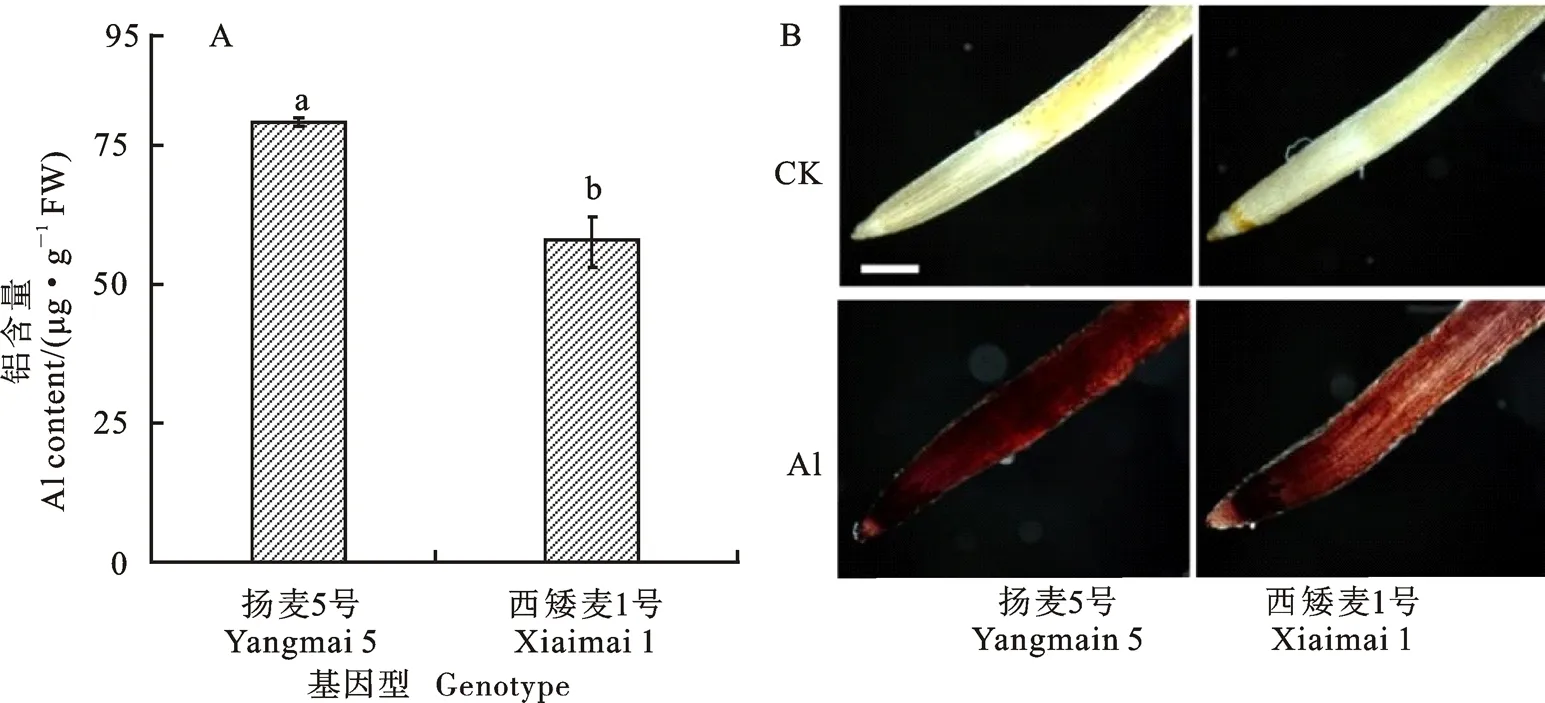
图2 铝胁迫下两个不同基因型小麦根尖铝积累情况
2.2 铝胁迫对小麦根系氧化损伤和活性氧产生的影响
铝胁迫24 h后扬麦5号和西矮麦1号根尖MDA含量分别较CK增加了147.20%和 67.12%(图3A),Evans blue吸收量分别增加了226.96%和196.14%(图3B)。Schiff’s reagent染色后,铝胁迫24 h后两个基因型小麦根尖染色程度均不同程度增加,说明铝胁迫加剧了小麦根系膜脂过氧化,其中扬麦5号膜脂过氧化程度更严重(图3C)。从Evans blue吸收的染色结果(图3D)看,铝胁迫24 h后扬麦5号根尖着色更深,进一步说明其Evans blue吸收量更大,细胞膜完整性的破坏程度更严重。
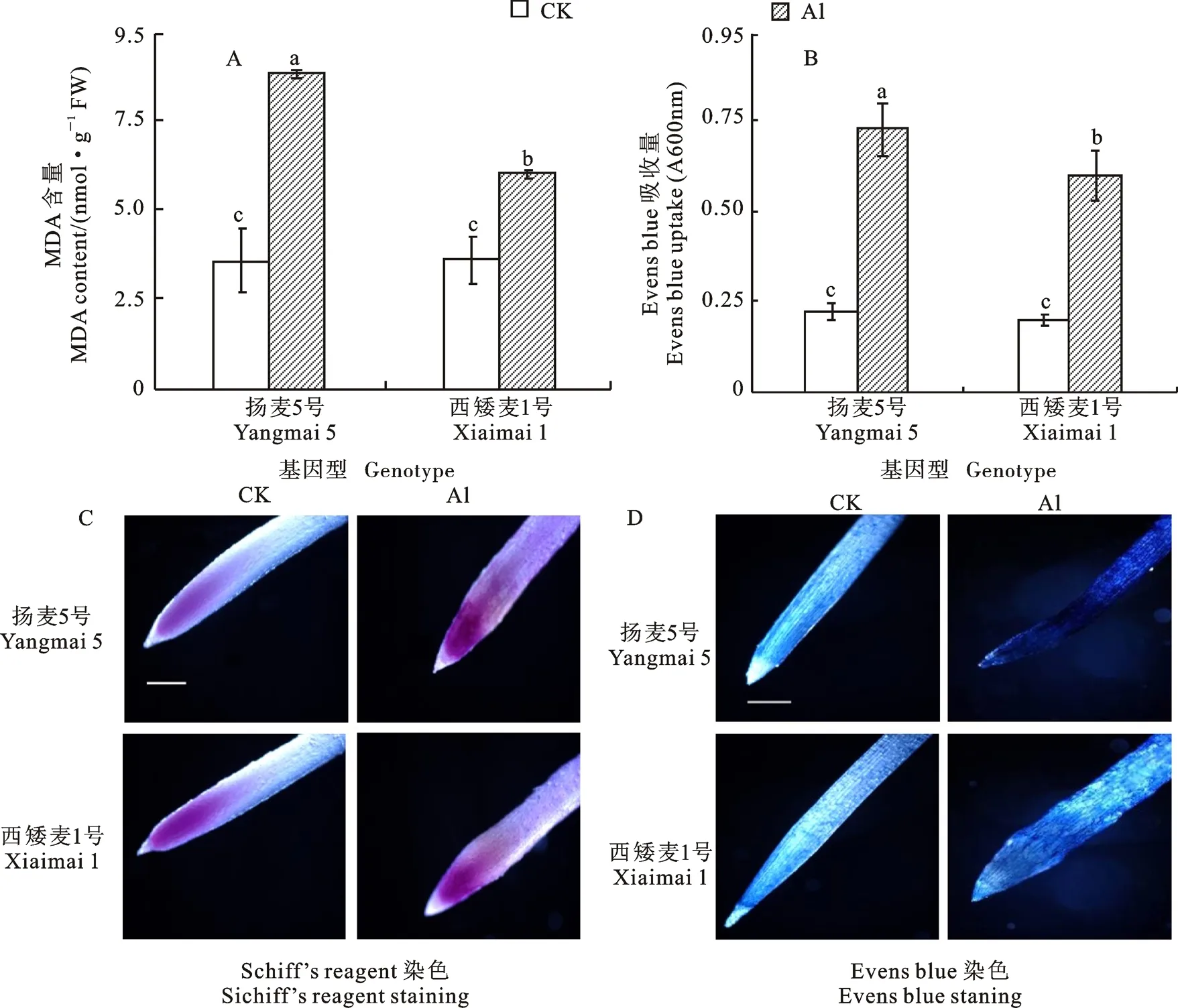
图3 铝胁迫对两个小麦基因型根尖膜脂过氧化程度和细胞膜完整性的影响


图4 铝胁迫对两个小麦基因型根尖活性氧产生的影响
2.3 铝胁迫对小麦根系多胺含量的影响
在CK条件下,小麦根尖Put含量以及Spd含量较低且相对稳定,而Spm未被检测到(可能由于含量低于检测限);在铝胁迫下,2个基因型根尖Put总量随铝胁迫时间的延长均不同程度增加,而Spd总含量则呈降低趋势(图5)。铝胁迫6 h时西矮麦1号的Put含量显著增加,在胁迫12 h时达到峰值32.11 μmol·g-1FW,约为CK的2倍;扬麦5号的Put总量仅在胁迫12 h后比CK增加约26.92%。与Put含量表现相反,铝胁迫后Spd含量随铝胁迫时间延长而逐渐下降,铝胁迫24 h时扬麦5号和西矮麦5号分别较CK下降 46.24%和24.90%(图5B)。这表明铝胁迫诱导的多胺水平差异性变化可能是两个小麦基因型耐铝性不同的重要原因。

*和**分别表示在同一时间下Al胁迫处理与CK差异显著(P<0.05)和极显著(P<0.01)。
2.4 外源多胺及合成抑制剂对小麦根系伸长和氧化损伤的影响
不同浓度和不同种类的多胺对铝诱导的小麦根系伸长的抑制作用效果不同(图6)。其中,0.5~10 mmol·L-1Put处理均不同程度地缓解了铝胁迫对小麦根系伸长的抑制;当Put浓度为2 mmol·L-1时,缓解效果最佳,扬麦5号和西矮麦1号的根系伸长量分别为CK的76.05%和85.00%,分别比铝单独处理高152.96%和89.23%,对扬麦5号根系伸长受抑的缓解程度更大。而Spd和Spm不仅无缓解效果,甚至较低的浓度就加剧铝毒程度(图6B和C)。

图6 外源多胺处理对铝胁迫下小麦幼苗根系伸长的影响
D-精氨酸(D-Arginine,D-Arg)是腐胺合成酶精氨酸脱羧酶(ADC)的竞争性抑制剂,可有效抑制植物体内多胺的合成。图7结果显示,CK条件下添加D-Arg对铝毒害相关的各指标无显著影响,但在铝胁迫下添加D-Arg处理后扬麦5号和西矮麦1号根尖的MDA含量、Evans blue吸收量分别增加了48%、107%和43%、69%。可见,抑制多胺合成加剧了铝对小麦根系的毒害,且西矮麦1号的加剧幅度更大,反向证明了腐胺可能有增强植物耐铝性的作用。

图7 D-精氨酸(D-Arg)对铝胁迫下小麦幼苗根尖MDA含量和Evans blue吸收量的影响
3 讨 论
铝毒是酸性土壤上限制作物生长最主要的障碍因子,植物根系伸长受抑是铝毒害后早期最典型的症状[4,7,10]。铝在植物体内的积累常会引起一系列生理生化变化,如活性氧大量积累、膜脂过氧化以及细胞膜完整性损伤程度增加等[8-9,31],同时会诱导植物对铝毒胁迫的适应性机制,如分泌有机酸、多胺积累等[3,11-13]。本试验结果表明,铝胁迫下,西矮麦1号根系中Put含量迅速增加,Spd含量缓慢下降(图5),同时活性氧积累量(图4)、MDA含量和Evans blue吸收量较低(图3),根尖铝积累量(图2)和根系伸长受抑程度(图1)也较轻;而铝敏感基因型扬麦5号根系Put含量增加较慢且幅度小,而Spd含量下降幅度较大,铝毒害程度较重,表明铝胁迫诱导的多胺水平变化与小麦耐铝性密切有关。
研究表明,多胺对增强植物的抗逆性有重要的作用,并且植物体内多胺水平的变化对逆境胁迫非常敏感,抗性植物在胁迫下通常会积累较高含量的多胺[14,16,19,22]。例如,在鹰嘴豆和大豆中,水分胁迫诱导多胺含量显著升高,其中Put升幅最大,植株表现出较高胁迫耐性;但多胺尤其Put含量下降时植株则表现出严重的胁迫损伤[34]。盐胁迫可显著诱导耐性品种Pokkali中Put尤其是结合态Put的积累,而敏感品种则下降,表明Put积累及其向结合态转化有助于增强植物抗盐性[35]。本研究中,铝胁迫下不同耐铝性小麦基因型根尖多胺水平及其变化有所不同。铝胁迫下西矮麦1号根尖Put含量的增加幅度显著大于扬麦5号;Spd含量减少,而西矮麦1号下降幅度却明显小于扬麦5号(图5)。这表明Put含量增加可能有利于提高小麦幼苗对铝胁迫的适应能力,而Spd含量下降则有可能降低耐铝性。这与Wen等[12]和Wang等[26]研究得出Spd或Put积累有助于增加西洋梨和红芸豆的耐铝性,以及Wang和Kao[25]研究得出Put大量积累是水稻铝毒害重要原因的结论并不完全一致,其原因可能与植物种类、对铝胁迫的耐受程度、胁迫程度与时间的不同有关。本研究采用耐铝性差异显著的两个小麦基因型为材料,分析其在短期铝胁迫下根系多胺含量的变化,更有利于阐明其与耐铝性的关系。
植物体内多胺生物合成的中心产物是Put,主要来源于ADC和鸟氨酸脱羧酶(CDC)两种途径[36]。鸟氨酸脱羧酶途径主要在植物的生长发育中起作用,而ADC则与植物对胁迫的响应有关[16,35]。例如,Do等[36]对21个水稻品种多胺合成相关基因表达分析发现,干旱胁迫诱导的多胺积累主要依赖于ADC途径。盐胁迫下植株中ADC活性受抑后,Put合成减少[37]。但也有研究认为,ADC和ODC两种酶均受氧化胁迫[38]和镉胁迫[22]诱导,这两种酶虽然是两个独立代谢途径的关键酶,但在某些胁迫条件下可协同调控植物体内多胺水平的变化。我们前期的试验通过对多胺合成酶活性的测定发现,铝胁迫下多胺的合成主要归因于ADC活性的增加[14]。铝胁迫下添加ADC抑制剂D-Arg处理显著加剧了铝导致的膜脂过氧化和膜透性增加,且对西矮麦1号的加剧程度更严重(图7),进一步反向证明了Put积累在增强小麦耐铝性中的作用。
4 结 论
铝胁迫下小麦根尖多胺种类和含量的变化是调控小麦耐铝性/铝敏感性的重要因素。铝诱导的西矮麦1号根尖Put含量大幅增加可能是其具有较强耐铝性的主要原因,而扬麦5号在铝胁迫下根尖Spd含量大幅下降可能是其对铝较敏感的原因。但是关于多胺种类及含量变化是如何影响植物耐铝性的尚不清楚,关于铝胁迫下植物体内多胺调控植物耐铝性的生理和分子机制有待进一步研究。
