青石斑幼鱼致病病原哈维氏弧菌的分离鉴定及致病性分析
2023-07-17郭美玲庞月刘芯睿刘玉茹薛淑霞孙金生
郭美玲 庞月 刘芯睿 刘玉茹 薛淑霞 孙金生
摘要 为阐明哈维氏弧菌对青石斑幼鱼的致病特性,开展了人工感染试验,注射感染健康青石斑幼鱼14 d,其半致死剂量(LD50)为6×105 CFU/mL。毒力基因分析表明,该菌株携带鞭毛结构基因flaB、flaC,溶血素基因vhhA、vhhB,群体效应调节基因luxR和几丁质酶基因chiA 6个毒力基因。耐药性分析表明,菌株TJYG-42对甲硝唑(MTZ)、链霉素(S)、阿莫西林(AMX)和氨苄西林(AM) 4种药物具有抗性。组织病理学分析表明,菌株TJYG-420感染引起了鱼体组织明显的病理变化,包括皮肤组织中囊状细胞数量明显增加,鳃细胞增生、肿胀、毛细血管扩张,肠黏膜断裂破损,部分绒毛脱落,肝脏细胞空泡化等。这些研究结果将为养殖青石斑鱼细菌性疾病的防治提供理论基础。
关键词 青石斑鱼;哈维氏弧菌;耐药性;毒力基因;组织病理学评估
中图分类号 S 941 文献标识码 A
文章编号 0517-6611(2023)12-0089-05
doi:10.3969/j.issn.0517-6611.2023.12.020
Identification and Pathogenicity Analysis of Vibrio harveyi from Juvenile Yellow Grouper (Epinephelus awoara)
GUO Mei-ling,PANG Yue,LIU Xin-rui et al
(College of Life Science,Tianjin Normal University,Tianjin 300387)
Abstract In order to elucidate the pathogenic characteristics of the V.harveyi isolate on juvenile yellow grouper,we conducted artificial infection experiments using intraperitoneal injection and the LD50 was determined as 6×105 CFU/mL in 14 days.The virulence gene analysis showed that the V.harveyi isolate carried 6 virulence genes,including flagellin (flaB、flaC),protease (chiA),hemolysin (vhhA、vhhB),population sensing system (luxR).Antibiotic susceptibility analysis showed that the V.harveyi isolate was susceptible to most antibiotics and resistant to only four drugs,including metronidazole(MTZ),streptomycin(S),amoxicillin(AMX) and ampicillin(AM).Histopathological analysis showed that the infection of the V.harveyi isolate caused obvious pathological changes in fish tissues,including more sacciform cells which cytoplasmic content formed an eosinophilic clump in the centre presented in skin tissues; cellular swelling vacuolation inflammatory infiltrating and angiotelectasis in gill lamellae; blunted,fused or shed intestinal villi and loosened mucous layer and connective tissues in intestine; cellular vacuolation in liver.The results suggest that the V.harveyi isolate is the causative pathogen causing massive mortalities in juvenile yellow grouper,carries a high number of virulence genes,is susceptible to most antibiotics,and its infection caused severe histopathological changes in the fish.These results of these studies will provide technical supports for the control of bacterial diseases in cultured yellow grouper.
Key words Vibrio harveyi;Epinephelus awoara;Drug resistance;Virulence genes;Histopathological analysis
基金項目 天津市海水养殖现代农业产业技术体系创新团队项目(ITTMR-S2022006);天津市劳模创新团队项目。
作者简介 郭美玲(1996—),女,山东潍坊人,硕士研究生,研究方向:水产病害学。*通信作者,研究员,从事水产病害学研究。
收稿日期 2023-01-05
青石斑(Epinephelus awoara)是我国重要的海水养殖经济鱼类,随着养殖规模的扩大及养殖环境的恶化,养殖青石斑疾病频发,给养殖企业造成了较大的经济损失。弧菌是海水养殖鱼类的主要致病病原,隶属于弧菌科弧菌属,常见于海水中。近年来,弧菌引起的鱼类疾病越来越多。据报道,多种弧菌可以感染海水养殖鱼类,如副溶血弧菌(V.parahaemolyticus)[1]、拟态弧菌(V.mimicus)[2]、哈维氏弧菌(V.harveyi)[3]、溶藻弧菌(V.anguillarum)[4]等。近年来,关于哈维氏弧菌感染海水养殖鱼类的研究报道较多。哈维氏弧菌(vibrio harveyi)是一种海洋革兰氏阴性发光微生物,生活在河口和海洋栖息地,需要氯化钠[5]。该细菌是养殖水生鱼类的一种重要病原体,可以感染多种水生鱼类。患病鱼体的常见临床症状包括皮肤溃疡、鳞片脱落、肌肉坏死和鳃盖上的结节等。研究表明,不同分离株的哈维氏弧菌,其致病特性存在差异。笔者对哈维氏弧菌的新分离株进行了致病性研究,将为阐释哈维氏弧菌的流行及为养殖青石斑细菌性疾病的预防和控制提供技术支撑。
1 材料与方法
1.1 试验材料 青石斑幼鱼购自天津某海水工厂化养殖场,体长8~12 cm,养殖水温(22±1)℃,盐度(25‰~26‰)。
1.2 人工感染试验
健康青石斑幼鱼在实验室暂养5 d后,随机分为7组,6组为试验组,1组为对照组,每组10尾鱼。采用腹腔注射的方式,试验组注射不同浓度梯度(4.7×107、4.7×106、4.7×105、4.7×104、4.7×103、4.7×102 CFU/mL)的TJYG-420菌悬液,注射剂量0.1 mL/尾。对照组注射同剂量0.7 % NaCl溶液。观察并记录鱼体发病症状及死亡情况。取濒死青石斑幼鱼的体表、肝脏、脾脏、肾脏等器官组织,再次分离纯化细菌,并进行鉴定。按照寇氏法计算病原菌对青石斑幼鱼的半致死剂量(LD50)。
1.3 菌株TJYG-420的鉴定
1.3.1 生理生化特性。
采用弧菌科和肠杆菌科生化鉴定管(购自杭州微生物试剂有限公司)测定细菌的生理生化特征。参照《常见细菌系统鉴定手册》[6]和《伯杰氏细菌鉴定手册》[7]生化指标分析菌株特征。
1.3.2 分子生物学鉴定。
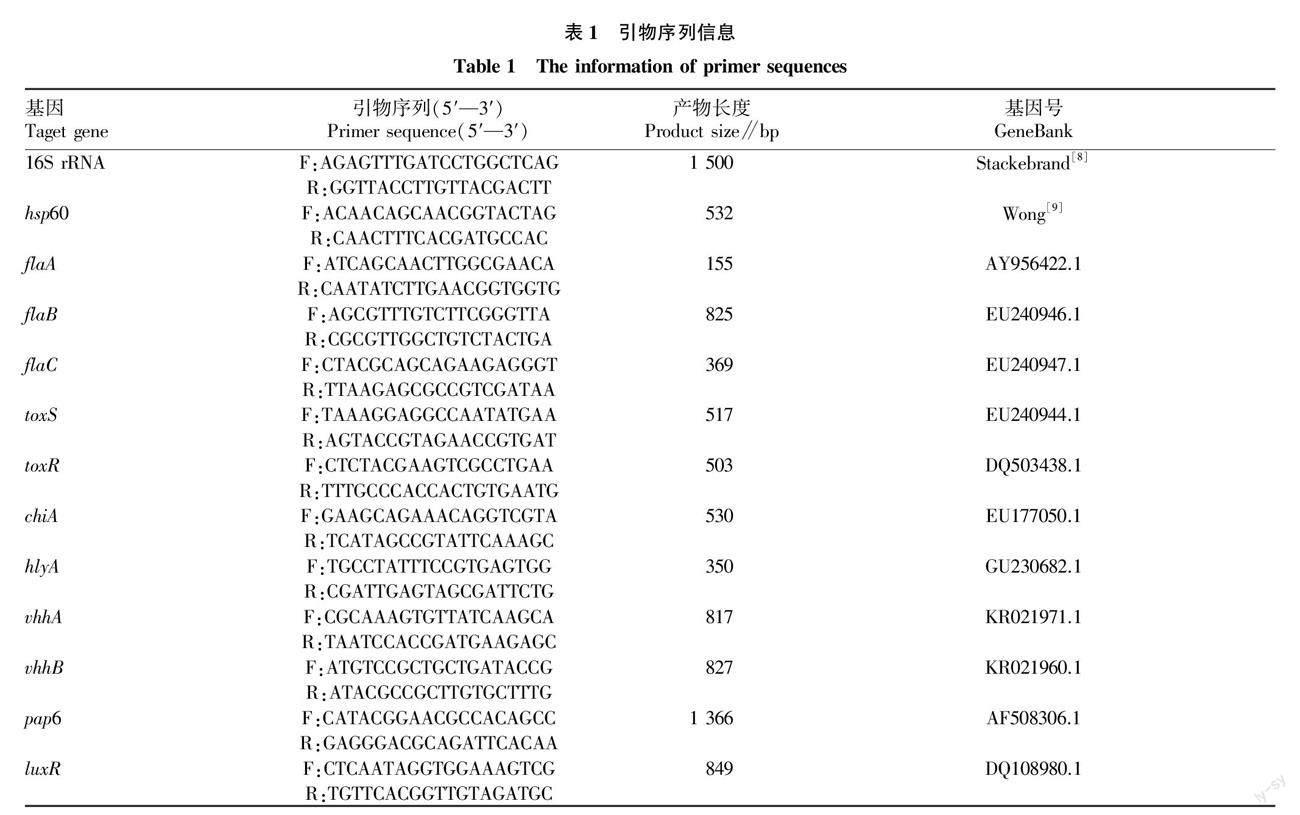
按照细菌基因組DNA提取试剂盒(购自天根生化科技有限公司)的方法提取DNA作为模板。引物(表1)由生物工程(北京)股份有限公司合成。PCR反应体系(50 μL):20 mmol/L正反向引物4 μL,2×Taq MasterMix酶(购自北京博迈德基因技术有限公司)25 μL,模板DNA 2 μL,ddH2O 19 μL。扩增程序:94 ℃,3 min,94 ℃,30 s、55 ℃,30 s、72 ℃,1 min,35个循环,72 ℃延伸7 min。测序结果利用MEGA11软件采用邻接法进行系统进化分析。
1.4 毒力基因检测 试验选取了11种毒力基因,包括鞭毛蛋白(flaA、flaB、flaC)、溶血素(vhhA、vhhB、hlyA)、毒力调控基因(toxS、toxR)、锌金属蛋白酶(pap6)、群体效应调节基因(luxR)、几丁质酶基因(chiA)。PCR扩增采用25 μL反应体系,扩增程序:94 ℃,3 min,94 ℃,30 s、58 ℃,30 s、72 ℃,1 min,35个循环,72 ℃延伸7 min。根据Primer Premier 5.0软件自行设计引物,其序列见表1。
1.5 耐药性分析
试验选取29种药敏纸片(杭州微生物试剂有限公司)测定细菌对各种抗菌药物的敏感性[10]。
1.6 组织病理分析
分别取健康和注射感染菌株TJYG-420 12 h青石斑幼鱼的皮肤、鳃丝、肠道和肝脏组织,用4%多聚甲醛溶液固定液固定,组织切片制备等参照文献[11]。
2 结果与分析
2.1 人工感染 在整个试验过程中,对照组鱼活动及进食正常,无发病或死亡情况出现。注射高浓度菌液组的鱼体死亡率为100%,而其他组的死亡率分别为30%、10%和0,经计算LD50为6×105 CFU/mL。从发病鱼体内脏中分离获得优势菌,经鉴定为哈维氏弧菌。
2.2 生理生化鉴定
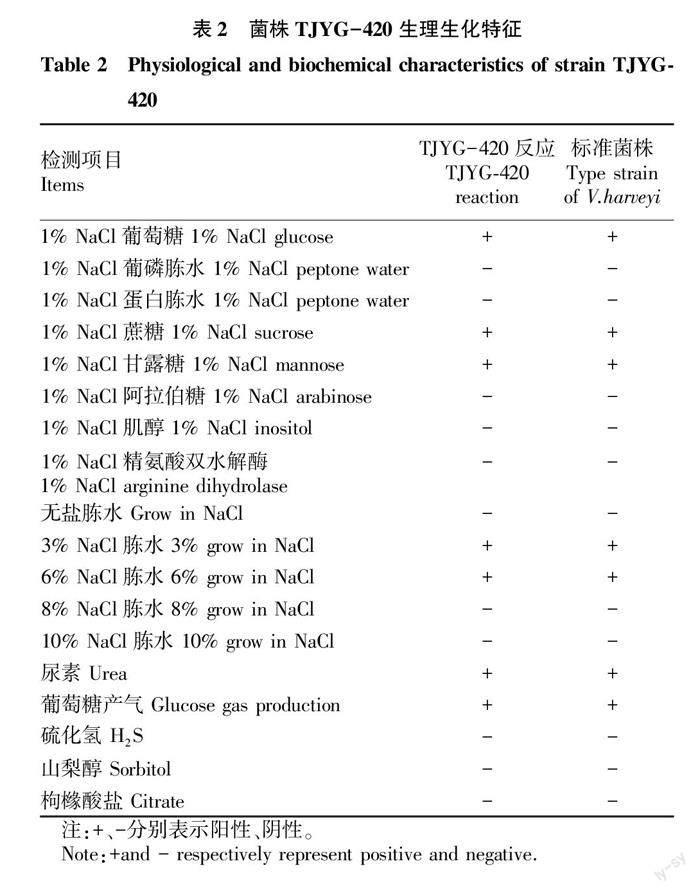
菌株TJYG-420的生理生化鉴定结果见表2。菌株TJYG-420能利用葡萄糖、蔗糖和甘露糖,发酵产气,分解尿素,能在3%~6% NaCl中生长,而在8%~10% NaCl不生长。经比对,发现其生理生化特征与哈维氏弧菌基本保持一致,初步判定为哈维氏弧菌。
2.3 分子生物学鉴定
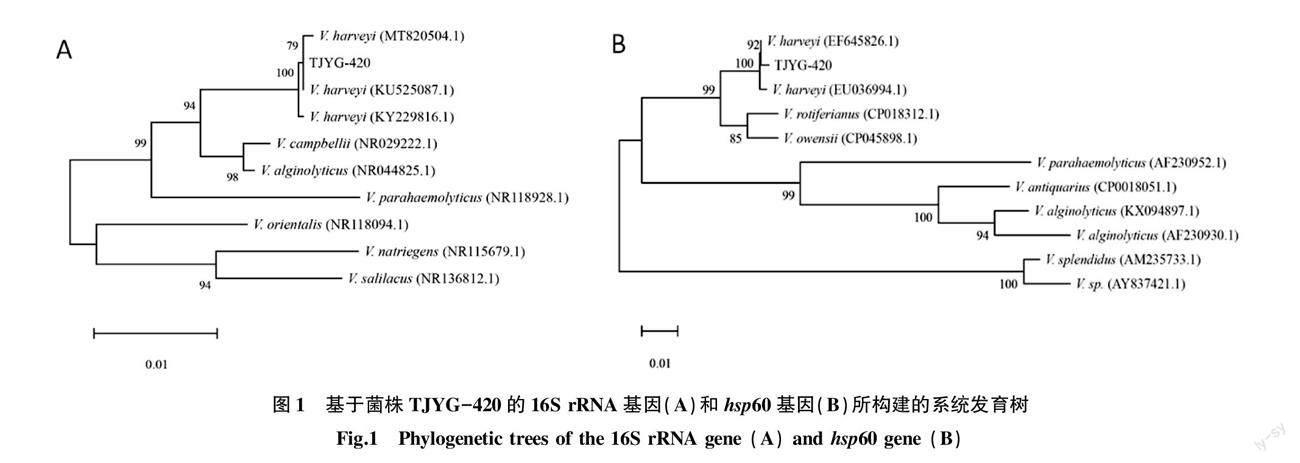
经16S rRNA基因和hsp60基因分别扩增得到大小约1 500 bp和532 bp的片段。将菌株TJYG-420的16S rRNA和hsp60基因序列在NCBI上进行同源性检索并构建系统发育树,结果显示(图1),菌株TJYG-420与哈维氏弧菌聚为一支,进一步确定TJYG-420菌株为哈维氏弧菌。
2.4 毒力基因分析
11种毒力基因检测结果显示(图2),菌株TJYG-420携带flaB、flaC、vhhA、vhhB、chiA和luxR 6个毒力基因。
2.5 耐药性分析
耐药性检测结果见表3,在抗菌药物中,菌株TJYG-420对阿奇霉素(AZM)、氯霉素(C)、奈替米星(NET)、哌拉西林(PIP)、庆大霉素(GM)、四环素类、喹诺酮类、硝基呋喃类以及头孢类等药物表现敏感,对甲硝唑(MTZ)、链霉素(S)、阿莫西林(AMX)和氨苄西林(AM) 4种药物呈耐药性。
2.6 组织病理分析
从图3可以看出,与健康鱼相比,感染鱼表现出明显的病理损伤。患病幼鱼皮肤囊状细胞增多,其细胞质成分在中心形成一个嗜酸性团块,与细胞膜分离,而杯状细胞在健康鱼体较多;病鱼鳃小片上皮细胞增生、肿胀、肥大,部分鳃细胞空泡变性,毛细血管扩张;肠黏膜固有层零星,黏膜断裂破损,部分绒毛脱落,黏膜层和结缔组织松动;肝细胞空泡变性,局部坏死。
3 讨论
生理生化特性分析是细菌鉴定的经典方法,但是该方法很难区分同一科属的不同种细菌,且试验流程烦琐,结果判定有一定的主观性。近年来,分子鉴定在细菌的分类鉴定中发挥了重要作用。16S rRNA基因是细菌鉴定中最常用的分子靶标[12],但是16S rRNA基因高度保守,对于同一属内的不同种难以很好地区分。研究表明,hsp60基因是一个编码60 kDa热休克蛋白的保守基因,其在同一属的不同种之间表现出高度的序列多样性[13]。因此,hsp60基因可用于快速、直接地从临床标本中鉴定致病性弧菌物种。笔者扩增了菌株TJYG-420的16S rRNA和hsp60基因序列,Blast比对分析发现,菌株TJYG-420的16S rRNA和hsp60基因序列与V.harveyi菌株的相似性最高。
哈维氏弧菌作为水产养殖中主要病原,其自身携带的毒力基因与其致病性密切相关。该研究对青石斑鱼致病过程起重要作用的毒力因子进行了研究。Yang等[14]从患病大黄鱼中分离出的哈维氏弧菌中携带 chiA、vhh毒力基因;吴立婷等[15]研究表明,宁德地区54株哈维氏弧菌均携带toxR、vhhA、vhhB、luxR 4个毒力基因;Peeralil等[16]研究表明,哈维氏弧菌毒力基因主要分为6种基因型,以vhpA、flaB、ser、vhh、luxR、vopD、vcrD、vscN为主;有文献数据显示[3,17],分离的哈维氏弧菌中vhh、luxR、chiA和toxR含量高于70%。分析结果显示,菌株TJYG-420携带包括鞭毛结构基因flaB、flaC,溶血素基因vhhA、vhhB,群体效应基因luxR和几丁质酶基因chiA 6个毒力基因。以上研究表明,哈维氏弧菌不同分离株之间携带的毒力基因存在差异,这也解释了哈维氏弧菌的不同分离株,其致病性存在较大的差异。
抗生素在水产养殖中用于治疗、控制和预防细菌性疾病,被视为水产养殖实践中疾病管理的工具之一。不同来源地区、不同宿主的哈维氏弧菌株耐药谱型存在差异。Shen等[18]研究发现,哈维氏弧菌对17种抗生素耐药,仅对头孢曲松、强力霉素和米诺环素3种抗生素敏感。Deng等[19]从中国患病龙胆石斑鱼中分离的哈维氏弧菌对氨苄西林、利福平、四环素等13种抗生素表现出耐药性。该研究结果显示,菌株TJYG-420仅对氨苄西林、阿莫西林、链霉素、甲硝唑4种抗生素表现出耐药性,与上述研究结果存在较大差异。这可能是由于菌株宿主、来源以及养殖过程中抗菌药使用情况存在差异所致。目前,施用化学药物仍是控制养殖鱼类细菌性疾病的重要手段之一。鉴于不同分离株的哈维氏弧菌的耐药性存在较大差异,对哈维氏弧菌的新分离株进行耐药特性分析,可为精准防控由哈维氏弧菌引起的疾病提供直接的用药参考。同时,为明确海水养殖鱼类弧菌病原耐药现状分析提供可靠的参考依据。
鱼类的第一道防线是由皮肤、鳃和肠道[20]等黏膜相关淋巴组织(MALT)组成。该研究中,感染菌株TJYG-420的石斑鱼皮肤中囊状细胞明显增加,这种变化与Mohamad等[21]研究研究結果一致。囊状细胞位于表皮的表层,在表皮损伤时释放其内容物导致酸性物质增多,颜色加深。这些细胞产生的信号以信息素、毒素形式存在,并被认为是由血清素介导的。研究发现囊状细胞还产生和分泌凝集素,凝集素可作为模式识别受体[22]。因此,囊状细胞被认为与鱼类免疫有关,有文献报道,在活跃的寄生虫感染期间,它们在鱼类皮肤中的数量显著增加了40倍[23-24]。哈维氏弧菌感染后,鳃小片上皮细胞表现为增生、肿胀、肥大,部分鳃细胞空泡变性,毛细血管扩张,这与许悦[25]的部分研究结果一致。肠道组织形态与其功能相适应,其差异主要表现在黏膜层,其中黏膜褶皱的高低和疏密、上皮细胞的完整性和数量等方面影响了肠道性能[26]。哈维氏弧菌感染后,肠道黏膜褶皱形态发生皱缩或损伤直至脱落,这与Zhang等[2]研究发现拟态弧菌感染黄颡鱼造成肠绒毛严重的变性和坏死脱落是一致的。而陈成等[27]病理结果显示,肠绒毛黏膜层仅表现为水肿变性。由于肝脏的造血功能,贫血引起的代偿性水肿可能会增加肝血管的通透性,增加肝组织中红细胞的浸润量[28],这些病理损伤上的差异都暗示了不同菌株有着不同的致病机制。综上所述,笔者推断病原体的复杂病理过程导致了一系列感染水平的发生,并推测是这些病变导致了患病鱼体多个组织器官的功能受损,进而使鱼体逐渐丧失了正常的生理代谢功能,最终导致了其发病和死亡。
参考文献
[1] LIU L,GE M F,ZHENG X Y,et al.Investigation of Vibrio alginolyticus,V.harveyi,and V.parahaemolyticus in large yellow croaker,Pseudosciaena crocea (Richardson) reared in Xiangshan Bay,China[J].Aquaculture reports,2016,3:220-224.
[2] ZHANG X,LI Y W,MO Z Q,et al.Outbreak of a novel disease associated with Vibriomimicus infection in fresh water cultured yellow catfish,Pelteobagrus fulvidraco[J].Aquaculture,2014,432:119-124.
[3] ZHU Z M,DONG C F,WENG S P,et al.The high prevalence of pathogenic Vibrio harveyi with multiple antibiotic resistance in scale drop and muscle necrosis disease of the hybrid grouper,Epinephelus fuscoguttatus (♀)×E.lanceolatus (♂),in China[J].Journal of fish diseases,2018,41(4):589-601.
[4] 李卓昱,鲍玉杰,尚玉曼,等.一株溶藻弧菌H1B6的分离与鉴定[J] .安徽农业科学,2019,47(5):100-103,146.
[5] AUSTIN B,ZHANG X H.Vibrio harveyi:A significant pathogen of marine vertebrates and invertebrates[J].Letters in applied microbiology,2006,43(2):119-124.
[6] BERGEY D H,HOLT J G.Bergeys manual of determinative bacteriology[M].9th ed.Baltimore:Williams & Wilkins,1994.
[7] 東秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8] STACKEBRANDT E,GOODFELLOW M.Nucleic acid techniques in bacterial systematics[M].Chichester:Wiley,1991.
[9] WONG R S Y,CHOW A W.Identification of enteric pathogens by heat shock protein 60 kDa (HSP60) gene sequences[J].FEMS microbiology letters,2002,206(1):107-113.
[10] 曾德乾,冯娟,徐力文,等.海水养殖鱼哈维弧菌分离株的耐药谱型分析[J].中国水产科学,2015,22(1):129-138.
[11] 王印庚,杨洋,张正,等.津冀地区养殖三疣梭子蟹大量死亡的病原和病理分析[J].中国水产科学,2017,24(3):596-605.
[12] BUSSE H J,DENNER E B M,LUBITZ W.Classification and identification of bacteria:Current approaches to an old problem.Overview of methods used in bacterial systematics[J].Journal of biotechnology,1996,47(1):3-38.
[13] GOH S H,POTTER S,WOOD J O,et al.HSP60 gene sequences as universal targets formicrobial species identification:Studies with coagulase-negative staphylococci[J].Journal of clinical microbiology,1996,34(4):818-823.
[14] YANG A M,LI W Y,TAO Z,et al.Vibrio harveyi isolated from marine aquaculture species in eastern China and virulence to the large yellow croaker (Larimichthys crocea)[J].Journal of applied microbiology,2021,131(4):1710-1721.
[15] 吴立婷,廖金轩,庞茂达,等.大黄鱼中哈维氏弧菌毒力及耐药特性分析[J].食品安全质量检测学报,2019,10(8):2111-2119.
[16] PEERALIL S,JOSEPH T C,MURUGADAS V,et al.Vibrio harveyi virulence gene expression in vitro and in vivo during infection in black tiger shrimp Penaeus monodon[J].Diseases of aquatic organisms,2020,139:153-160.
[17] BLUFORD J,GAUTHIER D,COLASANTO M,et al.Identification of virulence genes in Vibrio spp.isolates from the 2009 Bermuda reef fish mortality event[J].Journal of fish diseases,2017,40(4):597-600.
[18] SHEN G M,SHI C Y,FAN C,et al.Isolation,identification and pathogenicity of Vibrio harveyi,the causal agent of skin ulcer disease in juvenile hybrid groupers Epinephelus fuscoguttatus× Epinephelus lanceolatus[J].Journal of fish diseases,2017,40(10):1351-1362.
[19] DENG Y Q,XU H D,SU Y L,et al.Horizontal gene transfer contributes to virulence and antibiotic resistance of Vibrio harveyi 345 based on complete genome sequence analysis[J].BMC genomics,2019,20(1):1-19.
[20] CHIENG C C Y,DAUD H M,YUSOFF F M,et al.Mucosal responses of brown-marbled grouper Epinephelus fuscoguttatus (Forsskl,1775) following intraperitoneal infection with Vibrio harveyi[J].Journal of fish diseases,2020,43(10):1249-1258.
[21] MOHAMAD N,MOHD ROSELI F A,AZMAI M N A,et al.Natural concurrent infection of Vibrio harveyi and V.alginolyticus in cultured hybrid groupers in Malaysia[J].Journal of aquatic animal health,2019,31(1):88-96.
[22] TSUTSUI S,SUZUKI Y,SHIBUYA K,et al.Sacciform cells in the epidermis of fugu (Takifugu rubripes) produce and secrete kalliklectin,a novel lectin found in teleosts[J].Fish & shellfish immunology,2018,80:311-318.
[23] CHIVERS D P,WISENDEN B D,HINDMAN C J,et al.Epidermal ‘alarm substancecells of fishes maintained by non-alarm functions:Possible defence against pathogens,parasites and UVB radiation[J].Proceedings of the royal society B,2007,274(1625):2611-2619.
[24] PICKERING A D,FLETCHER J M.Sacciform cells in the epidermis of the brown trout,Salmo trutta,and the Arctic char,Salvetinus alpinus[J].Cell and tissue research,1987,247(2):259-265.
[25] 許悦.海南地区养殖石斑鱼两种细菌性疾病病原病理学研究[D].海口:海南大学,2018.
[26] 夏青,王宝杰,刘梅,等.哈维氏弧菌浸浴后凡纳滨对虾肠道组织病理变化及转录水平的免疫应答[J].水产学报,2015,39(10):1521-1529.
[27] 陈成,耿毅,汪开毓,等.拟态弧菌感染黄颡鱼的动态病理损伤及病原分布研究[J].南方水产科学,2017,13(1):10-18.
[28] MUSSO G,CASSADER M,PASCHETTA E,et al.Thiazolidinediones and advanced liver fibrosis in nonalcoholic steatohepatitis:A meta-analysis[J].JAMA internal medicine,2017,177(5):633-640.
